
- •Особенности действия и применения лекарственных средств у детей
- •Курск – 2009
- •Содержание
- •Предисловие
- •Основные сокращения
- •Особенности фармакокинетики у детей
- •Особенности биотрансформации и применения лекарств при наследственных ферментопатиях у детей
- •Особенности фармакодинамики у детей
- •Механизмы действия лекарственных веществ в организме
- •Взаимодействие с рецепторами
- •Влияние на активность ферментов (ложные субстраты и ингибиторы ферментов).
- •III. Физико-химическое действие на мембраны клеток
- •Блокаторы транспортных систем
- •Виды действия при повторных введениях лс:
- •Отрицательные виды действия лп во время беременности
- •Дозирование лекарственных средств у детей
- •Возрастные особенности детского организма
- •Возрастные значения некоторых физиологических факторов для оценки действия и применения лекарств
- •Средства, влияющие на м-холинорецепторы
- •Симптоматика отравления атропином
- •Средства, влияющие на н - холинорецепторы
- •Классификация
- •Особенности действия и применения миорелаксантов у детей
- •По длительности действия
- •Миорелаксанты, применяемые в анестезии у детей
- •Антихолинэстеразные средства (непрямые холиномиметики)
- •3.1. Адреномиметики
- •Взаимодействия адреномиметиков
- •3.2. Адреноблокаторы и симпатолитики
- •4.1. Местные анестетики
- •По химической структуре.
- •1) Группа сложных эфиров пабк:
- •2) Группа сложных амидов:
- •III. По выраженности эффекта и длительности действия при парентеральном введении (табл. 8):
- •Побочные эффекты ма, связанные с резорбтивным действием
- •Метгемоглобинемия.
- •Абсолютные противопоказания к регионарной анестезии у детей:
- •Взаимодействия
- •Средства для ингаляционного наркоза
- •Физико-химические свойства ингаляционных анестетиков
- •Увеличение активности недеполяризующих миорелаксантов.
- •4.3. Средства для внутривенного наркоза
- •Средства, применяемые при нарушениях сна
- •Снотворные с наркотическим действием:
- •Дозирование и способы применения мидозалама в премедикации
- •5.2. Противосудорожные средства
- •Механизм действия противоэпилептических средств
- •Характеристика препаратов
- •Принципы медикаментозного лечения эпилепсии у детей
- •Характеристика препаратов
- •5.3. Нейролептики
- •Классификация
- •Механизм антипсихотического действия нейролептиков
- •Побочные эффекты нейролептиков
- •Цнс: усталость, сонливость, внутреннее беспокойство, спутанность сознания. Злокачественный нейролептический синдром (гипертермия, нарушение сознания, экстрапирамидные реакции).
- •5.4. Транквилизаторы
- •Применение
- •5.5. Седативные средства
- •Фармакодинамика морфина
- •«Мозаичность» действия на цнс
- •Передозировка (острое отравление)
- •Меры помощи
- •Синдром отмены
- •Гиперактивность вегетативной нервной системы:
- •Мышечная и суставная боль.
- •Взаимодействия
- •Психостимуляторы
- •Показания к применению
- •Основные фармакологические свойства кофеина
- •Ноотропные препараты (noos - мышление, разум, tropos - сродство).
- •Особенности ноотропов
- •Классификация
- •Аналептики (от греч analeptikos - восстанавливающий, укрепляющий, оживляющий).
- •Адаптогены
- •Фармакодинамика адаптогенов:
- •Классификация ненаркотических анальгетиков
- •Классификация нестероидных противовоспалительных средств
- •Применение салицилатов
- •Побочные эффекты
- •Симптомы острого отравления аспирином у детей
- •Анальгетики - антипиретики
- •Меры помощи:
- •Производные индола
- •Производные пропионовой кислоты
- •Производные антраниловой кислоты
- •Принципы жаропонижающей терапии у детей
- •Заключение
- •Формы выпуска и дозирование нпвс
- •9.1. Противоаллергические средства
- •Показания к применению иммунодепрессантов у детей
- •Иммуностимуляторы
- •Антигистаминные средства
- •Классификация н1–гистаминоблокаторов
- •Фармакологическая характеристика препаратов 1-го поколения
- •Фармакологическая характеристика препаратов 2 поколения
- •Фармакологическая характеристика препаратов 3 поколения
- •Сердечные гликозиды
- •Механизм действия
- •Другие кардиальные эффекты сг
- •Показания к применению сг
- •Токсическое действие сердечных гликозидов
- •Проявления токсических эффектов сг
- •Меры помощи
- •Профилактика интоксикации сердечными гликозидами
- •Противоаритмические средства
- •Основные показания к назначению хинидина
- •Дилтиазем.
- •Антигипертензивные средства
- •Феохромоцитома.
- •Поздний токсикоз беременности.
- •Медикаментозное лечение артериальной гипертензии
- •Побочные эффекты β-адреноблокаторов:
- •Блокаторы кальциевых каналов
- •Основные побочные эффекты:
- •Ингибиторы апф
- •Антагонисты рецепторов ангиотензина II
- •Некоторые антигипертензивные средства, полезные при амбулаторном лечении гипертонии у детей
- •Общая характеристика
- •Побочные эффекты:
- •Общая характеристика
- •Применение фуросемида у детей
- •Осложнения у детей
- •Сочетанное применение диуретиков и лекарственных препаратов других групп
- •12.1. Противокашлевые средства
- •Заболевания дыхательных путей у детей, сопровождающиеся кашлем
- •Противокашлевые препараты
- •12.2. Отхаркивающие средства
- •Особенности действия муколитиков
- •12.3. Бронхолитические средства
- •Классификация ингибиторов фосфодиэстеразы
- •12.4. Средства терапии бронхиальной астмы
- •Ингаляционные гкс, применяемые при бронхиальной астме у детей
- •Комбинированные препараты двойного действия:
- •Преимущества небулайзерной терапии:
- •13.1. Средства, повышающие моторику жкт
- •Слабительные средства
- •13.2. Противоязвенные препараты
- •Классификация блокаторов н2–гистаминорецепторов
- •Сравнительная фармакокинетика блокаторов н2-гистаминорецепторов
- •Сравнительная эффективность блокаторов н2 – гистаминорецепторов
- •Взаимодействия блокаторов н2-гистаминорецепторов
- •Ликвидация н. Pylori
- •Схемы антибактериальной терапии язвенной болезни против h. Pylori
- •1. Тройная терапия препаратами висмута.
- •2. Тройная терапия с применением н2-блокаторов.
- •3. Тройная терапия с ингибиторами протонового насоса.
- •4. Квадротерапия.
- •Препараты, которые применяются для эрадикации h. Pylori у детей
- •Монокомпонентные препараты
- •13.3. Средства, влияющие на функцию печени и поджелудочной железы
- •Лечение панкреатита у детей
- •Основные принципы лечения
- •Причины нарушения свертывания крови у детей:
- •14.1. Лекарственные средства, понижающие свертываемость крови
- •1. Антикоагулянты:
- •Фармакодинамика гепарина
- •Показания к применению гепарина:
- •Побочные эффекты:
- •14.2. Лекарственные средства, способствующие свертыванию крови и остановке кровотечений (гемостатики)
- •2. Ингибиторы фибринолиза и антагонисты гепарина:
- •3. Гемостатики разных групп:
- •Назначение викасола с профилактической целью:
- •Назначение викасола с лечебной целью:
- •15.1. Бета - лактамные антибиотики
- •Комбинированные
- •Спектр активности природных пенициллинов
- •Комбинации пенициллинов с ингибиторами бета-лактамаз
- •Побочные эффекты пенициллинов
- •Цефалоспорины
- •Классификация цефалоспоринов
- •Препараты I поколения
- •Препараты II поколения
- •Препараты III и IV поколений
- •Карбапенемы
- •Преимущества меропенема перед имипенемом
- •Монобактамы
- •15.2. Макролиды
- •Общие свойства
- •Применение макролидов в педиатрии
- •15.3. Аминогликозиды
- •Побочные эффекты
- •15.4. Антибиотики широкого спектра действия
- •Побочные эффекты
- •Взаимодействия антибиотиков
- •16.1. Сульфаниламидные препараты
- •Характеристика препаратов
- •Показания к применению бисептола:
- •Побочное действие сульфаниламидов
- •Гепатотоксическое действие.
- •Гипогликемия.
- •Лекарственные взаимодействия сф-амидов
- •16.2. Хинолоны. Фторхинолоны
- •Преимущества фторхинолонов
- •I. По фармакодинамике:
- •II. По фармакокинетике:
- •III. По переносимости:
- •Недостатки фторхинолонов
- •Применение:
- •16.3. Нитрофураны
- •Побочные эффекты нитрофуранов
- •Противопоказания
- •16.4. Нитроимидазолы
- •Показания
- •17.1. Противотуберкулезные средства
- •Классификация противотуберкулезных препаратов
- •Фармакологическая характеристика препаратов 1 ряда
- •Побочные эффекты
- •Фармакологическая характеристика препаратов 2 ряда
- •Основные принципы двухэтапной антибактериальной терапии туберкулеза (воз)
- •17.2. Противогрибковые средства
- •Классификация противогрибковых препаратов
- •17.3. Противовирусные средства
- •Классификация интерферонов
- •Виды гормональной терапии:
- •Гормоны белковой и полипептидной природы
- •Препараты задней доли гипофиза
- •Препараты гормонов поджелудочной железы
- •Классификация препаратов инсулина
- •I. По происхождению:
- •Генно – инженерные инсулины
- •II. По способу очистки (чистоте):
- •III. По скорости наступления эффектов и продолжительности действия (видоспецифические) человеческие инсулины
- •Механизм действия инсулина
- •Осложнения инсулинотерапии
- •Производные аминокислот
- •Препараты стероидных гормонов
- •Глюкокортикостероиды (гкс)
- •1. Влияние на белковый обмен.
- •7. Антиаллергическое и иммунодепрессивное действие.
- •Показания к применению гкс у детей
- •Тактика лечения глюкокортикоидами
- •Схемы назначения гкс
- •Побочные эффекты гкс
- •Взаимодействия гкс
- •Препараты половых гормонов
- •Препараты женских половых гормонов
- •Препараты мужских половых гормонов (андрогены)
- •1) Тестостерона пропионат
- •2) Тестостерона энантат
- •Анаболические стероиды
- •Побочные эффекты
- •Группы риска развития дефицита витаминов:
- •19.1. Жирорастворимые витамины и их препараты
- •Применение витамина д в педиатрии
- •Фармакодинамика:
- •Показания к применению:
- •Показания к применению:
- •19.2. Водорастворимые витамины и их препараты
- •Показания к применению
- •Показания к применению
- •Показания к применению c целью профилактики
- •Показания к применению c лечебной целью
- •Поливитамины
- •Наследственные нарушения эритропоэза;
- •Недостаточность меди и магния.
- •Причины дефицита железа
- •Основными причинами дефицита железа у детей всех возрастных групп являются:
- •Группы риска
- •Принципы назначения и дозирования препаратов железа у детей
- •Фармакокинетика железа
- •Классификация препаратов железа
- •Сравнительная характеристика препаратов железа для перорального применения
- •Побочные эффекты препаратов железа:
- •Отравление железом
- •Средства, применяемые при гиперхромных анемиях
- •Средства, стимулирующие лейкопоэз
- •Факторы риска возникновения лейкозов
- •Акселерация физического развития.
- •Современные препараты – регуляторы гемопоэза
- •Критические периоды органогенеза
- •Факторы, способствующие проникновению лекарств через плаценту:
- •Лекарственные средства, абсолютно противопоказанные в период беременности
- •Частные вопросы действия и применения лекарств при беременности
- •Мутагенное действие лекарственных (химических) веществ на плод
- •Особенности применения и действия лекарств при кормлении грудью
- •Лекарственные средства, противопоказанные кормящим матерям
- •Лекарственные средства, разрешенные кормящим матерям:
- •Лекарственные формы препаратов для детей
- •Некоторых фармацевтических, фармакологических и клинических терминов и понятий
- •Список литературы:
- •305041, Г. Курск, ул. К. Маркса, 3.
- •305041, Г. Курск, ул. К. Маркса, 3. Заказ № 169.
Особенности фармакокинетики у детей
При введении ребенку лекарственного препарата осуществляются процессы его всасывания, распределения, связывания, метаболизма и выделения.
Всасывание лекарственных веществ - это процесс поступления препарата из места введения в кровь. Характер и интенсивность всасывания препарата при приеме внутрь зависит как от фармацевтических факторов (лекарственная форма, растворимости и др.), так и анатомо-физиологических факторов ЖКТ.
Лекарственная форма играет существенную роль в обеспечении лечебного эффекта препарата. Особенно очевидна роль лекарственной формы при выборе и назначении лекарств детям.
Нужны такие формы, в которых имелась бы не только дозировка, предназначенная для конкретной возрастной группы, но и максимально учитывали бы психофизиологические особенности детского организма (формы с улучшенным вкусом, приятным запахом, красивым внешним оформлением и т.д.). И такие специальные лекарственные формы для детей – pro infantibus (for children) в настоящее время созданы (например, диазолин, парацетамол, декарис, називин, мальтофер и др.).
Среди условий, влияющих на силу, скорость и характер развития эффекта лекарственных веществ у детей, важное место занимают пути их введения.
Прием лекарств через рот (per os) в детской практике для большой группы препаратов является основным. При достаточно обоснованном выборе лекарственной формы он дает вполне удовлетворительные результаты. Основные преимущества – удобство, доступность, естественность введения препарата в организм, не требуется соблюдения стерильности. Начало эффекта через 20-40 мин.
ЛВ всасывается и попадает в систему воротной вены печени, где уже при первом прохождении подвергается биотрансформации (метаболизму).
Доля дозы лекарства от введенного внутрь, которая поступает по полой вене в системный кровоток в активной форме, соответствует понятию биоусвояемость (биодоступность) лекарства.
Фармацевтические факторы, влияющие на всасывание препаратов в ЖКТ.
Лекарственная форма и агрегатное состояние (время дезинтеграции и растворения таблетки, наличие примесей в составе таблетки или оболочки). Лекарственные вещества в дисперсной форме, или эмульгированные, всасываются лучше.
Химико-физическое строение ЛВ. Миорелаксанты - препараты, содержащие четырехвалентный атом азота N (тубокурарин, дитилин и др.), совершенно не проникают через липидный слой клеток, а поэтому их необходимо вводить только внутривенно.
Таким образом, зная физико-химические свойства лекарственного средства и характеристику процессов его проникновения через различные тканевые барьеры, можно предсказать, как тот или иной препарат будет всасываться в кровь, распределяться в органах и тканях, выводиться из организма.
Скорость и степень всасывания лекарств зависят и от того, является ли вещество преимущественно водорастворимым (ионизированным, диссоциированным) или жирорастворимым (неионизированным), т.е. является ли лекарство слабой кислотой или слабым основанием.
pH среды определяет степень ионизации молекул слабых кислот и слабых оснований. Поэтому, изменяя рН среды, можно ускорить, например всасывание или выделение лекарственного вещества.
Физиологические факторы, влияющие на всасывание лекарств в ЖКТ:
уровень кислотности (рН) в просвете желудка и кишечника;
уровень содержания желчных кислот (соли желчных кислот замедляют всасывание нистатина, полимиксина, ванкомицина, при образовании нерастворимых комплексов);
инактивация ферментами белковых или полипептидных веществ (кортикотропин, вазопрессин, инсулин и др.), а также некоторых гормональных препаратов (прогестерон, тестостерон, альдостерон). Значительно более высокая активность -глюкуронидазы 12-перстной кишки у детей первых месяцев жизни и особенно новорожденных обеспечивает деконъюгацию некоторых антибактериальных препаратов, выводимых с желчью, что в свою очередь вызывает их последующую реабсорбцию в кровь и увеличение концентрации;
время опорожнения желудка и время прохождения пищи через кишечник (моторика, перистальтика);
соотношение протяженности кишечника (площадь поверхности слизистой) и массы тела. Оно существенно больше у детей, чем у взрослых. У детей первых месяцев жизни и новорожденных возможности для абсорбции препаратов значительно выше, чему также способствуют замедленная эвакуация содержимого кишечника, нерегулярная перистальтика;
заболевания ЖКТ (колиты, инфекции, дисбактериоз);
интенсивность кровотока в кишечнике;
присутствие в ЖКТ других субстанций (препараты, ионы, компоненты пищи, ее объем и состав, интервал времени между едой и приемом лекарств):
молоко, соли железа, ионы Ca, Mg, Fe (яблоки), а также высокое содержание жира в пище нарушают всасывание тетрациклинов, ампициллина и амоксициллина, изониазида, но повышают всасывание гризеофульвина;
прием различных соков приводит к сдвигу pH в кислую сторону, что приводит к распаду кислотонеустойчивых лекарств (эритромицин).
Однако при всей простоте пероральный путь введения лекарств не лишен весьма существенных недостатков, наличие которых особенно важно учитывать в детской фармакотерапии:
трудность, иногда невозможность применения этого способа в педиатрии;
влияние вкуса, запаха, цвета лекарств;
неэффективность назначения многих препаратов (большинство антибиотиков, ферменты, гормоны и т.д.);
зависимость скорости всасывания от различных анатомо-физиологических факторов детского организма (секреция, кислотность, моторика, влияние пищеварительных ферментов, состояние флоры кишечника, особенности питания и пищи и др.);
многие лекарственные вещества вызывают у детей тошноту и рвоту.
В педиатрической практике наиболее широко используются жидкие лекарственные формы, которые составляют около 70% в общем количестве лекарств в педиатрии.
Из них более 50% приходится на лекарства для внутреннего применения. Большой популярностью пользуются пероральные жидкие формы – растворы, микстуры, капли, настои, отвары, эмульсии, суспензии.
Это основано на безболезненности их применения, точности дозирования, равномерности и быстроте всасывания и выделения из организма ребенка. Но в жидких формах наиболее отчетливо проявляются вкус и запах, в связи с чем, для детей требуется подбор специальных растворов, вспомогательных и корригирующих веществ.
Корригирующие вещества должны придавать лекарству приятный вкус, запах и красивый внешний вид, а также хорошо смешиваться с основным (базисным) лекарственным веществом и не снижать его активности и стабильности. Существуют маскирующие составы, содержащие лимонный, вишневый, абрикосовый, банановый, черносмородиновый и другие сиропы. Для устранения интенсивно-горького вкуса применяют мед и медовый сироп. Синтетические сладкие вещества и эссенции в педиатрической практике в настоящее время не применяются.
Следует учитывать, что на фоне сиропов может снижаться активность лекарственных веществ, замедляться всасывание и выведение их из организма. Это особенно надо учитывать при необходимости создания в организме высоких концентраций таких средств, как антибиотики, сульфаниламиды и др.
Из твердых лекарственных форм в педиатрии чаще используют порошки для внутреннего и наружного применения. Детям до двух лет обычно не назначают таблетки, имеющие низкую биодоступность, и детям труднее их проглатывать. Детям старшего возраста широко назначают таблетки и другие твердые лекарственные формы – гранулы, капсулы и микрокапсулы, особенно с кишечнорастворимым покрытием.
Гранулированные лекарственные формы, предназначенные для детей первых лет жизни и младшего дошкольного возраста, особо удобны в употреблении.
Преимуществами инъекционного пути введения лекарственных веществ являются быстрота наступления терапевтического эффекта, отсутствие на пути всасывания и метаболизма препаратов достаточно эффективных ферментных систем, инактивирующих лекарственные вещества, возможность регулировать содержание препарата в кровяном русле и т.д.
Характер и интенсивность всасывания препарата при парентеральном введении прежде всего зависят от состояния гемодинамики и тканевого метаболизма.
Однако инъекционный путь введения имеет серьезные недостатки, особенно остро проявляющиеся в детской практике: наличие боли, возможность внесения инфекции, повреждение нервно-сосудистых образований и др.
Всасывание при внутрикожном и подкожном введении у новорожденных и грудных детей значительно выше, чем у старших детей. Как известно, всасывание через кожу обратно пропорционально толщине зернистого слоя и прямо пропорционально гидрофильности кожи.
Поскольку у новорожденных детей зернистый слой тоньше, чем у взрослых, через кожу новорожденных легко проникают многие химические вещества, которые могут вызвать тяжелое отравление.
При внутривенном введении лекарственное вещество сразу и полностью попадает в кровоток.
В некоторых случаях (при невозможности введения препарата внутрь или парентерально) прибегают к ректальному введению лекарственных средств.
Ректальный путь введения лекарственных веществ характеризуется быстротой всасывания препаратов в прямой кишке, простотой назначения, возможностью применения лекарственных веществ, разрушаемых пищеварительными соками, поступлением большей части адсорбированного препарата через ректальные вены непосредственно в систему общего кровотока.
Этот путь введения лекарств позволяет добиться такой же скорости всасывания веществ, как при пероральном введении, не раздражая пищеварительный тракт. При ректальном применении лекарств нежелательные явления, возникающие при оральном способе, у детей (тошнота и рвота) не наблюдаются.
В педиатрии достаточно широко распространены ректальные желатиновые капсулы в форме удлиненной капли, например ректокапсулы, содержащие антибиотики, анальгетики, антипиретики, транквилизаторы, седативные и другие средства.
Часто у детей используют ректальные суппозитории и ректальные мази (в специальных тубах). В последние годы в России и за рубежом номенклатура суппозиториев увеличилась. В суппозиториях как лекарственной форме сконцентрированы все преимущества, присущие ректальному способу введения лекарств: быстрота всасывания, удобство назначения, возможность щадящего воздействия на местный и общий патологический процесс. В суппозиториях можно совмещать лекарственные вещества с самыми разнообразными фармакологическими и физико-химическими свойствами.
Детские суппозитории спазмолитического действия применяются в основном для лечения распространенных в раннем возрасте спастических заболеваний, в особенности дыхательных путей, сопровождающихся сильным кашлем, удушьем и ухудшением общего состояния, при гипертермии.
Ректальные мази применяются в детской практике как с целью локального, так и резорбтивного действия. Весьма широко назначаются они для облегчения дефекации у детей, обычно выпускаются в тубах с наконечниками.
Клизма как лекарственная форма существует и используется в детской практике достаточно давно. Широко пользовались водно-мыльными, водно-глицериновыми и масляными очистительными, питательными и лечебными клизмами. В настоящее время в виде детских клизм прописывают рентгеноконтрастные вещества, спазмолитические, противосудорожные средства, анестетики, гормональные препараты.
Несмотря на высокую эффективность клизм в различных областях педиатрии, существенными недостатками данной лекарственной формы являются необходимость определенной аппаратуры, подготовительного момента и экстемпоральный характер рецептуры.
В последние годы за рубежом в детской медицинской практике большое распространение подучили лекарственные микроклизмы заводского изготовления в виде пластмассовых баллончиков, емкостью 2-3 мл – так называемые ректиоли. Они рассчитаны на разовое использование и имеют несомненное преимущество перед клизмами. Сохраняя высокие резорбционные свойства, ректиоли имеют высокую точность дозирования лекарственных веществ, просты в применении. В виде ректиолей в настоящее время широко назначают снотворные, жаропонижающие средства, гормоны и др.
Описано применение в детской практике слабительных ректиолей, в которых в качестве действующих веществ используют растворы препаратов, специфически действующих на рецепторы слизистой оболочки кишечника.
В педиатрической практике мягкие лекарственные формы применяются реже, чем твердые и жидкие. Из мягких форм в педиатрии чаще применяют мази и линименты, реже – пасты.
Среди мягких лекарственных форм для наружного применения в педиатрии большое место занимают мази, а также трансдермальные системы – пластыри.
Структура и физиология детской кожи существенно отличаются от кожи взрослых. Поэтому необходим четко обоснованный подход к составлению прописей мазевых основ и мазей для детей.
Для кожи новорожденных в качестве мазевой основы вместо вазелина и ланолина предложены основы, обладающие меньшим раздражающим действием и содержащие полиэтиленгликоли 3000 и 4000, спирт цетиловый, моноолеат, полиоксиэтилированный сорбитан (твин - 80) и др.
Такие мазевые основы обладают удовлетворительными структурно-механическими свойствами, обеспечивающими легкость их нанесения на кожу, гомогенность и устойчивость в процессе хранения. Введение в состав указанных основ 10% поливинилбутилового эфира позволяет получить выраженное лечебное действие при так называемом пеленочном дерматите и пиодермиях у новорожденных.
Трансдермальный способ введения лекарств у детей (назначение лекарств через неповрежденную кожу для получения резорбтивного эффекта) используется только в крайних случаях из-за практической непроницаемости кожи в отношении большинства лекарственных веществ.
Увеличить биодоступность активных компонентов мази через неповрежденную кожу возможно в случае применения в составе мази поверхностно-активных веществ, солюбилизаторов, а также применения паровых компрессов.
Трансдермальный путь введения лекарственных средств используется для локального воздействия на патологический процесс. К недостаткам данного пути введения можно отнести трудность регулирования дозировкой, раздражающее действие и др. Поэтому этот способ введения лекарственных средств в детской практике применяется редко. Кроме того, возможны случаи отравления детей грудного возраста лекарственными веществами, наносимыми на кожу, в частности борной кислотой.
Распределение. После абсорбции лекарственные вещества попадают, как правило, в кровь, а затем разносятся в разные органы и ткани.
В зависимости от характера распределения лекарственного вещества, оно будет распределяться в крови, тканях и органах равномерно или неравномерно, что определяется следующими факторами:
объемом внеклеточной жидкости;
растворимостью ЛВ в воде или липидах;
степенью связывания с белками плазмы крови;
интенсивностью регионарного кровотока;
сродством препарата к тем или иным тканям (например, йод накапливается в тканях щитовидной железы, а тетрациклины избирательно накапливаются в костной ткани, в частности, зубах. Зубы, особенно у детей, могут приобрести желтую окраску).
Первая фаза распределения зависит от кровотока, например поступление ЛВ в органы с хорошим кровоснабжением (сердце, печень, мышцы). Вторая фаза зависит от связывания с белками. Основные связывающие белки: 1) альбумины, образующие комплекс с лекарственными средствами – кислотами; 2) α1 - кислый гликопротеин, образующий комплекс с лекарственными средствами – основаниями.
Большинство лекарственных средств первоначально распределяется во внеклеточной жидкости.
Объем экстрацеллюлярной жидкости и концентрация белка в плазме крови зависят от возраста и степени морфофункциональной зрелости.
К особенностям распределения как водорастворимых, так и жирорастворимых лекарственных средств относится преобладание внеклеточной жидкости в организме ребенка.
Так, аминогликозиды, атропин и некоторые другие лекарственные препараты, распределяющиеся в основном в жидкой среде организма, детям назначают в большей дозе на кг массы тела, чем взрослым.
Общий объем жидкости у недоношенных новорожденных составляет 85%, 70% - у доношенных новорожденных, В течение первых трех месяцев жизни объем внеклеточной жидкости снижается почти в 1,5 раза. В последующем снижение объема внеклеточной жидкости происходит более медленно. У детей старше одного года объем составляет 60%, и 50% - у взрослых лиц.
Чем меньше объем жидкости в организме, тем выше конечная концентрация водорастворимых препаратов в плазме. Причем чем младше ребенок или чем он менее морфофункционально зрелый, тем больше экстрацеллюлярной жидкости содержат ткани его организма.
Поэтому у детей замедляется время достижения пиковой концентрации в крови, т.е. позднее возникает терапевтический эффект.
У детей с увеличением возраста, доза водорастворимых препаратов для поддержания равнозначных терапевтических концентраций в плазме уменьшается.
Растворимость лекарственных веществ в липидах определяет способность его проникать через биологические барьеры – стенку капилляров, клеточные мембраны, являющиеся основными структурами различных гистогематических барьеров (гематоэнцефалический и плацентарный барьеры). Например, средства для наркоза легко проникают через ГЭБ, а также могут образовывать жировые депо).
Связывание лекарственного вещества белками плазмы и печени обусловливает снижение его концентрации в месте действия, влияет на распределение препарата и может изменять выраженность и продолжительность фармакологического эффекта.
Лекарственная субстанция, находящаяся в комплексе с белком, лишена своей специфической активности. Некоторые эндогенные вещества могут вытеснять лекарственные субстанции из комплекса с белками плазмы и наоборот. Так, сульфаниламиды или салицилаты вытесняют билирубин из комплекса с альбумином. В результате за счет вытеснения билирубина, повышается его количество в крови, что может привести, например, к развитию желтухи у новорожденных. В то же время сам билирубин может вытеснять лекарственный препарат из комплекса с альбумином, вызывая повышение фармакологической активности лекарственного средства и объема его распределения.
Способность к связыванию и степень связывания антибиотика с белками плазмы, также оказывает существенное влияние на транспорт антибиотика к тканям организма, в первую очередь к очагу или очагам воспаления.
Для детей раннего возраста, особенно для новорожденных и недоношенных детей, характерен низкий уровень альбумина в плазме крови.
Это будет снижать эффективность антибиотиков. Например, низкая антибактериальная активность цефтриаксона у новорожденных детей, страдающих гнойным менингитом, у детей с гипотрофией, а также у детей с тяжелыми диареями.
К антибиотикам, антибактериальная активность которых практически не зависит от уровня белков плазмы, относятся такие цефалоспорины, как цефазолин (кефзол, цефамезин), цефамандол (кефадол), цефотаксим (клафоран), цефуроксим, цефтазидим (фортум).
Связывающая способность альбуминов плазмы у новорожденных и детей первого года жизни ниже, чем у взрослых, что может обусловить более сильное действие некоторых препаратов. Кроме того, это также может явиться причиной возникновения побочных реакций при концентрации препарата в плазме, безопасной для взрослых.
Некоторые цефалоспориновые антибиотики, в частности цефтриаксон (роцефин, лонгацеф), в обычных терапевтических дозах способны связывать свободные рецепторы альбумина, тем самым задерживая связывание и выведение билирубина из тканей.
Это также вызывает развитие желтухи, а в периоде новорожденности может стать причиной развития ядерной энцефалопатии. Подобным же действием обладает цефоперазон (цефобид) в высоких концентрациях. Этому дополнительно способствуют низкий уровень альбумина, низкая активность глюкуронилтрансферазы печени, более высокая проницаемость ГЭБ по отношению к билирубину и более высокий уровень лизиса эритроцитов (в результате которого и образуются повышенные количества непрямого билирубина).
На распределение лекарственных средств влияют и другие факторы. Для детей характерна повышенная проницаемость капилляров и гематоэнцефалического барьера.
Биотрансформация (метаболизм) лекарственных веществ осуществляется преимущественно в печени, но происходит также в надпочечниках, почках, кишечнике, коже.
Для детей характерным является замедленный метаболизм лекарственных средств, обусловленный медленными темпами созревания ферментных систем печени, которые созревают постепенно в процессе развития ребенка. По этим причинам у новорожденных метаболизм лекарственных средств замедлен вдвое.
Биотрансформация (рис. 1) включает ряд процессов: окисление, восстановление, гидролиз, конъюгацию, преобразование лекарственных субстанций в фармакологически неактивные или активные формы, образование водорастворимых соединений, способных к элиминации.
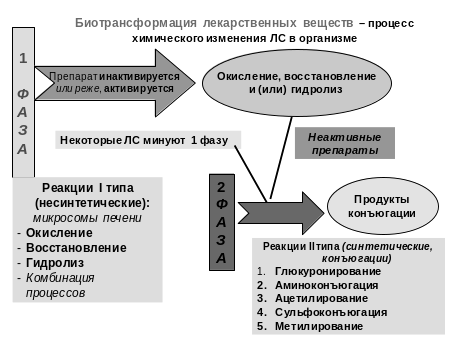
Рис. 1. Фазы биотрансформации.
У новорожденных скорость окислительных реакций с участием микросомальных ферментных систем (цитохрома Р450 - оксидазы, НАДФ-цитохром-С-редуктазы, глутатионтрансферазы, глюкуронилтрансферазы и др.) снижена вдвое, поэтому биотрансформация лекарственных веществ, в основе которой лежат эти реакции, замедляется.
Активность глюкуронилтрансферазы, алкогольдегидрогеназы, эстеразы у новорожденных снижена, поэтому выведение препаратов, в биотрансформации которых участвуют перечисленные ферменты, у новорожденного замедляется, а Т ½ выведения увеличивается.
Из-за невысокой скорости биотрансформации лекарственных веществ увеличивается их выведение в неизмененном виде.
Необходимо также учитывать состояние желез внутренней секреции, играющих немаловажную роль в метаболизме лекарственных средств. Например, при гипофункции щитовидной железы в значительной степени изменяется превращение лекарств.
Метаболические расстройства, легко возникающие у детей раннего возраста при тяжелых инфекциях – гипоксия, ацидоз, накопление шлаков, способствуют кумуляции лекарственных препаратов.
