
6 курс / Кардиология / Джон_Кэмм_Болезни_сердца_и_сосудов_2011
.pdf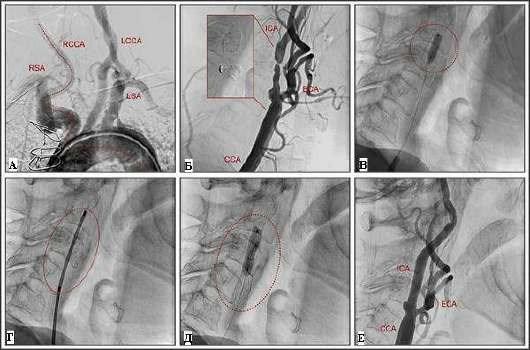
в наружной сонной артерии установлен дистальный баллон (отмечен стрелкой); Г - проксимальный приток крови полностью прекращен, раздуты дистальный и проксимальный баллоны (отмечены стрелками), инъекция контрастного вещества через просвет в защитном устройстве; Д - постдилатация стента с помощью баллона 5,5×20 мм (отмечен стрелками); Е - окончательный результат. CCA - общая сонная артерия; ECA - наружная сонная артерия; ICA - внутренняя сонная артерия; RCCA - правая общая сонная артерия; RSA - правая подключичная артерия; LCCA - левая общая сонная артерия; LSA - левая подключичная артерия.
Рис. 36.18. Эндоваскулярное вмешательство при наличии кальцинированной бляшки в сонной артерии. Сложный случай ангиопластики сонной артерии: A - выраженная извитость проксимальной части артерии (отмечена красной линией); Б - выраженный стеноз сонной артерии, отдельно представлено более крупное изображение бляшки с выраженным кальцинозом; В - предилатация стеноза с помощью "режущего" баллона для коронарных артерий (отмечен кружком); Г - установка стента (отмечен кружком); Д - постдилатация стента (отмечен кружком); контрольная ангиограмма (окончательный результат). CCA - общая сонная артерия; ECA - наружная сонная артерия; ICA - внутренняя сонная артерия; RCCA - правая общая сонная артерия; RSA - правая подключичная артерия; LCCA - левая общая сонная артерия; LSA левая подключичная артерия.
СТЕНТИРОВАНИЕ СОННОЙ АРТЕРИИ И КАРОТИДНАЯ ЭНДАРТЕРЭКТОМИЯ: ЧТО ЛУЧШЕ?
Стентирование сонной артерии считают альтернативой каротидной эндартерэктомии, но попрежнему не ясно, столь же безопасна ли эта методика и обеспечивает ли она защиту от инсульта в отдаленном периоде в той же степени, что и операция.
Вобзорной статье, опубликованной в 2005 г. [148], было проведено сравнение двух обсуждаемых методов на основании результатов рандомизированных клинических исследований по показателям риска смерти, инсульта (с выраженным или легким неврологическим дефектом), а также несмертельного ИМ. Обзор включал пять исследований, в которых участвовали
1269 больных (Cavatas, Kentucky, Leicester, SAPPHIRE, Wallstents). Авторы не обнаружили достоверных различий между двумя видами лечения по основным показателям риска, но в связи с существенной неоднородностью изученных работ эти различия могли остаться незамеченными. Впоследствии были опубликованы результаты еще двух испытаний - EVA 3-S (Endarterectomy
Versus Stenting in Patients with Symptomatic Severe Carotid Stenosis / Эндартерэктомия в сравнении со стентированием при симптомном тяжелом стенозе сонной артерии) и SPACE (Stent-Protected Angioplasty Versus Carotid Endarterectomy / Сравнитетельное исследование ангиопластики со стентированием с каротидной эндартерэктомией), которые также не внесли ясность в этот вопрос.
Висследовании EVA 3-S [149] основной показатель (риск инсульта или смерти в течение 30 дней
после операции) составил 3,9% в группе эндартерэктомии и 9,6% - в группе стентирования (анализ "по намерению лечить", "intention-to-treat"). К сожалению, разница в опыте эндоваскулярных хирургов, участвовавших в исследовании EVA 3-S, а также тот факт, что средний уровень их технических навыков был явно недостаточным, привели к тому, что многие представители научного сообщества не считают возможным объективно оценивать безопасность стентирования сонных артерий на основании результатов этой работы. Споры не прекратились и после публикации исследования SPACE [150]. Несмотря на отсутствие существенных различий по летальности и частоте ипсилатерального ишемического инсульта от момента рандомизации до истечения 30-дневного срока после вмешательства (6,8% в группе стентирования и 6,3% в группе эндартерэктомии), исследование SPACE не подтвердило эквивалентность этих двух методов.
Более достоверными представляются результаты анализа среднеотдаленных результатов стентирования сонной артерии по сравнению с эндартерэктомией: как в исследовании SPACE (срок наблюдения два года) [151], так и в EVA 3-S (срок наблюдения четыре года) [152], стентирование не уступало каротидной эндартерэктомии по эффективности профилактики ипсилатерального инсульта в среднеотдаленном периоде. В этой неясной и противоречивой ситуации, в условиях, когда имеющиеся данные иногда оказываются бесполезными или искажают истинное положение вещей, а дизайн исследований подвергается бурной критике, трудно прийти к консенсусу. Учитывая отсутствие объективных доказательств, а также понимая необходимость индивидуального подхода к лечению пациента, роль эндартерэктомии и стентирования сонных артерий можно охарактеризовать следующим образом.
•Единственная цель лечения стеноза сонной артерии - профилактика инсульта.
•Как при симптомном, так и при бессимптомном течении заболевания риск инсульта, связанный с выполнением какого-либо профилактического вмешательства, не должен превышать этот же показатель при естественном течении атеросклероза сонных артерий.
•В настоящее время отсутствуют данные, на основании которых можно было бы отказаться от использования каротидной эндартерэктомии в клинической практике в качестве предпочтительного метода лечения при стенозе сонной артерии определенной степени.
•Стентирование сонной артерии с защитой от эмболии, выполненное опытным специалистом, следует рассматривать как надежную альтернативу каротидной эндартерэктомии у пациентов с высоким риском открытого вмешательства.
•До публикации результатов рандомизированных исследований, которые проводятся в настоящее время, следует воздержаться от расширения показаний к стентированию сонной артерии и не выполнять это вмешательство у пациентов с небольшим риском открытой операции.
АТЕРОСКЛЕРОЗ ПОЧЕЧНОЙ АРТЕРИИ
ОСНОВНЫЕ ПОЛОЖЕНИЯ (СМ. ГЛАВУ 13)
•Частота реноваскулярной гипертензии (см. главу 13) в общей популяции составляет около 4%. В отдельных подгруппах пациентов (например, при подтвержденной ИБС) этот показатель может достигать 15-30%.
•У пациентов с реноваскулярной гипертензией клинические признаки заболевания и эффективность лечения зависят от степени сужения почечной артерии.
•В последнее время отмечен существенный прогресс в технике транскатетерной ангиопластики
(пластика почечной артерии со стентированием), который во многом обусловлен созданием инструментов и стентов низкого профиля.
•Гипертензия, вызванная значимым стенозом почечной артерии, хорошо поддается лечению у двух третей больных с атеросклеротическим поражением сосуда и 80% пациентов с фибромускулярной дисплазией.
•Реваскуляризацию почек можно использовать с целью коррекции ХПН. Положительный прогностический фактор - быстрое прогрессирование заболевания при скорости клубочковой фильтрации более 10 мл/мин.
ЭПИДЕМИОЛОГИЯ И ФАКТОРЫ РИСКА
Стеноз почечной артерии - причина артериальной гипертензии у 1-5% пациентов (реноваскулярная гипертензия). В большинстве наблюдений причиной заболевания служат атеросклеротические изменения в стенке аорты, распространяющиеся на почечные артерии и приводящие к развитию приустьевого эксцентрического сужения, характерного для этого
заболевания. Менее 10% всех случаев стенозирования почечной артерии вызваны другими причинами, чаще всего фибромускулярной гиперплазией или васкулитом, которые обычно возникают у пациентов молодого возраста (менее 40 лет) [153] и поражают преимущественно средний отдел почечной артерии.
У пациентов старшей возрастной группы среди причин стеноза почечной артерии преобладает атеросклероз, часто в сочетании со множественными факторами риска (курение, сахарный диабет, дислипидемия) и изменениями в других сосудистых бассейнах. По данным одного из исследований, ИБС была обнаружена у 71% больных с атеросклеротическим стенозом почечной артерии, поражение периферических артерий - у 41%, сонных артерий - у 38%, аневризма брюшной аорты - у 13%, стеноз второй почечной артерии - у 16% пациентов [154].
ПАТОФИЗИОЛОГИЯ
Существование функционально значимого стеноза почечной артерии активирует ряд патофизиологических механизмов, которые, в свою очередь, приводят к развитию клинически выраженных изменений со стороны сердечно-сосудистой и мочевыводящей системы. Ишемия почки вызывает нейроэндокринный ответ, который сопровождается усиленной продукцией ренина, ангиотензина II и активацией симпатической нервной системы. В сочетании с задержкой солей в организме это способствует поддержанию повышенного АД и поражению сердца (гипертрофия ЛЖ), мозга (инсульт), кровеносных сосудов (прогрессирование атеросклероза) и почек (нефросклероз). В зависимости от патофизиологических механизмов можно выделить три стадии развития клинических признаков этого заболевания.
• Фаза I:
♦ повышение концентрации ренина и ангиотензина II;
♦прием иАПФ приводит к снижению АД.
• Фаза II:
♦возвращение концентрации ренина и ангиотензина II к нормальным значениям;
♦увеличение объема внеклеточной жидкости в организме;
♦прием иАПФ приводит к менее значимому снижению АД.
• Фаза III:
♦ коррекция стеноза почечной артерии не приводит к регрессу артериальной гипертензии.
С позиции тактики лечения крайне важно определить, в какой стадии реноваскулярной гипертензии находится пациент. В I и II фазе болезни лечение эффективно, а назначение антигипертензивных препаратов и (или) коррекция стеноза почечной артерии позволяет снизить АД и предотвратить дальнейшее ухудшение почечной функции. При необратимом повреждении почек, которое развивается на поздних стадиях (фаза III), реноваскулярная гипертензия может быть рефрактерной к лечению. В этой ситуации коррекция стеноза почечной артерии не приведет к излечению или уменьшению гипертензии, поскольку, в отличие от начальных стадий заболевания, повышенное АД у таких больных поддерживается другими механизмами, аналогичными тем, которые действуют при гипертензии у пациентов с ХПН различной этиологии. В другой почке (без стеноза артерии) также развиваются изменения, вызванные хроническим повышением АД.
Рассуждая о клинической стороне вопроса, необходимо подчеркнуть, что гипертрофия ЛЖ, инсульт, прогрессирование атеросклероза и нефросклероз не только способствуют развитию гипертензии, но и, в свою очередь, служат результатом действия ангиотензина II, эндотелина, трансформирующего фактора роста β, тромбоцитарного фактора роста β, а также активных форм кислорода (пролиферация гладкомышечных клеток, разрыв покрышки атеросклеротической бляшки, эндотелиальная дисфункция, подавление фибринолиза, гипертрофия кардиомиоцитов) [155, 156]. Действительно, гипертрофия миокарда развивается даже при нормальных показателях АД, если при этом сохраняется повышенное содержание ангиотензина II [157]. Неудивительно, что поражение почечных артерий имеет неблагоприятное прогностическое значение как для общей выживаемости, так и для выживаемости, связанной с заболеваниями почек. При этом риск развития сердечно-сосудистых осложнений и летальность существенно возрастают, а шестилетняя выживаемость без сердечно-сосудистых осложнений составляет лишь 53%. Более того, частота развития ХПН в течение шести лет достигает 27%, а в 18% артерий стеноз в течение пяти лет приводит к окклюзии [158, 159]. В связи с этим лечение стеноза почечной артерии должно быть направлено на то, чтобы разорвать порочный круг почечной ишемии и обеспечить достижение трех основных результатов:
•лучший контроль АД, позволяющий отказаться от использования нескольких гипотензивных препаратов и предотвратить гипертрофию ЛЖ;
•сохранение функций почек;
•профилактика обострений ХСН, в том числе отека легких.
ДИАГНОСТИКА
КЛИНИЧЕСКАЯ КАРТИНА
Клинически стеноз почечной артерии может манифестировать артериальной гипертензией, ХПН или острым отеком легких. При обследовании пациента часто выслушивают шум над крупными артериями (в том числе над брюшной аортой). В то же время он редко определяется над пораженной почечной артерией. Стеноз почечной артерии можно заподозрить на основании следующих клинических признаков:
•пожилой возраст;
•недавний дебют артериальной гипертензии;
•женский пол;
•признаки атеросклероза артерий;
•курение;
•систолический шум при аускультации брюшной полости;
•повышенная концентрация креатинина крови;
•гиперхолестеринемия.
В клинической практике о возможном существовании стеноза почечной артерии следует думать, если у пациента присутствуют признаки поражения сосудистой системы в сочетании с выраженной артериальной гипертензией.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА
Для серологической оценки стеноза почечной артерии предложены следующие тесты:
•определение концентрации креатинина в крови (повышение на фоне лечения иАПФ);
•определение концентрации ренина в крови (особенно после приема каптоприла);
•определение концентрации ренина в крови, полученной из почечной вены на стороне поражения (чаще применяют в исследовательских целях).
Следует подчеркнуть, что рутинное использование вышеупомянутых тестов ограничено в связи с их недостаточной чувствительностью и специфичностью.
МЕТОДЫ ВИЗУАЛИЗАЦИИ
К методам визуализации относят дуплексное УЗИ, ренографию с каптоприлом, магнитнорезонансную артериографию, спиральную КТ-ангиографию и селективную артериографию почек. По сравнению с селективной артериографией, которая остается "золотым стандартом" диагностики этого заболевания, достаточной диагностической точностью также обладает КТангиография и магнитно-резонансная артериография с гадолинием. УЗИ - простой, надежный и сравнительно недорогой метод, но характеризуется крайне вариабельными показателями чувствительности и специфичности, которые зависят от специалиста, выполняющего исследование, и конкретного центра, в котором его проводят.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Правильно подобранная медикаментозная терапия - важный элемент лечения стеноза почечной артерии. Она включает эффективное снижение АД с помощью иАПФ или БРА, поскольку препараты этих групп не вызывают значимой азотемии. Ограничение употребления соли и использование диуретиков может способствовать снижению давления на фоне приема антагонистов ангиотензина. При тяжелых поражениях почечных артерий (выраженный двусторонний стеноз, критический стеноз у пациента с единственной почкой) лечение следует назначать с осторожностью, поскольку иАПФ могут усиливать гиперазотемию, т.е. существование подобных состояний считают относительным противопоказанием к назначению иАПФ и БРА. Обязательна агрессивная коррекция факторов риска (ограничение употребления жирной пищи и
отказ от курения), что связано с высоким риском развития других ССЗ, включая ИБС и ИМ. Для исключения поражения коронарных и периферических сосудов необходимо детально обследовать пациентов.
ТАКТИКА РЕВАСКУЛЯРИЗАЦИИ
Реканализацию почечных артерий можно выполнять открытым способом (эндартерэктомия, аортопочечное шунтирование) или с помощью ЧТА с имплантацией стента по показаниям (рис. 36.19). Первоначально единственным методом реваскуляризации было открытое вмешательство. В настоящее время вместо него все чаще используют эндоваскулярные методики - ЧТА почечных артерий со стентированием и, с недавнего времени, с использованием защитных фильтров для профилактики эмболии почки атероматозными массами [160, 161]. Тем не менее в настоящее время отсутствуют четкие данные, подтверждающие клиническую эффективность стентирования почечных артерий. Необходимые доказательства, возможно, будут получены после завершения исследования CORAL, в котором участвуют более 1000 пациентов. Оно позволит определить эффективность стентирования в сочетании с оптимальным медикаментозным лечением [162]. Учитывая вышеописанные аспекты патофизиологии заболевания, оценка реального эффекта эндоваскулярного лечения должна включать два важных элемента:
•влияние стентирования почечных артерий на полноценный контроль АД, дозу гипотензивных препаратов и функцию почек;
•частота рестеноза после процедуры.
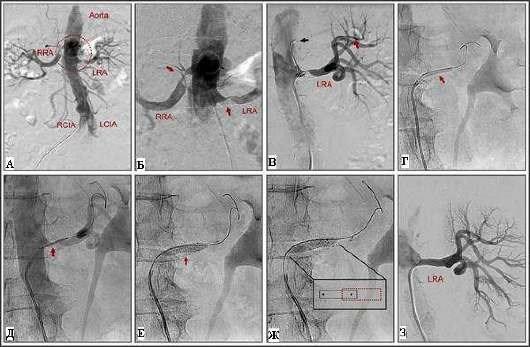
Рис. 36.19. Эндоваскулярное вмешательство при стенозе почечной артерии. Пример ангиопластики и стентирования почечной артерии: A - ангиограмма брюшной аорты, демонстрирующая двусторонний стеноз почечных артерий (отмечен кружком); Б - более крупное изображение стеноза (отмечен стрелками); В - проводник диаметром 0,35 мм (отмечен красной стрелкой) проведен через стеноз по методике "no-touch" (черной стрелкой отмечен проводник диаметром 0,89 мм, установленный в просвете аорты); Г - предилатация с помощью обычного баллона для ангиопластики (отмечен стрелкой); Д - установка стента (отмечен стрелкой); Е - стентирование (отмечено стрелками); Ж - постдилатация стента; на иллюстрации показана дилатация стента в устье артерии, при этом проксимальная часть баллона выступает в просвет аорты; З - контрольная ангиография (окончательный результат). LCIA - левая общая подвздошная артерия; LRA - левая почечная артерия; RCIA - правая общая подвздошная артерия; RRA - правая почечная артерия.
СТЕНТИРОВАНИЕ ПОЧЕЧНОЙ АРТЕРИИ ДЛЯ ЛЕЧЕНИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
Блокада РААС - высокоэффективный метод контроля АД. Степень активации этой системы при реноваскулярной гипертензии можно уменьшить посредством стентирования, которое приводит к восстановлению нормального кровотока в почке. Согласно результатам метаанализа трех рандомизированных исследований, в ходе которых проводилось сравнение баллонной ангиопластики и медикаментозного лечения, операция приводила к умеренному снижению АД, а также уменьшала потребность в антигипертензивных препаратах [163]. В то же время в этих исследованиях участвовало небольшое число пациентов и в них использован не вполне адекватный протокол медикаментозного лечения, поскольку некоторые классы препаратов (например, БРА) на момент их проведения отсутствовали. Отсутствие существенного гипотензивного эффекта после стентирования почечной артерии можно объяснить развитием вторичных изменений (например, длительной ишемией почки и гипертоническими изменениями в другой почке), поддерживающих повышенное АД.
Влияние стентирования почечной артерии на гипертрофию ЛЖ - другой важный вопрос, на который необходимо ответить при прогнозировании результата реваскуляризации почки. Индекс массы ЛЖ (показатель его гипертрофии), который, в свою очередь, является известным фактором риска развития сердечно-сосудистых нарушений, после реконструкции почечной артерии снижается [164].
СТЕНТИРОВАНИЕ ПОЧЕЧНОЙ АРТЕРИИ ДЛЯ УЛУЧШЕНИЯ ФУНКЦИЙ ПОЧЕК
С недавнего времени основным клиническим показанием к реваскуляризации при стенозе почечной артерии считали ХПН, а не артериальную гипертензию, как это было ранее. Тем не менее эффективность стентирования почечной артерии с целью замедления ухудшения функций почек и развития последней стадии заболевания по-прежнему остается спорной. Несмотря на то что в ряде обсервационных исследований была продемонстрирована стабилизация или улучшение почечных функций у некоторых пациентов, такой эффект может отсутствовать, если в паренхиме почки уже наступили изменения. Более того, эндоваскулярная процедура может способствовать прогрессированию заболевания вследствие развития контрастной нефропатии или эмболии почки атероматозными массами.
Существуют данные, свидетельствующие о значительном улучшении состояния после выполнения ЧТА почечных артерий и (или) стентирования почечной артерии у больных с единственной или трансплантированной почкой. Ситуация с развитием ХПН у больного с двумя почками и стенозом одной из почечных артерий представляется более сложной. Как показали некоторые исследования, у пациентов с умеренным повышением концентрации креатинина в крови стабилизации течения или регресса ХПН достигают более чем в 70% наблюдений [165-168]. Даже в группе больных с выраженным снижением функций почек транскатетерная ангиопластика приводила к улучшению почечной функции или предотвращала ее дальнейшее снижение в 50% случаев [167] (рис. 36.20). Даже если перед вмешательством у больного регистрировали прогрессирующее снижение функции почек, но при этом скорость клубочковой фильтрации превышала 10 мл/мин, реваскуляризация приводила к положительному результату [167, 168]. При значимом повреждении паренхимы почек (скорость клубочковой фильтрации менее 10 мл/мин), а также при индексе резистентности более 0,80 (по данным допплерографии) [169], ангиопластика почечной артерии не приводит к улучшению функций органа.
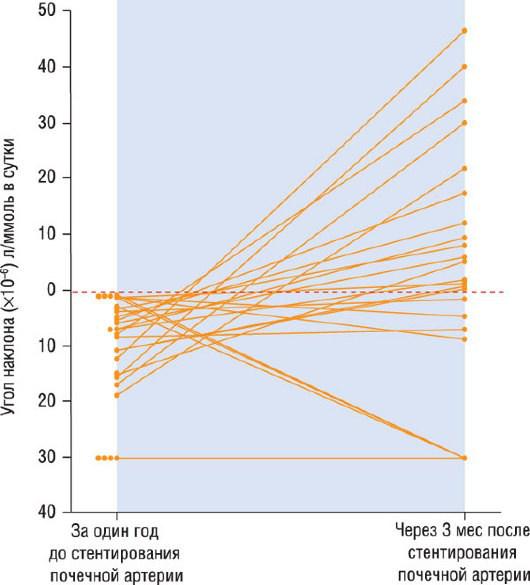
Рис. 36.20. Изменение угла наклона кривой средней концентрации реципрокного креатинина крови (показатель, аналогичный клиренсу креатинина) за один год до и через 3 мес после стентирования почечной артерии у 22 пациентов с ХПН (содержание креатинин в крови более 300 мкмоль/л): отрицательный угол наклона свидетельствует о снижении концентрации реципрокного креатинина в течение двух лет, предшествовавших вмешательству; угол становится нулевым при стабилизации обсуждаемого показателя и приобретает положительное значение после процедуры, что обусловлено увеличением содержания реципрокного креатинина.
Отдельного упоминания заслуживают недавно опубликованные результаты исследования ASTRAL (Angioplasty and Stenting for Renal Artery Lesions / Ангиопластика и стентирование при стенозах почечных артерий) [170]. Целью этой работы было определение эффективности реваскуляризации почек с помощью баллонной ангиопластики и (или) эндоваскулярного стентирования, направленной на профилактику развития прогрессирующей ХПН у широкого круга больных с атеросклеротическим поражением почечных артерий. На этапе рандомизации пациентов случайным образом распределяли между двумя группами: чрескожная реваскуляризация (ангиопластика или стентирование) + медикаментозное лечение (n=403) и только медикаментозное лечение (n=403). Основные результаты этой работы можно охарактеризовать следующим образом.
•Смертность от ССЗ в группе реваскуляризации составила 7,4%, а в группе медикаментозного лечения - 8,2% (различия недостоверны).
•Частота госпитализаций в связи с развитием отеков составила 12% в группе реваскуляризации и 14% в группе медикаментозного лечения (различия недостоверны).
• Исследованные группы больных не различались по концентрации креатинина в крови, систолическому АД, времени возникновения первых клинических симптомов, связанных с поражением почек, а также общей частоте сосудистых осложнений в период наблюдения (различия недостоверны для всех конечных точек).
Согласно авторской интерпретации, результаты исследования ASTRAL не подтвердили эффективность реваскуляризации почек. Стоит ли говорить о том, что эти данные стали поводом для многочисленных споров, главным образом связанных с тем, что они противоречат выводам подавляющего большинства опубликованных работ, посвященных анализу клинических результатов реваскуляризации почек. Более того, некоторые специалисты негативно оценивают дизайн исследования. С методологической точки зрения ASTRAL нельзя считать целостным исследованием. Фактически оно представлено группой отдельных работ, проведенных среди пациентов с различными клиническими симптомами и разным спектром сопутствующих заболеваний. Эта методологическая проблема снижает достоверность результатов исследования в связи с невозможностью проведения полноценного анализа различных сценариев.
РЕСТЕНОЗ СТЕНТИРОВАНОЙ ПОЧЕЧНОЙ АРТЕРИИ
Частота повторного сужения сосуда после стентирования почечной артерии с использованием некоторых моделей металлических стентов составляет 6-23%. По данным исследования GREAT
(Low-profile Stent System for Treatment of Atherosclerotic Renal Artery Stenosis / Низкопрофильные стенты при лечении атеросклеротического стеноза почечной артерии), в котором проводили сравнение металлических стентов без покрытия и стентов, выделяющих сиролимус (Genesis), частота рестеноза после имплантации последних составила 6,7%, а при использовании непокрытых металлических стентов - 14,6% [171]. Предикторами рестеноза были диаметр сосуда (рестеноз редко возникал в артериях диаметром ≥6 мм), индекс массы тела и курение в анамнезе. Рестеноз внутри стента трудно диагностировать на основании клинических признаков, поскольку его единственным признаком может быть повышение АД через 6-8 мес после вмешательства.
Для диагностики рестеноза внутри стента в почечной артерии применяют ряд методов визуализации. Ангиографию, которую считают "золотым стандартом" в этой области, нельзя применять в качестве скринингового метода в связи с инвазивным характером этой процедуры. За последние десять лет широкое распространение получила магнитно-резонансная ангиография с гадолинием, поскольку эта методика неизвазивна, а используемое контрастное вещество не влияет на функцию почек. Кроме того, она позволяет измерить градиент давления в области стеноза [172]. Тем не менее, согласно недавно опубликованным исследованиям, у пациентов с тяжелым поражением почек гадолиний может способствовать развитию нефрогенного системного фиброза [173]. Мультиспиральная КТ-ангиография позволяет получить трехмерное изображение сосуда с высоким разрешением и меньшим числом артефактов, вызванных присутствием стента (по сравнению с магнитно-резонансной ангиографией), но серийное использование этого метода с целью контроля результатов в послеоперационном периоде ограничено в связи с необходимостью введения йодсодержащего контрастного вещества [174]. Дуплексное УЗИ, как неинвазивный и более дешевый метод исследования, вероятно, служит наилучшим способом скрининга пациентов для диагностики рестеноза после коррекции стеноза почечной артерии.
Среди различных показателей, определяемых в процессе дуплексного УЗИ, пиковая систолическая скорость кровотока, превышающая 200 см/с, а также отношение скорости кровотока в почечной артерии к таковой в аорте, превышающее 3,5, свидетельствуют о существовании стеноза, достигающего 50-60% (по ангиографической шкале). В то же время была обнаружена высокоспецифичная корреляция между разницей индекса резистивности ([пиковая систолическая скорость - конечная диастолическая скорость]/пиковая систолическая скорость ×100]) между почечными артериями, достигающей ≥0,05, и существованием стеноза, превышающего 70% по ангиографической шкале [175].
ПОКАЗАНИЯ К СТЕНТИРОВАНИЮ ПОЧЕЧНОЙ АРТЕРИИ
Проблема эндоваскулярной коррекции стеноза почечной артерии неоднозначна. Если допустить, что проходимая почечная артерия лучше, чем окклюзированная, то все научные споры должны сводиться к вопросу о том, приведет ли реканализация к достоверному существенному клиническому улучшению. Существующие литературные данные не освещают некоторые неизученные аспекты, касающиеся определения показаний к реваскуляризации почек у больных с поражением почечных артерий. Несмотря на это, методику стентирования почечных артерий активно применяют в западных странах, часто без каких-либо четких показаний и вопреки высокой опасности развития тяжелых осложнений и, иногда, смерти пациента.
Таким образом, существующий сегодня подход к реваскуляризации почек можно представить следующим образом.
•Гипертензия, вызванная значимым стенозом почечной артерии, хорошо поддается лечению у двух третей больных с атеросклеротическим поражением сосуда и у 80% пациентов с фибромускулярной дисплазией.
•Реваскуляризацию почек можно использовать с целью коррекции ХПН. Положительным прогностическим фактором считают быстрое прогрессирование заболевания при скорости клубочковой фильтрации более 10 мл/мин.
•При обнаружении гемодинамически значимого стеноза необходимо как можно скорее выполнить его коррекцию для предотвращения окклюзии сосуда.
Основываясь на представленных выше литературных данных, показанием к стентированию почечной артерии при стенозе ее устья или проксимального отдела служит обнаружение у пациента следующих патологических состояний.
• Односторонний или двусторонний стеноз почечной артерии (более 70%) в сочетании с:
♦ мягкой, умеренной или тяжелой гипертензией или поражением нескольких сосудистых бассейнов (особенно у пациентов с ИБС);
♦ легкой, умеренной или тяжелой ХПН, острой (подострой) почечной недостаточностью или анурией;
♦ повторными эпизодами отека легких.
• Стеноз почечной артерии (более 70%) у пациентов с окклюзией второй почечной артерии (в том числе протекающей бессимптомно).
ДАЛЬНЕЙШИЕ ПЕРСПЕКТИВЫ
Проблемы лечения некоронарного атеросклероза - предмет многочисленных споров среди специалистов по заболеваниям сердца и сосудов. В этой главе авторы не только представили имеющиеся научные данные по обсуждаемой проблеме, но и продемонстрировали, насколько трудно порой применить эти результаты в различных клинических ситуациях вследствие методологических особенностей каждого из исследований.
Что касается различных методов лечения некоронарного атеросклероза, то, несмотря на недостаточное количество достоверных научных данных по этому вопросу, бурное развитие медицинских технологий в течение последних лет существенно изменило подход к лечению этих заболеваний, их восприятие обществом и социально-политическое значение. Например, несколько лет назад критическую ишемию нижних конечностей считали почти неизлечимой болезнью с сомнительными перспективами медикаментозного лечения, единственной альтернативой которому у некоторых пациентов, а также на поздних стадиях заболевания было открытое вмешательство на сосудах. Сегодня, благодаря внедрению сложных неинвазивных методик, можно оценить степень и распространенность поражения без какого-либо серьезного риска для здоровья пациента. Более того, эндоваскулярные технологии открыли дорогу к созданию менее инвазивных методик, что привело к переоценке риска и эффективности лечения у пациентов пожилого возраста, которые тоже имеют право на полноценную медицинскую помощь не только с целью продления жизни, но и для улучшения ее качества.
Рассуждая об особенностях лечения различных форм облитерирующих поражений сосудов, следует признать, что настоящий консенсус между специалистами разного профиля пока не достигнут. В настоящее время сохраняются разногласия в отношении того, следует ли считать стентирование сонной артерии альтернативой каротидной эндартерэктомии при лечении атеросклероза сонных артерий. У пациентов с высоким риском открытой операции эндоваскулярное вмешательство, выполненное с защитой мозга, по своим результатам не уступает эндартерэктомии, но у асимптомных больных со стенозом высокой степени окончательные представления о показаниях к эндоваскулярному лечению не сформированы. Что касается стентирования сонной артерии, то недавно полученные результаты рандомизированных исследований подтверждают большое значение квалификации врача, выполняющего ангиопластику и имплантацию стента, в том числе уровня его подготовки, частоты развития осложнений и порядка аттестации. В ближайшем будущем необходимо разработать интенсивную программу обучения и строгие критерии сертификации таких специалистов.
Ангиопластику и стентирование сегодня рассматривают в качестве предпочтительного метода лечения атеросклеротического поражения почечных артерий. Тем не менее врачам следует настороженно относиться к существующим литературным данным, касающимся стентирования
почечных артерий, и вновь обратиться к вопросу нетехнического характера - клиническим показаниям к выполнению этой процедуры. Поскольку клиническая эффективность обсуждаемого вмешательства по-прежнему не ясна, экспертное сообщество должно признать необходимость получения достоверных научных доказательств.
При лечении поражений артерий аорто-подвздошного сегмента новые методики реканализации в сочетании с имплантацией стентов высокого качества (саморасправляющихся и расправляемых с помощью баллона) и тромболитической терапией обеспечивают очень высокую частоту положительных результатов, а отдаленные результаты таких процедур сопоставимы с таковыми хирургических операций. Доля поражений, которые не удается корректировать эндоваскулярно, не превышает 10%. Именно по этой причине внутрисосудистые вмешательства при поражениях аорто-подвздошного сегмента выходят на первое место в клинической практике.
Совсем другая ситуация складывается при лечении поражений артерий, расположенных ниже паховой связки. Методы реканализации таких изменений оказались высокоэффективными: частота успешных реконструкций превышает 90%, в том числе при наличии протяженных и кальцинированных бляшек. Отдаленные результаты таких вмешательств остаются неудовлетворительными в виду особенностей анатомии пораженного сегмента, который постоянно подвергается сжатию, скручиванию и растяжению. Успехи, связанные с использованием нитиноловых стентов, которые поддерживают проходимость сосуда, могут нивелироваться поломкой стента. Абсолютно необходимым представляется создание стентов с улучшенным механическими свойствами, что особенно актуально при протяженных поражениях. Расширение показаний к применению стентов с лекарственным покрытием для коррекции изменений бедренноподколенного сегмента требует дополнительных исследований. Одним из наиболее перспективных направлений становятся эндоваскулярные вмешательства на артериях голени. Использование материалов низкого профиля в сочетании с другими методиками (разрушение бляшки, стенты с лекарственным покрытием) полностью изменило существующее положение и позволило добиться неожиданно высоких результатов лечения при поражении артерий голени, а также у пациентов с диабетической стопой.
В заключении следует подчеркнуть важность "командного" подхода: при выборе того или иного метода лечения всегда необходимо соблюдать оптимальное соотношение его преимуществ и опасностей для пациента, которые определяются в ходе коллективного обсуждения с участием различных специалистов. Таким образом, залог успешной стратегии лечения состоит в активном сотрудничестве между представителями различных дисциплин (эндокринологами, неврологами, сосудистыми и эндоваскулярными хирургами). Кроме того, необходимо оказывать интенсивную поддержку центрам, в которых проводят лечение сосудистых заболеваний.
БЛАГОДАРНОСТЬ
Мы выражаем особую благодарность Барбаре Спанголо за ее труд по проверке текста этого руководства.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
1.Abela G.S. Peripheral vascular Disease-Basic Diagnostic and Therapeutic Approach. - Philadelphia, PA: Lippincott Williams & Wilkins, 2004.
2.Bates E.R., Babb J.D., Casey D.E. Jr. et al. ACCF/SCAI/SVMB/SIR/ASITN 2007 clinical expert consensus document on carotid stenting: a report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents (ACCF/SCAI/SVMB/SIR/ASITN Clinical Expert Consensus Document Committee on Carotid Stenting) // J. Am. Coll. Cardiol. - 2007. - N. 49. - Vol. 1. - P. 126-170.
3.Brancherau A., Jacobs M. Open surgery versus endovascular procedures. - Oxford: Paris Consultants Ltd., 2007.
4.Cremonesi A., Setacci C., Bignamini A. et al. Carotid artery stenting: first consensus document of the ICCS-SPREAD Joint Committee // Stroke. - 2006. - N. 37. - Vol. 9. - P. 2400-2409.
5.Greenhalgh R.M. Vascular and endovascular consensus update, 2008. London: Biba Publishing. Management of peripheral arterial disease TransAtlantic Inter-Society Consensus (TASC) // Eur. J. Vasc. Endovasc. Surg. - 2000. - N. 19. - P. 1-250.
6.Norgren L., Hiatt W.R., Dormandy J.A. et al. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II) // J. Vasc. Surg. - 2007. - N. 45. - P. 5-67.
