
6 курс / Кардиология / Джон_Кэмм_Болезни_сердца_и_сосудов_2011
.pdf
отвечают на РСТ. Все методы визуализации могут предоставить информацию о рубцовой ткани, но МРТ предпочтительнее, поскольку позволяет с высоким пространственным разрешением дифференцировать трансмуральные и субэндокардиальные рубцы.
Таким образом, для оптимального прогнозирования эффективности РСТ, судя по всему, необходима дополнительная информация, помимо классических критериев отбора. Такую информацию можно получить в результате комбинирования результатов различных методов визуализации: данных о диссинхронии, зоне самой поздней активации, жизнеспособности миокарда и анатомии вен (рис. 3.11).
Рис. 3.11. Визуализирующие методы могут предоставить дополнительную информацию, помимо классических критериев отбора, для улучшения эффекта РСТ. Наличие внутрижелудочковой диссинхронии, а также место самой поздней активации можно идентифицировать при ЭхоКГ с тканевой допплерографией. Для оценки протяженности и расположения рубцовой ткани, а также жизнеспособного миокарда можно использовать ядерные методики или МРТ, в то время как МСКТ может быть полезна для оценки анатомии вен до имплантации ЛЖ-электрода.
КАКАЯ ВИЗУАЛИЗИРУЮЩАЯ МЕТОДИКА ПОДХОДИТ ПАЦИЕНТУ?
Предлагаемый подход включает пять ступеней и позволяет всесторонне оценить больного с СН. В отношении этих больных визуализирующие методы будут предоставлять следующую информацию:
•этиология СН (наличие или отсутствие ИБС);
•наличие ишемии и жизнеспособность миокарда;
•размер и форма ЛЖ;
•наличие и степень митральной регургитации;
•потребность в ИКД и РСТ.
Основываясь на этой всеобъемлющей оценке, можно выбрать индивидуальный способ лечения больного с СН. Важно понимать, что СН - сложное заболевание, и необходима точная оценка для обеспечения наилучшего лечения каждому больному.
ДАЛЬНЕЙШИЕ ПЕРСПЕКТИВЫ
Настоящая глава не охватывает все аспекты визуализирующих методик и не является рекомендациями, а скорее приводит некоторые практические примеры того, каким образом интегрировать различные методы визуализации в ведении пациентов. Задача каждого практикующего врача - разработка алгоритмов применения визуализирующих методов в ведении пациентов с различными ССЗ (например, разработка критериев целесообразности), но в то же время необходимо внимательно следить за потребностями конкретного больного. Кроме того, концепцию "рандомизированных контролируемых исследований" и "доказательной медицины" будет трудно применить к методам визуализации с учетом быстрого развития и постоянных изменений в этой области. Как можно в настоящее время обследовать пациента без ЭхоКГ? Судя по всему, надлежащая клиническая практика, основанная на мнении хорошо информированного врача, может стать руководством в выборе и интеграции методов визуализации в повседневной клинической работе.
Наконец, как уже несколько раз было упомянуто в этой главе, различные методы визуализации предоставляют сопоставимую информацию, поэтому доступность, опыт и знания на местах могут оказывать влияние на выбор метода исследования.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Greenland P., Bonow R.O., Brundage B.H. et al. ACCF/AHA 2007 clinical expert consensus document on coronary artery calcium scoring by computed tomography in global cardiovascular risk assessment and in evaluation of patients with chest pain: a report of the American College of Cardiology Foundation Clinical Expert Consensus Task Force (ACCF/AHA Writing Committee to Update the 2000 Expert Consensus Document on Electron Beam Computed Tomography) developed in collaboration with the Society of Atherosclerosis Imaging and Prevention and the Society of Cardiovascular Computed Tomography // J. Am. Coll. Cardiol. - 2007. - Vol. 49. - P. 378-402.
Hendel R.C., Patel M.R., Kramer C.M. et al. ACCF/ACR/SCCT/SCMR/ASNC/NASCI/SCAI/SIR 2006 appropriateness criteria for cardiac computed tomography and cardiac magnetic resonance imaging: a report of the American College of Cardiology Foundation Quality Strategic Directions Committee Appropriateness Criteria Working Group, American College of Radiology, Society of Cardiovascular Computed Tomography, Society for Cardiovascular Magnetic Resonance, American Society of Nuclear Cardiology, North American Society for Cardiac Imaging, Society for Cardiovascular Angiography and Interventions, and Society of Interventional Radiology // J. Am. Coll. Cardiol. - 2006. - Vol. 48. - P. 14751497.
Kirkpatrick J.N., Vannan M.A., Narula J. et al. Echocardiography in heart failure: applications, utility, and new horizons // J. Am. Coll. Cardiol. - 2007. - Vol. 50. - P. 381-396.
O’Hanlon R., Prasad S.K., Pennell D.J. Evaluation of nonischemic cardiomyopathies using cardiovascular magnetic resonance // J. Nucl. Cardiol. - 2008. - Vol. 15. - P. 400-416.
Schroeder S., Achenbach S., Bengel F. et al. Cardiac computed tomography: indications, applications, limitations, and training requirements: report of a Writing Group deployed by the Working Group Nuclear Cardiology and Cardiac CT of the European Society of Cardiology and the European Council of Nuclear Cardiology // Eur. Heart J. - 2008. - Vol. 29. - P. 531-556.
Ypenburg C., Westenberg J.J., Bleeker G.B. et al. Noninvasive imaging in cardiac resynchronization therapy - part 1: selection of patients // Pacing. Clin. Electrophysiol. - 2008. - Vol. 31. - P. 1475-1499.
СПИСОК ЛИТЕРАТУРЫ
1.Henneman M.M., Schuijf J.D., van Werkhoven J.M. et al. Multi-slice computed tomography coronary angiography for ruling out suspected coronary artery disease: what is the prevalence of a normal study in a general clinical population? // Eur. Heart J. - 2008. - Vol. 29. - P. 2006-2013.
2.Meijboom W.B., van Mieghem C.A., Mollet N.R. et al. 64-slice computed tomography coronary angiography in patients with high, intermediate, or low pretest probability of significant coronary artery disease // J. Am. Coll. Cardiol. - 2007. - Vol. 50. - P. 1469-1475.
3.Hendel R.C., Patel M.R., Kramer C.M. et al. ACCF/ACR/SCCT/SCMR/ASNC/NASCI/SCAI/SIR 2006 appropriateness criteria for cardiac computed tomography and cardiac magnetic resonance imaging: a report of the American College of Cardiology Foundation Quality Strategic Directions Committee Appropriateness Criteria Working Group, American College of Radiology, Society of Cardiovascular Computed Tomography, Society for Cardiovascular Magnetic Resonance, American Society of Nuclear Cardiology, North American Society for Cardiac Imaging, Society for Cardiovascular Angiography and Interventions and Society of Interventional Radiology // J. Am. Coll. Cardiol. - 2006. - Vol. 48. - P. 14751497.
4.Agatston A.S., Janowitz W.R., Hildner F.J. et al. Quantification of coronary artery calcium using ultrafast computed tomography // J. Am. Coll. Cardiol. - 1990. - Vol. 15. - P. 827-832.
5.Greenland P., Bonow R.O., Brundage B.H. et al. ACCF/AHA 2007 clinical expert consensus document on coronary artery calcium scoring by computed tomography in global cardiovascular risk assessment and in evaluation of patients with chest pain: a report of the American College of Cardiology Foundation Clinical Expert Consensus Task Force (ACCF/AHA Writing Committee to Update the 2000 Expert Consensus Document on Electron Beam Computed Tomography) developed in collaboration with the Society of Atherosclerosis Imaging and Prevention and the Society of Cardiovascular Computed Tomography // J. Am. Coll. Cardiol. - 2007. - Vol. 49. - P. 378-402.
6.Schroeder S., Achenbach S., Bengel F. et al. Cardiac computed tomography: indications, applications, limitations, and training requirements: report of a Writing Group deployed by the Working Group Nuclear Cardiology and Cardiac CT of the European Society of Cardiology and the European Council of Nuclear Cardiology // Eur. Heart J. - 2008. - Vol. 29. - P. 531-556.
7.Ward R.P., Al Mallah M.H., Grossman G.B. et al. American Society of Nuclear Cardiology review of the ACCF/ASNC appropriateness criteria for single-photon emission computed tomography myocardial perfusion imaging (SPECT MPI) // J. Nucl. Cardiol. - 2007. - Vol. 14. - P. 26-38.
8.Hachamovitch R., Hayes S.W., Friedman J.D. et al. Comparison of the short-term survival benefit associated with revascularization compared with medical therapy in patients with no prior coronary artery disease undergoing stress myocardial perfusion single photon emission computed tomography // Circulation. - 2003. - Vol. 107. - P. 2900-2907.
9.Gibbons R.J., Abrams J., Chatterjee K. et al. ACC/AHA 2002 guideline update for the management of patients with chronic stable angina - summary article: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines (Committee on the Management of Patients With Chronic Stable Angina) // J. Am. Coll. Cardiol. - 2003. - Vol. 41. - P. 159168.
10.Brindis R.G., Douglas P.S., Hendel R.C. et al. ACCF/ASNC appropriateness criteria for single-photon emission computed tomography myocardial perfusion imaging (SPECT MPI): a report of the American College of Cardiology Foundation Quality Strategic Directions Committee Appropriateness Criteria Working Group and the American Society of Nuclear Cardiology endorsed by the American Heart Association // J. Am. Coll. Cardiol. - 2005. - Vol. 46. - P. 1587-1605.
11.Shaw L.J., Hachamovitch R., Berman D.S. et al. The economic consequences of available diagnostic and prognostic strategies for the evaluation of stable angina patients: an observational assessment of the value of precatheterization ischemia. Economics of Noninvasive Diagnosis (END) Multicenter Study Group // J. Am. Coll. Cardiol. - 1999. - Vol. 33. - P. 661-669.
12.Kaufmann P.A., Camici P.G., Underwood S.R. Nuclear Cardiology. In: Camm A.J., Lüscher T.F., Serruys P.W. eds. The ESC Textbook of Cardiovascular Medicine. - Oxford: Blackwell Publishing, 2006. - P. 141-158.
13.Schuijf J.D., Shaw L.J., Wijns W. et al. Cardiac imaging in coronary artery disease: differing modalities // Heart. - 2005. - Vol. 91. - P. 1110-1117.
14.Dickstein K., Cohen-Solal A., Filippatos G. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM) // Eur. Heart J. - 2008. - Vol. 29. - P. 2388-2442.
15.Ghostine S., Caussin C., Habis M. et al. Non-invasive diagnosis of ischaemic heart failure using 64slice computed tomography // Eur. Heart J. - 2008. - Vol. 29. - P. 2133-2140.
16.Kirkpatrick J.N., Vannan M.A., Narula J. et al. Echocardiography in heart failure: applications, utility, and new horizons // J. Am. Coll. Cardiol. - 2007. - Vol. 50. - P. 381-396.
17.O’Hanlon R., Prasad S.K., Pennell D.J. Evaluation of nonischemic cardiomyopathies using cardiovascular magnetic resonance // J. Nucl. Cardiol. - 2008. - Vol. 15. - P. 400-416.
18.Lang R.M., Mor-Avi V., Zoghbi W.A. et al. The role of contrast enhancement in echocardiographic assessment of left ventricular function // Am. J. Cardiol. - 2002. - Vol. 90. - P. 28-34.
19.Rahimtoola S.H. The hibernating myocardium // Am. Heart J. - 1989. - Vol. 117. - P. 211-221.
20.Schinkel A.F., Bax J.J., Poldermans D. et al. Hibernating myocardium: diagnosis and patient outcomes // Curr. Probl. Cardiol. - 2007. - Vol. 32. - P. 375-410.
21.Bax J.J., Schinkel A.F., Boersma E. et al. Extensive left ventricular remodeling does not allow viable myocardium to improve in left ventricular ejection fraction after revascularization and is associated with worse long-term prognosis // Circulation. - 2004. - Vol. 110. - P. 18-22.
22.Vahanian A., Baumgartner H., Bax J. et al. Guidelines on the management of valvular heart disease: The Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology // Eur. Heart J. - 2007. - Vol. 28. - P. 230-268.
23.Vardas P.E., Auricchio A., Blanc J.J. et al. Guidelines for cardiac pacing and cardiac resynchronization therapy. The Task Force for Cardiac Pacing and Cardiac Resynchronization Therapy of the European Society of Cardiology. Developed in collaboration with the European Heart Rhythm Association // Eur. Heart J. - 2007. - Vol. 28. - P. 2256-2295.
24.Lang R.M., Bierig M., Devereux R.B. et al. Recommendations for chamber quantification: a report from the American Society of Echocardiography’s Guidelines and Standards Committee and the Chamber
Quantification Writing Group, developed in conjunction with the European Association of Echocardiography, a branch of the European Society of Cardiology // J. Am. Soc. Echocardiogr. - 2005. - Vol. 18. - P. 1440-1463.
25.Ahuja K., Crooke G.A., Grossi E.A. et al. Reversing left ventricular remodeling in chronic heart failure: surgical approaches // Cardiol. Rev. - 2007. - Vol. 15. - P. 184-190.
26.Grigioni F., Enriquez-Sarano M., Zehr K.J. et al. Ischemic mitral regurgitation: long-term outcome and prognostic implications with quantitative Doppler assessment // Circulation. - 2001. - Vol. 103. - P. 17591764.
27.Tops L.F., Van de Veire N.R., Schuijf J.D. et al. Noninvasive evaluation of coronary sinus anatomy and its relation to the mitral valve annulus: implications for percutaneous mitral annuloplasty // Circulation. - 2007. - Vol. 115. - P. 1426-1432.
28.Zoghbi W.A., Enriquez-Sarano M., Foster E. et al. Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography // J. Am. Soc. Echocardiogr. - 2003. - Vol. 16. - P. 777-802.
29.Enriquez-Sarano M., Avierinos J.F., Messika-Zeitoun D. et al. Quantitative determinants of the outcome of asymptomatic mitral regurgitation // N. Engl. J. Med. - 2005. - Vol. 352. - P. 875-883.
30.Westenberg J.J., Roes S.D., Ajmone M.N. et al. Mitral valve and tricuspid valve blood flow: accurate quantification with 3D velocity-encoded MR imaging with retrospective valve tracking // Radiology. - 2008. - Vol. 249. - P. 792-800.
31.Bax J.J., Abraham T., Barold S.S. et al. Cardiac resynchronization therapy: Part 1 - issues before device implantation // J. Am. Coll. Cardiol. - 2005. - Vol. 46. - P. 2153-2167.
32.Bleeker G.B., Yu C.M., Nihoyannopoulos P. et al. Optimal use of echocardiography in cardiac resynchronisation therapy // Heart. - 2007. - Vol. 93. - P. 1339-1350.
33.Ypenburg C., Westenberg J.J., Bleeker G.B. et al. Noninvasive imaging in cardiac resynchronization therapy - part 1: selection of patients // Pacing. Clin. Electrophysiol. - 2008. - Vol. 31. - P. 1475-1499.
34.Chung E.S., Leon A.R., Tavazzi L. et al. Results of the Predictors of Response to CRT (PROSPECT) trial // Circulation. - 2008. - Vol. 117. - P. 2608-2616.
35.Suffoletto M.S., Dohi K., Cannesson M. et al. Novel speckle-tracking radial strain from routine black- and-white echocardiographic images to quantify dyssynchrony and predict response to cardiac resynchronization therapy // Circulation. - 2006. - Vol. 113. - P. 960-968.
36.Kapetanakis S., Kearney M.T., Siva A. et al. Real-time three-dimensional echocardiography: a novel technique to quantify global left ventricular mechanical dyssynchrony // Circulation. - 2005. - Vol. 112. - P. 992-1000.
37.Ypenburg C., van Bommel R.J., Delgado V. et al. Optimal left ventricular lead position predicts reverse remodeling and survival after cardiac resynchronization therapy // J. Am. Coll. Cardiol. - 2008. - Vol. 52. - P. 1402-1409.
ГЛАВА 04. ЭХОКАРДИОГРАФИЯ
Frank A. Flachskampf, Jens-Uwe Voigt и Werner G. Daniel
РЕЗЮМЕ
Ультразвуковое исследование сердца, или эхокардиография (ЭхоКГ), - наиболее используемый визуализирующий метод диагностики ССЗ. 2D- и 3D-ЭхоКГ позволяет в режиме реального времени детально исследовать морфологию сердца с очень высоким пространственным (‹1 мм) и временным (>100 кадров/с) разрешением. Кроме того, допплерография и методика отслеживания дифракционных пятен ("speckle tracking") предоставляют возможность определения скорости кровотока и движения миокарда в любой точке сердца, позволяя оценивать кровоток при клапанных (стенозе или регургитации) и врожденных пороках, а также движение и деформацию миокарда, что способствует выявлению функциональных нарушений, например при ишемии или кардиомиопатиях. ЭхоКГ неинвазивна и не связана с воздействием ионизирующего излучения; эхокардиографическое оборудование портативно и дает возможность выполнения исследования у постели больного. По особым показаниям выполняют "полуинвазивное" (чреспищеводное) или инвазивное (внутрисосудистое) УЗИ. Последние достижения в ЭхоКГ - ее использование при нагрузочных пробах, особенно для выявления ишемии миокарда, и при контрастировании правых и левых камер сердца. Благодаря повсеместной доступности, отсутствию вредного воздействия, относительно низкой стоимости в сочетании с высокой диагностической ценностью ЭхоКГ стоит первой в ряду визуализирующих методик в кардиологии и показана практически при любом ССЗ.
ФИЗИЧЕСКИЕ И ТЕХНИЧЕСКИЕ ОСНОВЫ ЭХОКАРДИОГРАФИИ
ПРИНЦИПЫ ЭХОКАРДИОГРАФИЧЕСКОЙ ВИЗУАЛИЗАЦИИ. ОЦЕНКА СКОРОСТНЫХ ПОКАЗАТЕЛЕЙ С ПОМОЩЬЮ ДОППЛЕРОГРАФИИ И МЕТОДИКИ "SPECKLE
TRACKING"
Звуковая волна - распространение упругих колебаний в среде, например в воде или воздухе. Будучи волной, звук характеризуется следующими параметрами: длиной волны λ (миллиметры или микрометры), частотой f (с-1 или герцы) и скоростью распространения c (метры в секунду, рис. 4.1). Эти параметры связаны между собой следующим образом:
с = f × λ.
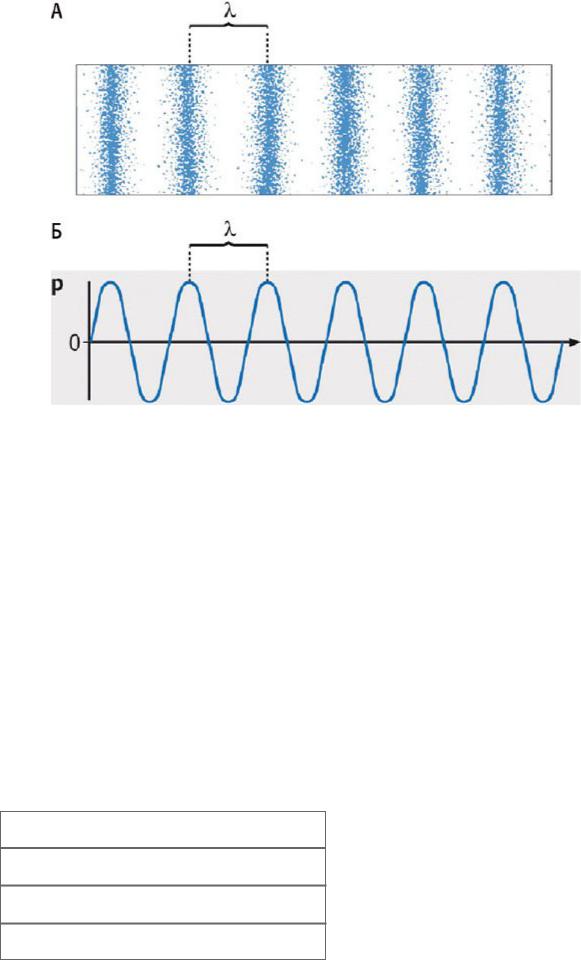
Рис. 4.1. Схематичное изображение звуковой волны. Верхний рисунок: чередующиеся зоны сжатия (высокого давления) и разрежения (низкого давления); расстояние между двумя пиками сжатия соответствует длине волны (λ). Нижний рисунок: звуковая волна представлена в виде синусоиды. Значение давления отмечено на оси Y, расстояние - на оси X. Так же выглядит кривая изменения давления во времени (по оси X): интервал времени между двумя пиками сжатия рассчитывают по формуле 1/f , где f - частота. Изменено (с
разрешения): Weyman A.E. Principles and Practice of Echocardiography, 2nd edn. - Philadelphia, PA: Lea & Febiger, 1994.
Звуковые волны с частотами выше порога человеческого восприятия (>20 000 Гц) называют ультразвуком. Скорость звука в воде значительно выше, чем в воздухе, и составляет 1540 м/с. Принято считать, что приблизительно с такой же скоростью ультразвук распространяется в биологических тканях. В диагностических целях обычно используют ультразвуковые волны с частотами в диапазоне от 2 до 7 МГц (1 МГц = 106 Гц), что соответствует длине волны от 0,8 до 0,2 мм. При внутрисосудистых исследованиях применяют датчики с частотами до 40 МГц (табл. 4.1). Одной из характеристик звуковой волны является интенсивность звука - величина,
равная отношению потока звуковой энергии через поверхность, перпендикулярную направлению распространения звука, к площади этой поверхности (Вт/cм2). Интенсивность генерируемого в эхокардиографах ультразвука считают биологически безопасной. Ввиду трудности измерения интенсивности ультразвука в тканях, на экране эхокардио-графа обязательно указывается суррогатный показатель интенсивности ультразвука: "механический индекс" - безразмерная величина, представляющая собой отношение максимального давления разряжения (мегапаскали, МПа) к квадратному корню частоты ультразвука (мегагерцы, МГц). Для диагностических исследований этот показатель не должен превышать 2.
Таблица 4.1. Частоты диагностического ультразвука
Слышимый звук: ‹20 кГц (1 кГц = 103 Гц)
Трансторакальная ЭхоКГ: 2-3 МГц (1 МГц = 106 Гц)
Чреспищеводная ЭхоКГ: 5-7 МГц
Внутрисосудистое УЗИ: до 40 МГц
Акустическая микроскопия: 100-1000 МГц
При прохождении ультразвука через ткани между ними происходят следующие взаимодействия.
•При удалении от источника ультразвука его энергия рассеивается (превращаясь главным образом в тепло), а интенсивность ультразвука уменьшается. Этот процесс называется затуханием и выражен тем сильнее, чем выше частота ультразвука. По этой причине ультразвуковые волны с более низкой частотой, проходя единицу расстояния, затухают в меньшей степени, чем волны с более высокой частотой, и, следовательно, лучше подходят для исследования расположенных глубоко структур.
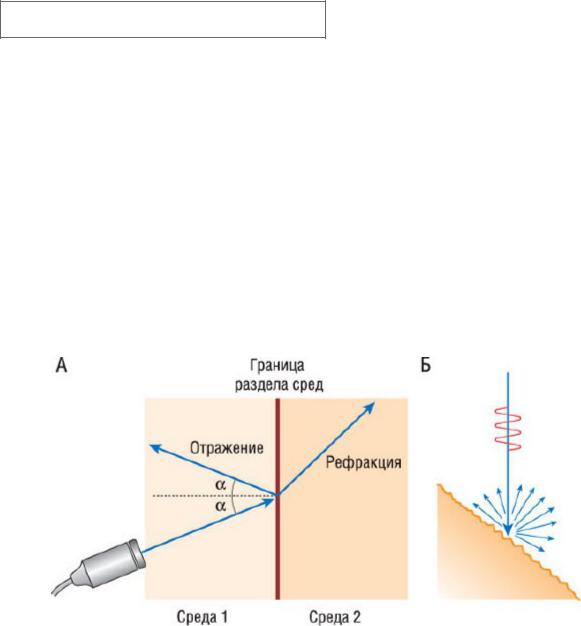
•При достижении ультразвуком границы раздела двух сред с различными акустическими свойствами возможны следующие взаимодействия (рис. 4.2). Если две среды сильно различаются в акустическом отношении, например воздух и вода (количественно это различие выражается таким показателем, как "акустическое сопротивление"), происходит отражение, то есть ультразвук не проходит дальше, а возвращается обратно под углом, зависящим от угла падения. Отражение может быть полным или частичным. Если граница раздела сред мала, то есть ее размер сопоставим с длиной звуковой волны, происходит рассеивание, при котором вместо однонаправленного отражения ультразвук распространяется во многих направлениях. В теле человека могут возникать любые из вышеперечисленных взаимодействий ультразвука с тканью. Наличие в ткани множества элементов, отражающих ультразвук, приводит к сложным межволновым взаимодействиям и формирует ее эхоструктуру, или рисунок из дифракционных пятен ("speckles").
Рис. 4.2. Отражение, рефракция и рассеивание звука. Все эти процессы происходят при взаимодействии ультразвука с тканью. А - при достижении звуковой волной границы двух сред с разным акустическим сопротивлением она частично отражается в направлении, которое зависит от угла падения. Величина отраженной энергии возрастает с увеличением разницы в акустическом сопротивлении этих двух сред. Другая часть звуковой волны проникает дальше, но направление распространения волны изменяется. Это явление называют рефракцией. Б - если размер отражающей поверхности находится в диапазоне длины звуковой волны или поверхность "неровная", волна отражается во всех направлениях. Это явление называют рассеиванием. Обратите внимание, что часть звуковой энергии отражается и в направлении источника ультразвуковой волны. Источник
(с разрешения): Flachskampf F.A. Kursbuch Echokardiographie, 4th edn. - Stuttgart: Thieme, 2008.
•При прохождении ультразвука через ткань происходит незначительное искажение формы волны, которое можно представить в виде добавления "гармонических частот" к исходной "основной" частоте. Эти "гармоники", несмотря на слабую интенсивность, могут быть выделены из отраженного ультразвукового сигнала и использованы для формирования изображения, поскольку они улучшают соотношение "сигнал-шум" вследствие их меньшей склонности к созданию артефактов и к другим влияниям, ухудшающим качество изображения.
•Отраженная от движущегося объекта ультразвуковая волна меняет частоту пропорционально скорости объекта относительно источника ультразвука. Этот эффект, названный по имени
австрийского физика Кристиана Допплера, позволяет измерять скорость движущейся крови или ткани сердца путем анализа изменения частоты (Δf) отраженного ультразвука с использованием уравнения Допплера:
Δf = 2 × f × v / c,
где f - частота ультразвука, генерируемого датчиком; c - скорость распространения звука в ткани; v - скорость движущегося объекта (к датчику или от датчика).
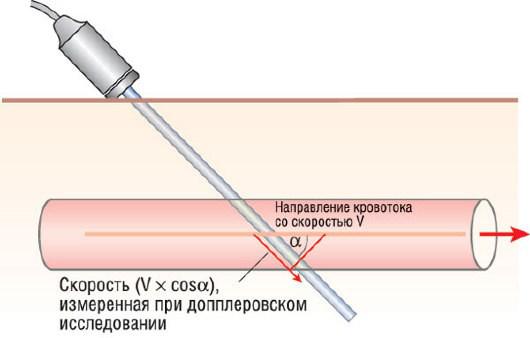
• Скорость (v) движущегося объекта относительно источника ультразвука (в нашем случае - датчика) может быть рассчитана из полученной величины сдвига частоты и известной скорости распространения ультразвука в ткани организма. Однако рассчитываемая скорость объекта зависит еще и от угла между ультразвуковым пучком и направлением вектора движения (рис. 4.3). Уравнение Допплера позволяет точно рассчитать скорость движения отражателя ультразвука только в двух направлениях (к датчику или от него). В случае несовпадения вектора движения объекта и ультразвукового пучка скорость окажется заниженной. Различие между измеренной (Vдопп) и истинной (Vист) скоростями определяется следующей зависимостью:
Vдопп = Vист × Cos α,
где α - угол между истинным вектором скорости и направлением ультразвукового пучка.
Рис. 4.3. Зависимость скорости потока крови от угла локации. Если ось ультразвукового пучка находится под углом к направлению кровотока, то расчетная скорость кровотока (Vдопп) отражает только величину проекции вектора потока на ось ультразвукового пучка. Таким образом, недооцениваются скорости, не совпадающие с направлением ультразвукового пучка. Изменено (с разрешения): Flachskampf F.A. Kursbuch Echokardiographie, 4th edn. - Stuttgart: Thieme, 2008.
• Необходимо отметить, что допплеровским методом можно измерять скорости как очень слабо отражающих и относительно быстро движущихся объектов, например форменных элементов крови (обычные скорости ‹1,5 м/с), так и сильно отражающих и относительно медленно движущихся объектов в тканях сердца, главным образом миокарда (обычные скорости ‹15 см/с; рис. 4.4). Допплеровские сигналы, получаемые от кровотока и тканей, избирательно записываются и отображаются на экране при использовании соответствующих электронных фильтров.

Рис. 4.4. Принцип методики отслеживания дифракционных пятен: на первом кадре определяется зона изображения с характерными особенностями, а на последующих кадрах отслеживается ее перемещение относительно исходного положения. При известной частоте кадров можно оценить величину и направление смещения выделенной зоны, а на основании этих данных можно вычислить параметры, характеризующие скорость и деформацию миокарда.
• Измерения скорости кровотока очень важны при оценке клапанных пороков: они дают возможность рассчитывать степень стеноза, величину УО, выраженность регургитации, патологических сбросов (шунтов) и др. С другой стороны, тканевые скорости предоставляют информацию о функционировании миокарда, которая может быть дополнена анализом регионарной деформации. Не очень давно появился другой способ измерения скорости движения ткани с использованием так называемой методики отслеживания дифракционных пятен ("speckle tracking"), при которой текстурные характеристики ткани ("speckles", "пятнышки", или дифракционные пятна) отслеживаются покадрово в 2D-изображении, что позволяет оценивать движение и скорость отдельных участков миокарда (см. рис. 4.4). При данной методике, которая еще только развивается, определение тканевых скоростей не зависит от угла распространения ультразвукового пучка, что дает возможность ее применения в будущем для оценки скоростей кровотока.
ТЕХНИЧЕСКИЕ ОСНОВЫ ЭХОКАРДИОГРАФИИ
В эхокардиографах фокусированный ультразвук генерируется датчиком, содержащим большое количество пьезоэлектрических элементов (кристаллов), преобразующих электромагнитные волны в ультразвуковые и наоборот. Ультразвуковой датчик и генерирует, и принимает ультразвуковые волны. ЭхоКГ проводят в импульсном режиме, то есть очень короткий период передачи ультразвука сменяется периодом приема отраженного ультразвука. Исходя из скорости распространения ультразвука в тканях и времени, затраченного ультразвуковым импульсом на достижение объекта и возвращение обратно к датчику, можно рассчитать расстояние от датчика до объекта (рис. 4.5). Этот принцип лежит в основе построения изображений. Один пьезоэлектрический элемент (кристалл) может создавать только одномерное изображение объектов, расположенных на пути распространения сгенерированной им ультразвуковой волны. Это принцип самого первого ЭхоКГ-режима - M-режима ("M" - от английского "motion"), до сих пор часто используемого для линейных измерений (рис. 4.6). Для получения 2D-ЭхоКГ-изображения необходимо множество кристаллов ("2D-матрица", состоящая обычно из 64-96 элементов), генерирующих ультразвук практически одновременно. Электронно наводимый ультразвуковой пучок последовательно перемещается и формирует сектор сканирования, что обеспечивает точное отображение сканируемой структуры, то есть сердца (рис. 4.7-4.9). Электромагнитные колебания, образующиеся пьезоэлектрическими элементами датчика при восприятии отраженного от тканей ультразвукового эха, формируют радиочастотный сигнал. Он проходит цифровую обработку в несколько этапов (детектирование огибающей, компрессия, преобразование развертки) для получения в итоге цифровых изображений в формате DICOM (Digital Images and Communication in Medicine - цифровые изображения и коммуникация в медицине), который поддерживают все производители эхокардиографического оборудования (более детально см. [1, 2]). Все это происходит так быстро, что позволяет создавать изображение сердца в режиме реального времени с частотой кадров более 100 в секунду. Такое временное разрешение недостижимо для других визуализирующих методик, используемых в кардиологии.
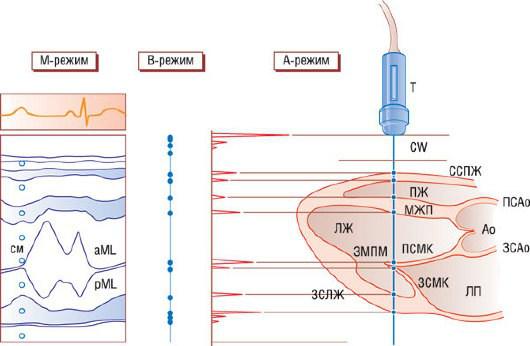
Рис. 4.5. Принцип измерения расстояния с использованием импульсного ультразвука. На этом схематическом примере импульс P, представляющий собой короткую серию ультразвуковых волн, сгенерированных датчиком, отражается от стенки контейнера и возвращается обратно к датчику за измеренный временной интервал T. Так как скорость распространения ультразвука (с) в среде известна, можно рассчитать расстояние до объекта по формуле с × Т / 2. Изменено (с разрешения): Weyman A.E. Principles and Practice of Echocardiography, 2nd edn. - Philadelphia, PA: Lea & Febiger, 1994.
Рис. 4.6. Схематичная диаграмма формирования М-режима ЭхоКГ. Показано продольное сечение сердца по длинной оси от основания до верхушки. Единственный ультразвуковой пучок от датчика (T), расположенного на грудной клетке, направлен так, чтобы пересекать структуры миокарда спереди назад. При этом визуализируются свободная стенка (СС) и полость ПЖ, МЖП, полость ЛЖ, передняя и задняя створки МК (ПСМК и ЗСМК) и задняя стенка ЛЖ (ЗСЛЖ). Сигналы, отраженные от границ структур, могут быть представлены на экране осциллоскопа в трех видах: A-режим, B-режим и М-режим. Ao - аорта; ПСAo и ЗCAo - передняя и задняя стенка аорты; ЗМПМ - заднемедиальная папиллярная мышца.
