
Накопление АМФ, АДФ (аллостерические активаторы) приводит к стимуляции гликолиза, ЦТК и окислительного фосфорилирования, что приводит к восстановлению резервов АТФ и креатинфосфата. Это самый быстрый способ ресинтеза АТФ. Максимально эффективен. Не требует присутствия кислорода, не дает побочных нежелательных продуктов, включается мгновенно. Его недостаток – малый резерв субстрата (хватает только на 20 с работы). Обратная реакция может протекать в митохондриях с использованием АТФ, образовавшейся в процессе окислительного фосфорилирования.
Мембрана митохондрий хорошо проницаема как для креатина, так и для креатинфосфата, а креатинфосфокиназа есть и в саркоплазме, и в межмембранном пространстве митохондрий.
Миокиназная реакция. Протекает только в мышечной ткани. АДФ  АТФ + АМФ.
АТФ + АМФ.
Реакция катализируется миокиназой (аденилаткиназой). Главное значение этой реакции заключается в образовании АМФ – мощного аллостерического активатора ключевых ферментов гликолиза, гликогенолиза.
Анаэробный гликолиз и гликогенолиз. Не требуют присутствия кислорода (анаэробные процессы). Обладают большим резервом субстратов. Используется гликоген мышц (2 % от веса мышцы) и глюкоза крови, полученная из гликогена печени. Недостатки следующие: небольшая эффективность – 3 АТФ на один глюкозный остаток гликогена; накопление недоокисленных продуктов (лактат); анаэробный гликолиз начинается не сразу – только через 10-15 с после начала мышечной работы.
Окислительное фосфорилирование. Преимущества: это наиболее энергетически выгодный процесс – синтезируется 38 молекул АТФ при окислении одной молекулы глюкозы. Имеет самый большой резерв субстратов: может использоваться глюкоза, гликоген, глицерин, кетоновые тела. Продукты распада (CO2 и H2O) практически безвредны. Недостаток: требует повышенных количеств кислорода.
Важную роль в обеспечении мышечной клетки кислородом играет миоглобин, у которого сродство к кислороду больше, чем у гемоглобина: при парциальном давлении кислорода, равном 30 мм.рт.ст., миоглобин насыщается кислородом на 100 %, а гемоглобин - всего на 30 %. Поэтому миоглобин эффективно отнимает у гемоглобин доставляемый им кислород.
Основные источники энергии в мышечной ткани в покое: β- окисление жирных кислот, кетоновые тела; при работе (в зависимости от снабжения О2) – анаэробный гликолиз, гликогенолиз, ЦТК.
В скелетных мышцах, кроме адениловых нуклеотидов (АТФ, АДФ, АМФ), креатинфосфата, креатина содержатся и другие небелко-
531
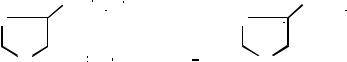
вые азотистые вещества – карнозин и ансерин. Это имидазол со-
держащие дипептиды. Синтезируются из конечного продукта распада пиримидиновых нуклеотидов - β-аланина. Эти соединения активируют Na+K+АТФазу, а также увеличивают амплитуду мышечного сокращения, предварительно сниженную утомлением.
N |
|
|
CH2 |
|
CH |
|
|
COOH |
N |
|
|
|
CH2 |
|
CH |
|
|
COOH |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
O |
|
|
NH |
|
CH2 |
|
CH2 |
|
|
|
|
|
|
|
O |
|
|
|
NH |
|
CH2 |
|
CH2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
N |
|
|
|
|
|
|
|
|
NH2 |
|
|
N |
|
|
|
|
|
|
|
|
|
NH2 |
|||||||||||
|
|
|
|
C |
|
|
|
|
|
|
|
C |
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
карнозин (β-аланин-гистидин) |
|
|
CH3 |
ансерин (N-метилкарнозин) |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||||||
Изменение метаболизма при мышечной работе
Уменьшение концентрации АТФ смещает равновесие креатинфосфокиназной реакции вправо: используется креатинфосфат. Далее включается гликолиз, так системе окислительного фосфорилирования необходима 1 мин для запуска. Это пусковая фаза мышечной работы.
Дальше изменения метаболизма зависят от интенсивности мышечной работы: если мышечная работа длительная и небольшой интенсивности, то в дальнейшем клетка получает энергию путем окислительного фосфорилирования – это работа в "аэробной зоне"; если мышечная работа субмаксимальной интенсивности, то - дополнительно к окислительному фосфорилированию включается анаэробный гликолиз
– это наиболее тяжелая мышечная работа – возникает "кислородная задолженность", это – работа "в смешанной зоне"; если мышечная работа максимальной интенсивности, но непродолжительная, то механизм окислительного фосфорилирования не успевает включаться. Работа идет исключительно за счет анаэробного гликолиза. После окончания максимальной нагрузки лактат поступает из крови в печень, где идут реакции глюконеогенеза, или лактат превращается в пируват, который дальше окисляется в митохондриях. Для окисления пирувата нужен кислород, поэтому после мышечной работы максимальной и субмаксимальной интенсивности потребление кислорода мышечными клетками повышено – возвращается кислородная задолженность (долг).
Существует наследственная предрасположенность к мышечной работе – у одних людей больше "быстрых" мышечных волокон – им рекомендуется заниматься теми видами спорта, где мышечная работа максимальной интенсивности, но кратковременная (тяжелая атлетика, бег на короткие дистанции и тому подобное). Люди, в мышцах которых больше "красных" ("медленных") мышечных волокон, наибольших успехов добиваются в тех видах спорта, где необходима длитель-
532
ная мышечная работа средней интенсивности, например, марафонский бег (дистанция 40 км). Для определения пригодности человека к определенному типу мышечных нагрузок используется пункционная биопсия мышц.
В результате скоростных тренировок (bodybuilding) утолщаются миофибриллы, кровоснабжение возрастает, но непропорционально увеличению массы мышечных волокон, количество актина и миозина возрастает, увеличивается активность ферментов гликолиза и креатинфосфокиназы.
Более полезны для организма тренировки "на выносливость". При этом мышечная масса не увеличивается, но увеличивается количество миоглобина и митохондрий.
Лекция 52
БИОХИМИЯ НЕРВНОЙ ТКАНИ
1. Возникновение и проведение нервного импульса
Нервные импульсы – это электрические сигналы, создаваемые током ионов через плазматическую мембрану нейронов. В создании нервного импульса участвуют Na+K+АТФаза, натриевые и калиевые каналы.
Na+K+АТФаза выводит из клетки 3 иона Na и вводит 2 иона K+, это активный транспорт с затратой 1 молекулы АТФ (движение про тив градиента концентрации – Na – снаружи, К – внутри).
Движение Na+ по натриевым и K+ по калиевым каналам происходит по градиенту концентрации.
1.1.Потенциал покоя
Всостоянии покоя по разные стороны мембраны существует разность потенциалов около 60-70 мв (отрицательный заряд внутри).
Причины возникновения потенциала покоя
Ионы К+ стремятся покинуть клетку (где их много), чтобы уровнять внешнюю и внутреннюю концентрации. В клетке остается избыток анионов (белки, нуклеиновые кислоты), которые не могут выходить наружу. Это создает на внутренней поверхности мембраны отрицательный заряд. Ионы Cl– стремятся проникнуть в клетку по градиенту концентрации.
533
Ионы Na двигаются внутрь клетки по градиенту концентрации, но гораздо в меньших количествах, чем выводится K+, т.к. проницаемость мембраны для Na+ составляет 1/20 по сравнению с проницаемостью для K+.
Вывод: в состоянии покоя ионы Na и K перемещаются по градиенту концентрации (K+ из клетки, Na+ – внутрь), причем Na+ в меньших количествах. Это создает потенциал покоя.
1.2. Потенциал действия
Возбуждение нерва временно вызывает резкое возрастание проводимости нервного волокна для K+, Na+. Сначала меняется проницаемость мембраны для Na+, она возрастает в 100 раз, Na+ по своим каналам движется в клетку. В результате потока Na+ внутри аксона происходит вначале деполяризация мембраны (заряд равен 0), а затем поляризация, однако теперь внутри аксона положительный заряд, Na+- каналы спонтанно закрываются и открываются K+-каналы. K+ выходит из клетки и мембранный потенциал опять становится отрицательным. Ионные каналы остаются открытыми непродолжительное время, после их закрытия Na+K+АТФаза восстанавливает исходное распределение ионов по сторонам мембраны.
Диффузия ионов из места возбуждения в соседние участки аксона снижает там потенциал покоя и вызывает открытие Na-каналов, т.е. развитие потенциала действия. В безмиелиновых волокнах Na-каналы располагаются вдоль всего аксона равномерно, поэтому потенциал действия распространяется по аксону постепенно. В миелиновых волокнах Na-каналы сосредоточены в перехватах Ронвье, поэтому потенциал действия перескакивает от перехвата к перехвату, вследствие чего импульс проводится быстрее и эффективнее.
2. Передача возбуждения в синапсах
Достигнув конца аксона, возбуждение передается другой клетке. Клетки разделены синаптической щелью. Синапс образован мембранами контактирующих клеток. Передача возбуждения происходит с помощью медиаторов.
Каждый тип синапса использует только определенный тип медиатора: холинэргические синапсы – ацетилхолин, адренэргические – катехоламины.
534
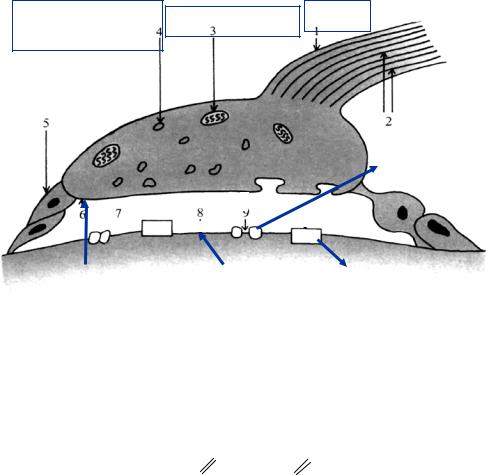
Строение холинэргического синапса
синаптические митохондрии аксон
пузырьки
|
клетки |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нейротрубочки |
|
|
||
|
Швана |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
рецептор |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
ацетилхолина |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
синаптическая щель |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пресинаптиче- |
|
|
|
|
|
|
|
|
|
|||
|
|
постсинаптиче- |
|
|
|
|
|
|
|||||
|
|
|
ацетилхолинэстераза |
|
|||||||||
|
ская мембрана |
|
ская мембрана |
|
|
||||||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.1. Холинэргическая передача
Ацетилхолин синтезируется вблизи пресинаптического окончания аксона (путем переноса ацетильной группы от ацетил-КоА на хо-
лин), фермент холинацетилтрансфераза.
O O
OH-CH2-CH2-N+(CH3)3 + CH3-C~SKoA H3C-C-CH2-CH2-N+(CH3)3 + HSKoA
Образовавшийся ацетилхолин попадает в синаптические пузырьки. Его высвобождение из пузырьков происходит порциями в ответ на возбуждение, передаваемое от аксона.
После освобождения в щель ацетилхолин взаимодействует с рецепторами на постсинаптической мембране.
Еще в 1953 г. Д. Нахманзон предположил, что этот рецептор представляет собой белок, который при взаимодействии с нейромедиатором претерпевает конформационные изменения, ведущие к образованию трансмембранного ионного канала. Холинорецепторы подразделяются на два типа: никотиновые и мускариновые. Никотиновые рецепторы способны активироваться никотином и находятся в основном в месте контакта аксонов со скелетными мышцами, в то время как мускариновые рецепторы имеют высокое сродство к мускарину и сосредоточены в мозге, секреторных клетках, гладких и сердечной мышцах.
Связывание ацетилхолина с никотиновыми рецепторами приводит к изменению конформации рецепторов, которое передается аденилатциклазе, локализованной в постсинаптической мембране. Запуск
535
аденилатциклазного механизма приводит к фосфорилированию белков натриевых и калиевых каналов и увеличению проницаемости мембраны для Na+ и К+. Как следствие происходит деполяризация клеточной мембраны за счет быстрого входа ионов натрия, что в конечном итоге ведет к возбуждению мышечной клетки. Следовательно, биологическая функция никотинового ацетилхолинового рецептора заключается в изменении ионной проницаемости постсинаптической мембраны в ответ на связывание ацетилхолина. После этого ацетилхолин гидролизуется ацетилхолинэстеразой до холина и рецептор переходит в исходное состояние.
Ацетилхолиновый рецептор локализован в зоне синаптических контактов с очень высокой плотностью, превышающей 1 молекулу рецептора на 100 нм2 поверхности мембраны. Такая плотность позволяет секретируемым молекулам ацетилхолина вступать во взаимодействие с рецептором, избежав гидролиза ацетилхолинэстеразой.
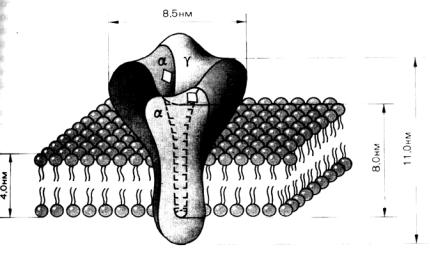
Строение ацетилхолинового рецептора
В электрофизиологических экспериментах установлены основные параметры одиночного канала холинорецептора: его проводимость составляет 20 пСм (См – Сименс, единица измерения электропроводимости), а время жизни не превышается 1-3 мс. Канал проницаем для ионов натрия, калия, кальция и даже некоторых органических катионов. С учетом размера последних полагают, что канал представляет собой пору, размеры которой в самой узкой части должны быть не мене
0,65×0,65 нм.
Согласно существующим моделям функционирования канала ацетилхолинового рецептора, рецептор может находится в трех состояниях: покоя, открытом (активированном) и десенситизированном. Активация канала достигается взаимодействием с ацетилхолином и явля-
536

ется быстрым процессом, протекающим в миллисекундном диапазоне. В десенситизированном состоянии медиатор все еще связан с рецептором, но канал уже закрыт. Переход из одного состояния в другое, повидимому, сопровождается существенными конформационными изменениями субъединиц белкового комплекса. Ацетилхолиновый рецептор никотинового типа представляет собой трансмембранный комплекс пяти гликопротеинов, образующий хемовозбудимый ионный канал. В отсутствие ацетилхолина канал находится в закрытом состоянии. При связывании с ацетилхолином канал на короткое время открывается для прохождения через него ионов натрия и калия, а затем переходит в десенситизированное состояние.
После диссоциации ацетилхолина из комплекса рецептором он разрушается под действием ацетилхолинэстеразы. Ацетилхолинэстераза связана с наружной стороной постсинаптической мембраны. В среднем на каждый ацетилхолиновый рецептор приходится 1 молекула
фермента.
O O
H3C-C-O-CH2-CH2-N+(CH3)3+H2O H3C-C-OH+OH-CH2-CH2-N+(CH3)3
ацетат холин
Нарушение холинэргической передачи
При заболевании миастения в крови находят антитела против собственных рецепторов ацетилхолина, что приводит к нарушению нейромышечной передачи, что проявляется мышечной слабостью (широкий зрачок, расслабление мышц). Лекарственные препараты (неостигмин, эзерин) ингибируют ацетилхолинэстеразу, тем самым они усиливают действие ацетилхолина. Еще более мощными ингибиторами фермента являются органические фторфосфаты. Они образуют прочную связь с ацетилхолинэстеразой и вызывают смерть от остановки дыхания. Это нервнопаралитические яды – табун, зарин.
|
Соединения, оказывающие влияние |
|
|
|
на синаптическую передачу |
|
|
Холинэргические синапсы |
|
|
|
Ботулотоксин |
|
Белок клостридий. Тормозит освобождение ацетилхоли- |
|
|
на из синаптических пузырьков. Источник – неправильно |
|
|
хранившиеся мясные, рыбные продукты и грибы. |
Никотин |
|
Алкалоид табака. Имитирует действие ацетилхолина на |
|
|
«никотиновые» рецепторы |
Мускарин |
|
Алкалоид гриба-мухомора. Имитирует действие ацетил- |
537
|
холина на «мускариновые» рецепторы |
Тубокурарин |
Основной компонент кураре – яда из некоторых южно- |
|
американских растений. Блокирует рецепторы нервно- |
|
мышечных синапсов скелетной мускулатуры (миорелак- |
|
сант) |
Дитилин |
Синтетический релаксант с курареподобной активностью |
Атропин |
Алкалоид растений семейства пасленовых. Блокирует |
|
мускариновые рецепторы. Применяется для устранения |
|
спазма гладкой мускулатуры. |
Физостигмин |
Алкалоид растений семейства бобов. Ингибитор ацетил- |
|
холинэстеразы. Применяется в лечении глаукомы. |
|
Зомби |
Дословно «зомби» означает «живой мертвец». Понятие это пришло с острова Гаити, где существовал, да, пожалуй, и поныне существует целый культ «зомби». Он состоит как бы из двух звеньев: сначала убийство, а затем возвращение к жизни. Жертве, которую намерены превратить в «зомби», подмешивают в еду яд, так называемую «пудру зомби». Основным компонентом для ее приготовления является рыба пузан. Она напоминает воздушный шарик, утыканный иголками, и содержит в себе яд тетродотоксин. Это очень сильный нервно-паралитический яд, превышающий степень воздействия цианистого калия в 500 раз. У жертвы сразу же прекращается дыхание, синеет поверхность кожи, стекленеют глаза. Лишь очень опытный специалист может определить, что смерть человека видимая, его искусственно ввели в состояние клинической смерти. Через несколько дней такого человека похищают с кладбища, чтобы якобы вернуть его к жизни. Так он становится «зомби». Осознание своего «я» возвращается к нему неполностью или не возвращается вовсе, остаются животные инстинкты, он легко внушаем.
2.2. Адренэргическая передача
Медиаторами адренэргической передачи являются катехола-
мины – норадреналин, адреналин, дофамин. Механизм их синтеза в нервной системе такой же, как и в мозговом веществе надпочечников. Норадреналин встречается в основном в симпатической нервной системе, в стволе мозга и в гипоталамусе. Дофамин обнаруживается в полосатом теле и в базальных ганглиях. В адренэргических синапсах нет систем, разрушающих медиаторы в синаптической щели. Вместо этого на пресинаптической мембране есть рецепторы для медиатора, взаимодействие с ними прекращает освобождение в щель новых порций медиатора. Кроме этого, в синаптической щели есть специальная
538
транспортная система для выкачивания медиатора из синапса. Реабсорбированный норадреналин либо вновь повторно исполь-
зуется, либо инактивируется ферментами МАО, метилированием.
С нарушением дофаминэргической передачи связана болезнь Паркинсона. У больных отмечается ригидность мышц, маскообразное лицо, задержка начала движений. Концентрация дофамина в хвостатом ядре и скорлупе снижена. При шизофрении высказано предположение об избыточной дофаминэргической передаче. Известно, что все лекарства, которые являются эффективными при шизофрении, вызывают блокаду дофаминовых рецепторов. Отсюда побочное действие этих препаратов: возникновение симптомов, характерных для болезни Паркинсона.
Соединения, оказывающие влияние на синаптическую передачу
|
Адренэргические синапсы |
|
|
|
|
Дигидроэрготамин |
|
Продукт восстановления эрготамина спорыньи. |
|
|
Блокатор α-адренорецепторов. Применяется в ле- |
|
|
чении мигрени. |
Пропранол |
|
Синтетический блокатор β-адрено-рецепторов. |
(анаприлин) |
|
Применяется в лечении стенокардии, нарушении |
|
|
ритма сердца. |
Имизин |
|
Синтетический ингибитор обратного переноса |
|
|
катехоламинов из синаптической щели в нервное |
|
|
окончание. Применяется в лечении депрессивных |
|
|
психозов. |
Ипразид |
|
Синтетический ингибитор монооксидазы, способ- |
|
|
ствующий накоплению катехоламинов в синап- |
|
|
сах. Применяется в лечении депрессивных психо- |
|
|
зов. |
Резерпин |
|
Алкалоид раувольфии. Ингибитор депонирования |
|
|
катехоламинов в пузырьках. Применяется как |
|
|
снижающий артериальное давление и в лечении |
|
|
шизофрении. |
|
2.3. Тормозные медиаторы |
|
Главным тормозным медиатором в нервной системе является
гамма-аминомасляная кислота (ГАМК). ГАМК увеличивает прони-
цаемость постсинаптических мембран для К+. В результате отдаляется мембранный потенциал от порогового уровня, при котором возникает потенциал действия. Инактивация ГАМК осуществляется путем трансминирования.
539
Глицин – тормозной медиатор в спинном мозге и в большинстве структур ствола мозга. Торможение осуществляется в результате повышения проводимости постсинаптической мембраны для Cl–, что приводит к ее гиперполяризации.
Соединения, оказывающие влияние на синаптическую передачу
|
Глициновые синапсы |
|
|
Стрихнин |
Алкалоид семян чилибухи. Связывается с |
|
глициновыми рецепторами, вытесняя глицин. |
|
Тонизирующее средство, при передозировке |
|
– судороги. |
Апамин |
Компонент пчелиного яда. Эффект аналогич- |
|
ный стрихнину. |
|
2.4. Пептидные синапсы |
|
Энкефалины и эндорфины |
Эндорфины – это родовое название эндогенных опиоидных пептидов. Эти пептиды назвали опиоидными из-за способности связываться с теми же рецепторами, которые связывают морфин и др. опиаты. Первыми были открыты два пентапептида, названные энкефалинами: мет-энкефалин и лей-энкефалин (остальные 4 аминокислоты одинаковые). Они, по-видимому, участвуют в интеграции сенсорной информации, имеющей отношение к боли.
В гипоталамусе позже были обнаружены более длинные пептиды α-, β-, γ-эндорфины, которые оказались в 12-100 раз активнее энкефалинов. Эти пептиды участвуют в регуляции эмоциональных ответов, вырабатываются также при мышечной работе.
Имеющиеся данные позволяют предполагать, что эндорфины и энкефалины могут синтезироваться в нервной ткани, в надпочечниках. Особый интерес к этим соединениям связан с надеждой найти анальгетики, к которым не возникает привыкания.
Энкефалины играют важную роль в регуляции функционального состояния ЦНС, сердечно-сосудистой системы, пищеварительной и других. Энкефалины оказывают гепатопротекторное действие. При действии энкефалинов секреторная функция печени, желудка, поджелудочной железы, как правило, снижается, поэтому можно полагать, что физиологическая роль энкефалинов, находящихся в крови, заключается в угнетении секреторной активности регулируемых органов.
Установлена взаимосвязь между содержанием опиоидных пепти-
540
