
- •1. Геномы основных групп организмов: размеры, число генов и их организация. Взаимосвязь организации генома со сложностью организма и особенностями базовых молекулярно-биологических процессов.
- •2. Организация хромосом различных организмов.
- •7. Вилка репликации днк: ферменты и их свойства.
- •8. Стадии репликации.
- •9. Механизм репликации у e.Coli.
- •10. Особенности репликации у эукариот. Ori у дрожжей, их структурно-функциональная организация. Принципы контроля инициации репликации днк эукариот.
- •11. Синтез теломер.
- •12. Повреждения днк в клетке.
- •13. Прямая репарация оснований.
- •14.Механизмы эксцизионной репарации днк (эксцизия нуклеотидов, оснований).
- •15. Репарация ошибок репликации днк (мисмэтч репарация).
- •17.Роль рекомбинационных процессов в репарации повреждений днк. Арест, реверсия и рестарт репликационной вилки.
- •19.Основные типы мобильных генетических элементов эукариот: структура, гены и их продукты.
- •20.Механизм транспозиции ретровирусоподобных ретротранспозонов.
- •21. Общая, или гомологичная, рекомбинация.
- •22.Рекомбинация у бактерий.
- •24.Сайтспецифическая рекомбинация. Молекулярный механизм действия рекомбиназ. Интеграция фага 1 Типы хромосомных перестроек,mосуществляемых при сайтспецифической рекомбинации.
- •26.Промотор прокариот и механизм его распознавания рнк-полимеразой. Альтернативные s-факторы(этого калла нет, но есть не s факторы а сигма, что и описаны ниже). Стадии транскрипционного цикла.
- •27.Промоторы эукариот: размеры, положение, структура и механизм
- •28.Регуляция процесса транскрипции прокариот. Лактозный и триптофановый опероны. Про опероны (изучите как они работают в различных ситуациях, здесь такого нет!!!!)
- •29. Нематричный синтез рнк.
- •30. Информационная рнк, ее структура и функциональные участки, различия у про-и эукариот. Модификация 5'- и 3'-концов транскриптов и ее значение.
- •31. Интроны. Особенности структуры и механизмы сплайсинга. Аутосплайсинг.
- •32. Сплайсинг пре-тРнк.
- •34. Транс-сплайсинг и альтернативный сплайсинг: механизмы, роль, распространение, примеры.
- •35. Процессинг тРнк
- •37. Транспортные рнк: первичная, вторичная и третичная структура, роль модифицированных нуклеотидов.
- •38. Аминоацилирование тРнк. Аминоацил-тРнк-синтетазы, их структура и механизм действия. Специфичность аминоацилирования, механизмы ее контроля.
- •41. Последовательность событий при инициации трансляции эукариот. Белковые факторы, взаимодействующие с рибосомой и с мРнк.
- •42. Механизм элонгации полипептидной цепи в процессе трансляции.
- •44. Ингибиторы синтеза белка
- •45. Молекулярные шапероны семейства Hsp60. Рабочий цикл шаперонина GroEls
- •46. Классы генов теплового шока у b. Subtilis. Рабочий цикл шаперонного комплекса DnaKj-GrpE
- •47. Деградация белка: атф-зависимые протеазы прокариот и 26s-протеасома эукариот. Насчет атф-зависимые протеазы не точно!!!
- •48. Механизм распознавания аномальных белков. Система убиквитинирования белков эукариот
- •49. Секреция белков прокариот: Sec-аппарат и сигнальный пептид (лекция)
- •50. Принципы распределения белков по компартментам клетки эукариот.
- •51. Транспорт белков в митохондрии и хлоропласты, контроль локализации белков внутри этих органелл.
- •52. Устройство и принципы действия бактериальных систем секреции белков.
- •53. Котрансляционная транслокация белка в полость эндоплазматического ретикулума. Srp-частица и ее рецептор.
- •54. Механизм транспорта белков через ядерные поры.
- •5 5. Структура белков-регуляторов транскрипции и механизм их взаимодействия с днк.
- •56. Сенсорные механизмы бактерий. Двухкомпонентные регуляторные системы: принцип действия и примеры. Сигнальные каскады у бактерий.
- •59. Сенсорные механизмы эукариот. Общие принципы детекции и передачи сигнала. Сигнальный путь jak-stat.
- •60.Типы рецепторных протеинкиназ. Механизмы их активации и дальнейшей передачи сигнала. Контроль специфичности сигнализации. Сигнальный путь Ras/mapk в клетка млекопитающих.
- •61.Регуляция экспрессии генов на уровне организации днк. Регуляция активности генов обусловленная метилированием днк
- •62.Регуляция экспрессии генов на уровне транскрипции. Ответ говно выучить надо когда выйчишь лактозный и триптофановый оперон
- •63.Регуляция экспрессии генов на уровне созревания рнк. Регуляция экспрессии генов на уровне трансляции.
- •Редактирование рнк
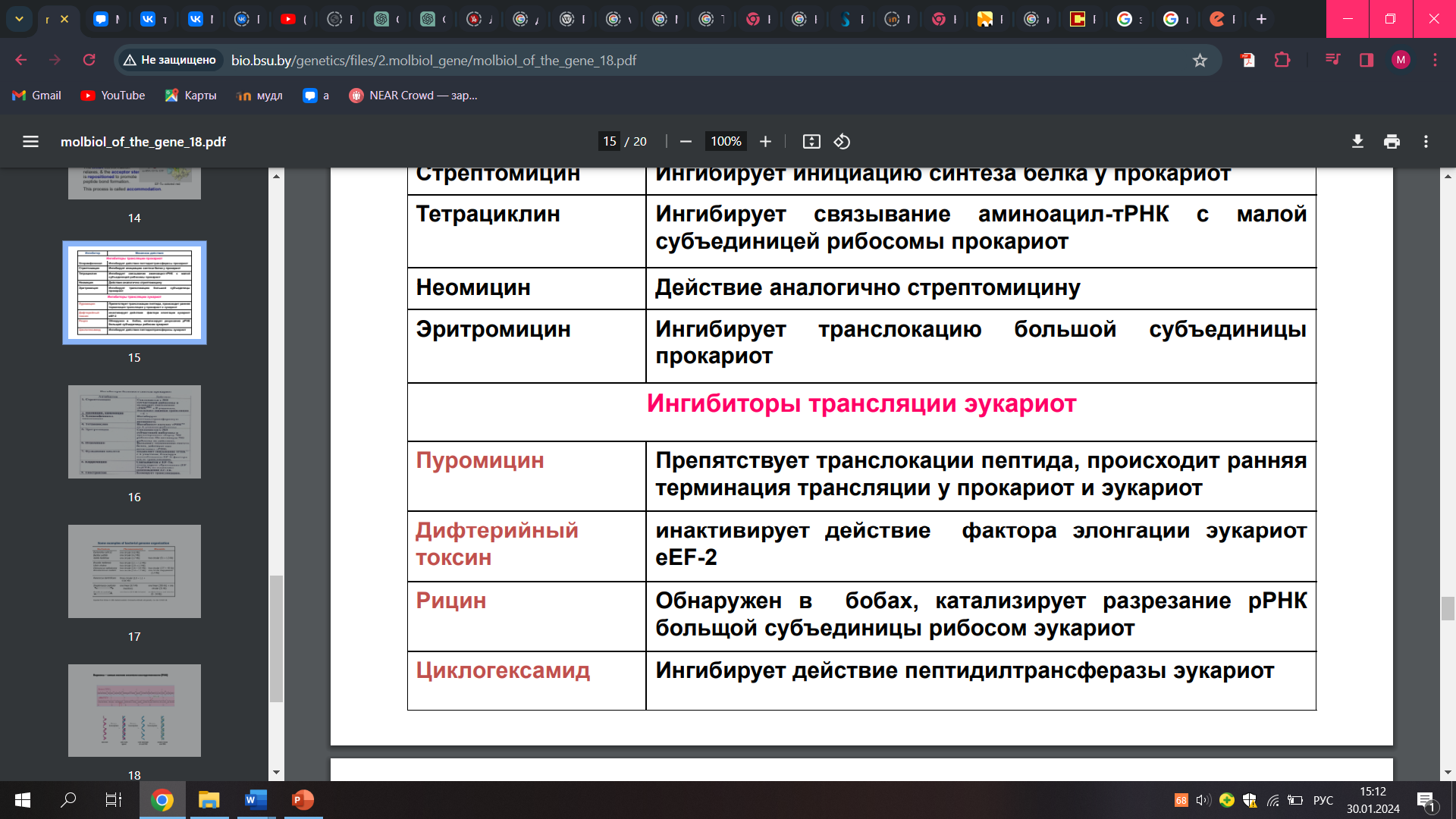
44. Ингибиторы синтеза белка

45. Молекулярные шапероны семейства Hsp60. Рабочий цикл шаперонина GroEls
Белки Hsp70 и Hsp60 называют белками теплового шока (heat shock proteins), поскольку они активно синтезируются клеткой при нагревании. Гомологом Hsp60 у E. coli является GroELS.
GroE (GroEL/GroES) — шаперонин бактерий. Шаперонины— это функциональная группа белков, которая входит в более широкий класс белков — шапероны. Шапероны ассистируют другим белкам при их синтезе, транспорте, деградации. Самая известная функция шаперонов — помогать только что синтезированным или поврежденным белкам обрести правильную пространственную структуру.
GroE представляет собой мультисубъединичный комплекс (состоящий из множества мономеров — субъединиц), похожий на горшочек с крышкой. «Горшочек» — шаперонин GroEL — образован двумя кольцами, лежащими друг на друге. Каждое такое колечко — гептамер, то есть состоит из семи одинаковых белковых субъединиц. Субъединицы в обоих кольцах одинаковые, но находятся в разной конфигурации. «Крышка» (красная на верхнем рисунке) — GroES — это тоже гептамерный кольцевой комплекс, но мономеры в нем другие.
Внутри комплекса Есть полость, в которую попадают Белки, они узнаются шаперонином по торчащим гидрофобным неполярным участком, в норме они не выставлены в цитоплазму, а находятся внутри белковой структуры.
Торчащие гидрофобные участки, это как раз то, что приводит к агрегации не правильно сложенных белков, когда субъединицы кольца GROEL с помощью специально расположенных гидрофобных остатков ловят неправильно сложенный белок, каждая из 7ми субъединиц связывает молекула АТФ с цитоплазмы.
Конформация комплекса меняется, его внутреннее пространство расширяется, что способствует разворачиванию неправильно структуры пойманного белка. Кольцо получает способность соединиться с крышкой GROES, которая утрамбовывает белок. Присоединение GROES снова меняет конформацию субъединиц кольца GROEL. Окружение белка из гидрофобного становился гидрофильным, что может навести его на принятие правильной структуру. При такой конформации комплекса, начинает происходить гидролиз связанных их молекул атф, что необходимо для открытия крышки и высвобождение белка
46. Классы генов теплового шока у b. Subtilis. Рабочий цикл шаперонного комплекса DnaKj-GrpE
У B. subtilis гены теплового шока могут быть разделены на три класса:

DnaKJ-GrpE
У E. coli гомологом Hsp70 является DnaK, который образует комплекс с кошапероном DnaJ и белком GrpE
В активный комплекс с Hsp70 входят белки-ко-шапероны Hsp40 и Hsp10. Ко-шаперон Hsp40 (мол. масса 40 кДа, в E. coli – DnaJ) содержит консервативный J домен (70 аминокислотных остатков), который определяет контакт с Hsp70. Кроме того, DnaJ содержит G/F-богатый фрагмент, цинксвязывающий домен и С-терминальный домен, участвующий в контакте с субстратом. Третий белок - Hsp10, необходимый для проявления шаперонной активности комплекса Hsp70-Hsp40 (DnaK-DnaJ), в E. coli, – GrpE. GrpE способствует быстрому обмену АТФ – АДФ, ускоряя освобождение комплекса от АДФ. Кратко данную систему шаперонов в E. coli обычно обозначают как DnaKJE.

![]()
Ко-шаперон GrpE необходим для диссоциации АДФ и для усиления связи с АТФ, в результате происходит высвобождение ренатурированного субстрата из комплекса и завершается цикл действия шаперонной системы
