

ХИМИЯ
@Liver.med
1

СОДЕРЖАНИЕ
Тема |
Стр |
|
|
I. АЛКАНЫ |
3 |
|
|
II. АЛКЕНЫ |
11 |
|
|
III. АЛКИНЫ |
18 |
|
|
IV. АЛКАДИЕНЫ |
23 |
|
|
V. АРЕНЫ |
25 |
|
|
VI. ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ |
31 |
|
|
VII. СПИРТЫ, ФЕНОЛЫ |
33 |
|
|
VIII. КАРБОНОВЫЕ КИСЛОТЫ |
35 |
|
|
IX. СЛОЖНЫЕ ЭФИРЫ, ЖИРЫ, МЫЛА |
42 |
|
|
X. ОКСИКИСЛОТЫ, АЛЬДЕГИДО- И КЕТОКИСЛОТЫ |
45 |
|
|
2

I. АЛКАНЫ
Алканы (предельные углеводороды) – это углеводороды, в молекулах которых атомы углерода соединены между собой простой σ – связью, а все остальные валентности атомов углерода насыщены атомами водорода,
Гомология. Изомерия. Номенклатура. Гомологи – это соединения, сходные по
строению и обладающие близкими химическими свойствами, но отличающие друг от друга по составу на одну или несколько групп атомов СН2 (гомологическая разность).
Алканы образуют гомологический ряд, общая формула которого СnH2n+2, где n – число атомов углерода.
Общепринятой для предельных углеводородов является международная или ИЮПАКноменклатура (международный союз теоретической и прикладной химии).
Первые четыре члена ряда носят тривиальные названия. Названия следующих гомологов образуются из названий греческих числительных, соответствующих числу атомов углерода в соединении и окончании «ан».
СН4 – метан |
С6Н14 |
– гексан |
||
С2Н6 |
– этан |
С7Н16 |
– гептан |
|
С3Н8 |
– пропан |
С8Н18 |
– октан |
|
С4Н10 |
– бутан |
С9Н20 |
– нонан |
|
С5Н12 |
– пентан |
С10Н22 – декан |
||
3
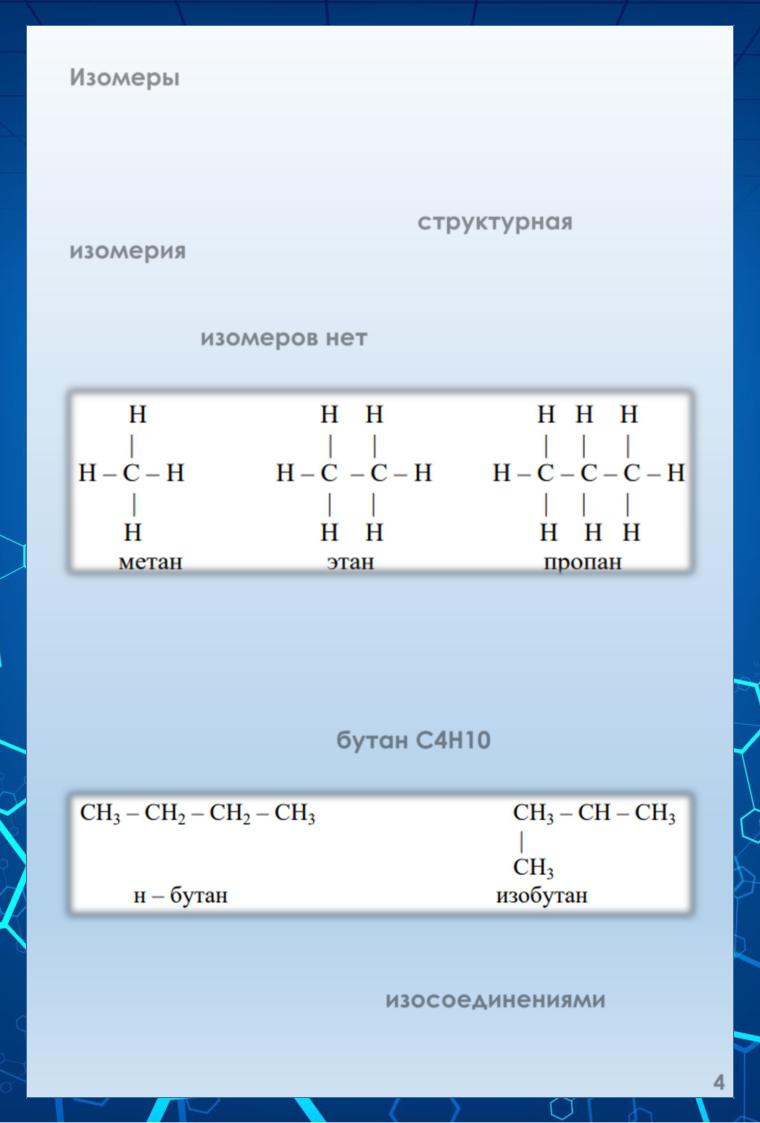
Изомеры – это вещества, имеющие одинаковый качественный и количественный состав, но различное строение молекул (разную структурную формулу) и обладающие поэтому разными свойствами. Для предельных углеводородов характерна структурная изомерия или изомерия углеродной цепи.
У первых трёх членов ряда: метана, этана и пропана – изомеров нет. Для них возможна только одна структурная формула:
Обычно пользуются упрощенными формулами, в которых указывают общее число атомов водорода при каждом углеродном атоме, например: СН3-СН3.
Следующий гомолог, бутан С4Н10 может существовать в виде двух изомеров:
Соединения с прямой (неразветвленной) цепью углеродных атомов называются нормальными, а с разветвленной цепью – изосоединениями.
4

Для углеводорода С5Н12 существует 3 изомера:
Атом углерода, соединенный с 1 атомом углерода, называется первичным, с 2 – вторичным, с 3 – третичным, с 4 - четвертичным.
Радикалы – это остатки, которые образуются при отнятии от молекул предельных углеводородов одного атома водорода. Радикалы имеют общее название «алкины» и обозначаются буквой R. Их общая формула – СnH2n+I . Названия радикалов образуют из названий алканов, путём замены окончания «ан» на «ил», например:
СН4 – метан |
СН3- – метил |
СН3-СН3 – этан |
СН3-СН2- – этил. |
От пропана образуются 2 радикала С3Н7-:
Радикал С4Н9- существует в виде 4 изомеров:
5

Названия углеводородов изостроения строятся следующим образом:
I. Выбирают главную цепь молекулы – самую длинную и разветвлённую углеродную цепь. II. Нумеруют атомы углерода, начиная с того
конца цепи, к которому ближе находится радикал. Если разные радикалы находятся на равном расстоянии от обоих концов цепи, то нумерацию начинают с того конца цепи, к которому ближе радикал с меньшим числом углеродных атомов. III. Указывают цифрами номера углеродных атомов, при которых находятся радикалы.
IV. Называют радикалы. Если имеется несколько одинаковых радикалов, то их число указывают греческими числительными (ди-, три-, тетра- и т.д.) перед названиями радикалов. Номера радикалов разделяют запятыми.
V. Называют углеводород по числу атомов углерода в главной цепи. При этом слово от цифр отделяют черточкой.
В молекулах алканов атомы углерода могут свободно вращаться вокруг оси связи С – С, поэтому углеводородная цепь будет принимать в пространстве разные формы, которые называются конформациями, или поворотными изомерами.
Конформации сравнительно легко переходят друг в друга и не являются разными соединениями, т.к. химическое строение их остаётся неизменным.
6
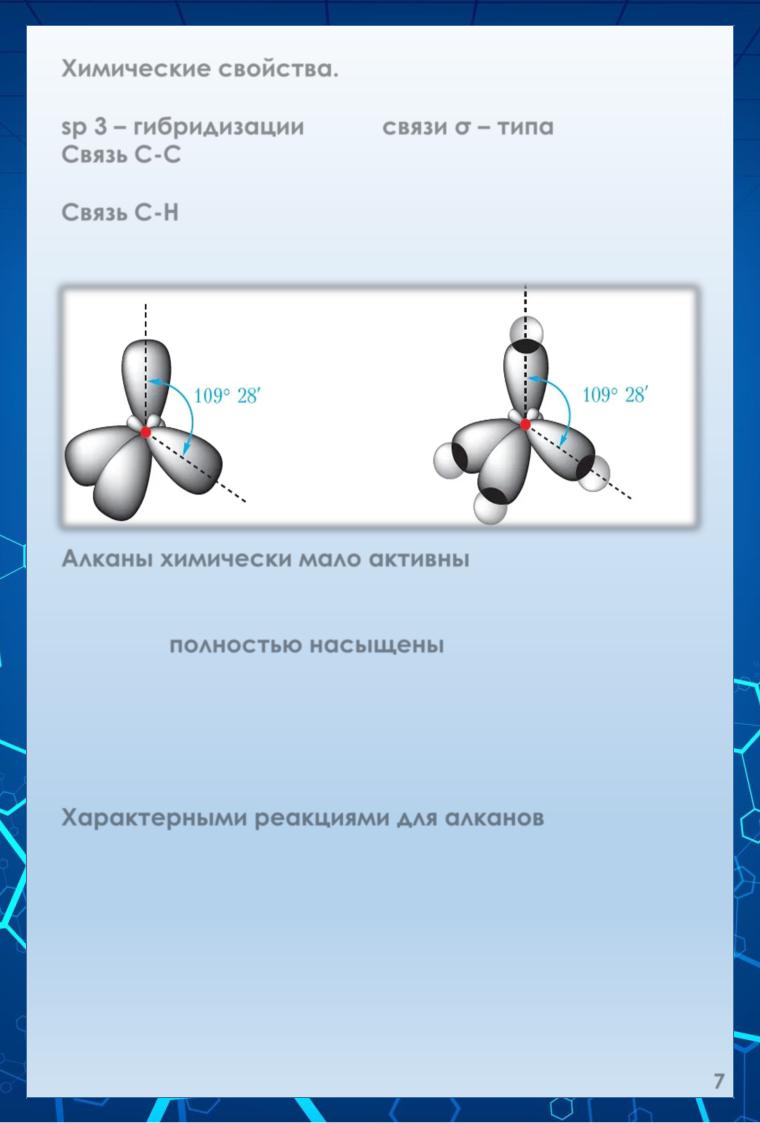
Химические свойства.
В алканах атомы углерода находятся в состоянии sp 3 – гибридизации и все связи σ – типа.
Связь С-С образуется при перекрывании гибридных орбиталей двух атомов углерода. Связь С-Н образуется при перекрывании гибридной орбитали атома углерода с
s – орбиталью атома водорода.
Перекрывание электронных облаков атома углерода и 4-х атомов водорода в молекуле метана.
Орбитали sp3гибридизованного атома углерода.
Алканы химически мало активны вследствие большой прочности и малой полярности σ – связей С-С и С-Н. Все валентности атомов углерода в алканах полностью насыщены, поэтому они не вступают в реакции присоединения. Концентрированная серная кислота и сильные окислители (KMnO4) при обычной температуре на алканы не действуют.
Характерными реакциями для алканов являются: 1) реакции замещения атомов водорода на другие атомы или группы атомов, идущие за счёт разрыва связи С-Н; 2) реакции расщепления молекулы (крекинг) – за
счёт разрыва связи С-С.
Алканы вступают в химические реакции только в «жестких» условиях, т.е. при нагревании, при облучении, в присутствии катализаторов.
7

I. Галогенирование.
При взаимодействии алканов с галогенами на свету происходит постепенно замещение атомов водорода на галоген. При этом образуется смесь галогенопроизводных углеводородов.
Например, при действии хлора на метан образуется 4 различных продута замещения:
II. Нитрование (реакция Коновалова).
При нагревании алканов с разбавленной азотной кислотой образуются нитросоединения: атом водорода в алкане замещается на нитрогруппу – NO2 (остаток азотной кислоты) и выделяется вода.
8

III. Сульфирование.
Концентрированная серная кислота (олеум) взаимодействует при нагревании с изоалканами, содержащим третичный атом углерода. Происходит замещение атома водорода на –SO3H (сульфогруппу) и образуются сульфокислоты.
IV. Дегидрирование.
Реакция отнятие молекулы водорода. Образуются этиленовые углеводороды:
V. Горение.
Предельные углеводороды при очень высокой (300oC) температуре сгорают с образованием СО2 и Н2О, выделяя большое количество тепла. На этом основано применение их в качестве топлива.
VI. Крекинг.
Под действием высокой температуры (500оС) у алканов происходит разрыв связей С – С, причём в радикалах водород перераспределяется так, что получается смесь алкана и алкена:
9
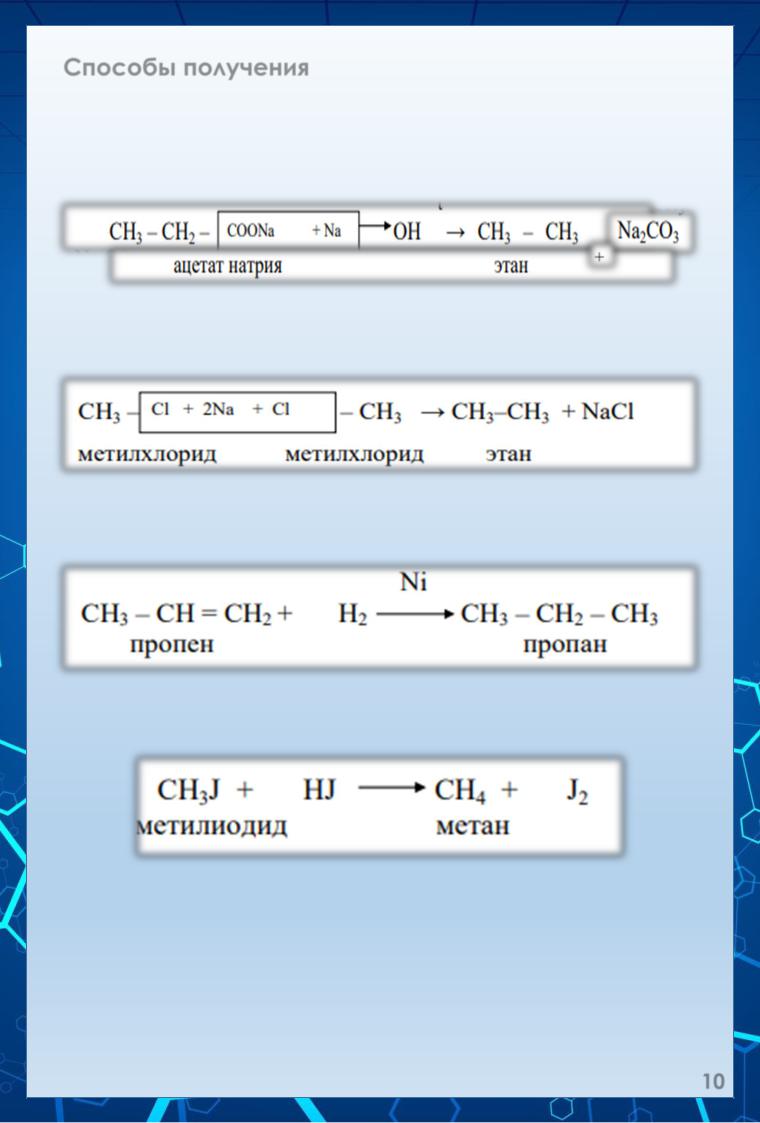
Способы получения.
1 - Сплавление солей карбоновых кислот с щелочью. Образующийся при этом алкан содержит на I атом углерода меньше, чем исходная соль карбоновой кислоты:
2. Действие металлического натрия на моногалогенопроизводные предельных углеводородов (реакция Вюрца):
3. Гидрирование непредельных углеводородов в присутствии катализаторов (Pt, Pd, Ni):
4. Восстановление галогенопроизводных углеводородов иодоводородом:
10
