

II. АЛКЕНЫ
Алкены (этиленовые углеводороды) – это углеводороды, содержащие одну двойную связь между углеродными атомами > С = С <.
Гомологичный ряд. Номенклатура. Изомерия. Алкены образуют гомологический ряд, общая формула которого СnH2n. Родоначальником ряда является углеводород этилен состава С2Н4.
По международной номенклатуре (М.Н.) названия алкенов производят от названий соответствующих алканов путём замены окончания «ан» на «ен». Углеродная цепь при этом нумеруется с того конца, к которому ближе двойная связь. Её положение указывают цифрой, т.е. номером атома углерода, за которым она следует, после названия углеводорода:
Радикал этилена СН2 = СН– называется винил, а радикал пропилена СН2 = СН – СН2– аллил.
11
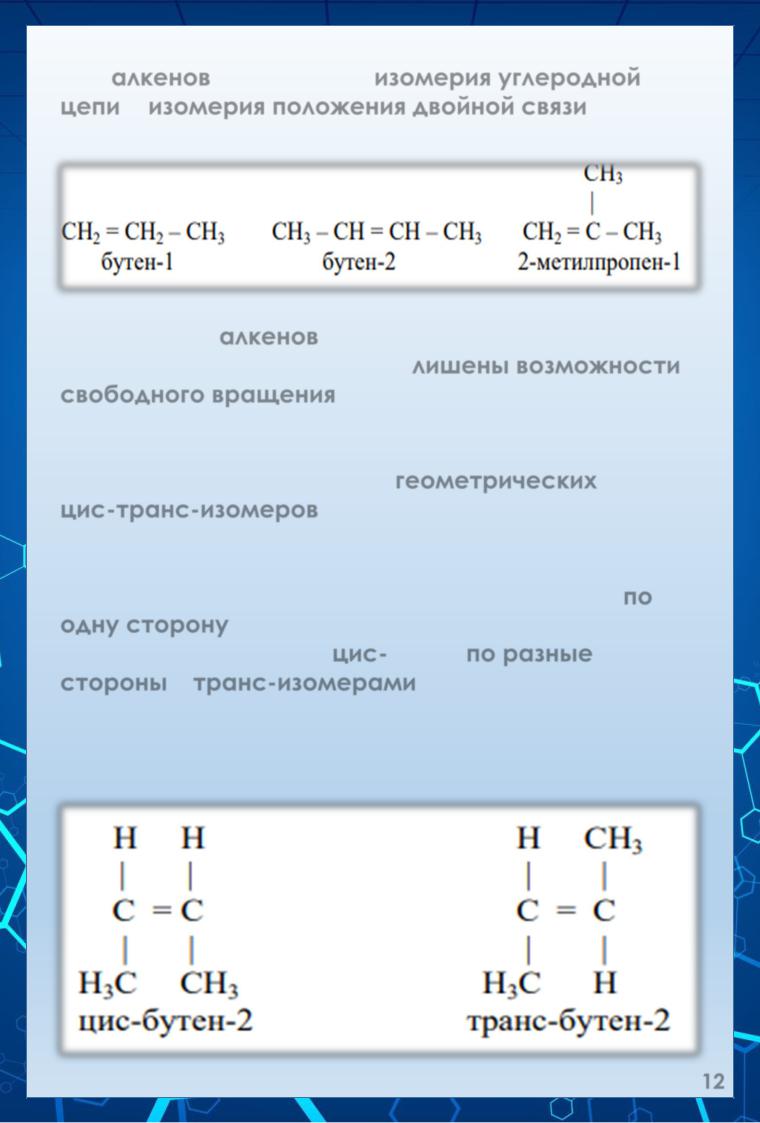
Для алкенов характерны изомерия углеродной цепи и изомерия положения двойной связи. Так, для алкена С4Н8 возможны три изомера:
В молекулах алкенов атомы углерода, которые соединены двойной связью, лишены возможности свободного вращения вокруг связи С=С, так как это требует затраты значительной энергии порядка 271 кДж/моль.
Это приводит к появлению геометрических или цис-транс-изомеров, которые различаются пространственным расположением заместителей относительно плоскости двойной связи.
Если одинаковые заместители расположены по одну сторону от плоскости двойной связи, то изомеры называются цис-, если по разные стороны – транс-изомерами.
Так, для бутена-2 известны два изомера – цис- бутен-2 и транс-буте-2:
12

Химические свойства.
В алкенах атомы углерода, связанные двойной связью, находятся в состоянии sp 2 – гибридизации. Двойная связь состоит из двух качественно неравноценных связей: одна из них является σ-связью, а другая π-связью.
σ-связь образуется при перекрывании гибридных орбиталей 2 атомов углерода.
π-связь – при боковом перекрывании «чистых» р- орбиталей.
π – связь является менее прочной, чем σ – связь, что обусловливает высокую реакционную способность алкенов.
Для алкенов характерные реакции присоединения, идущие с разрывом двойной связи и превращением ее в простую. Электронные облака π – связи заряжены отрицательно и способны взаимодействовать с частицей, испытывающей дефицит электронов (электрофилом) или радикальной частицей, несущей неспаренный электрон. Отрицательно заряженная частица (нуклеофил) будет отталкиваться от π- электронных облаков и не сможет атаковать двойную связь.
По этой причине реакции присоединения к алкенам чаще идут по электрофильному механизму, реже – по радикальному.
13

1. Присоединение водорода (р-ция гидрирования). В присутствии катализаторов (Pt, Pd, Ni) водород присоединяется по месту двойной связи. Образуются предельные углеводороды:
Эту реакцию принимают в промышленности для получения твёрдых жиров из жидких растительных масел.
2. Присоединение галогенов.
Галогены присоединяются к алкенам с образованием дигалогенопроизводных алканов:
В полярных растворителях, н-р, в воде, происходит поляризация молекулы брома и реакция бромирования идёт по электрофильному мех-му. Вначале образуется π – комплекс за счёт взаимодействия π – электронов двойной связи с электрофильной частицей галогена. Затем происходит гетеролитический разрыв π – связи в алкене и связи в молекуле брома с образованием карбкатиона (σ – комплекса) и аниона брома. Последний затем присоединяется к положительно заряженному С-атому с образованием дигалогенопроизводного.
Реакция алкенов с бромной водой является качественной реакцией на двойную связь, так как желтая окраска брома при этом исчезает.
Эта реакция используется для определения непредельности жиров и масел.
14

3. Присоединение галогеноводородов. Галогеноводороды присоединяются к алкенам с образованием моногалогенопроизводных алканов. В случае несимметричных алкенов присоединение идёт по правилу Марковникова, т.е. водород присоединяется к наиболее гидрированному атому углерода (связанному с наибольшим числом водородных атомов):
Под влиянием электроннодонорного метильного радикала π – электроны двойной связи в молекуле пропена смещаются к крайнему атому углерода, что приводит к появлению на нем частичного отрицательного заряда (δ-); на другом атоме углерода при двойной связи возникает частичный положительный заряд (δ+). Молекула пропена поляризуется. Поэтому при взаимодействии с поляризованной молекулой Н-Br катион Н+ присоединяется к С-атому, несущему отрицательный заряд, т.е. к более гидрированному, а анион брома Br- – к положительно заряженному атому углерода, менее гидрированному.
4. Присоединение воды (реакция гидратации). В присутствии катализатора (H2SO4) вода присоединяется к алкенам по правилу Марковникова с образованием спиртов:
15

5. Присоединение серной кислоты.
Реакция также идет по правилу Марковникова. Образуются алкилсерные кислоты, легко гидролизующиеся на спирт и серную кислоту:
6.Горение. При высоких температурах алкены сгорают на воздухе, образуя СО2 и Н2О:
7.Окисление.
В отличие от предельных углеводородов непредельные углеводороды легко окисляются. При окислении алкенов перманганатом калия в нейтральной или слабощелочной среде по месту двойной связи присоединяются две гидроксильные группы и образуются двухатомные спирты:
Эта реакция является качественной на двойную С=С
– связь (обесцвечивание фиолетовой окраски раствора перманганата калия).
Кислые р-ры перманганата калия расщепляют алкены по двойной связи с обр-ем кислот и кетонов:
8. Полимеризация.
В присутствии катализаторов или при высокой температуре под давлением алкены вступают в реакцию полимеризации с образованием высокомолекулярных соединений - полимеров.
При полимеризации этилена образуется полиэтилен:
16

Способы получения.
1.Дегидрирование предельных углеводородов:
2.Дегалогенирование 1,2 – дигалогеналканов:
3. Действие спиртового раствора щелочи на моногалогеналканы:
Отщепление галогеноволорода от молекулы галагеналкана происходит по правилу Зайцева: атом водорода уходит от соседнего, наименее гидрированного атома углерода (который содержит меньшее число атомов водорода).
4. Дегидратация спиртов.
При нагревании спиртов с водоотнимающими средствами (H2SO4, Al2O3) происходит отщепление молекулы воды:
17

III. АЛКИНЫ
Алкины (ацетиленовые углеводороды) – это углеводороды, содержащие тройную связь между атомами углерода -С≡С-.
Гомологичный ряд. Номенклатура. Изомерия. Общая формула гомологического ряда ацетиленовых углеводородов СnH2n-2.
По М.Н. названия ацетиленовых углеводородов производят от названий соответствующих предельных углеводородов, заменяя окончание «ан» на «ин». Перед названием указывают положение тройной связи цифрой, соответствующей номеру атома углерода, за которым она следует:
Изомерия алкинов обусловлена изомерией углеродной цепи и изомерией положения тройной связи. Так, алкин состава С5Н8 может существовать в виде трех изомеров:
18
Химические свойства.
В алкинах атомы углерода, связанные тройной связью, находятся в состоянии spгибридизации. Тройная связь между атомами углерода состоит из одной σ – связи и двух π – связей. σ – Связь С-С образуется при перекрывании гибридных sp – орбиталей двух атомов углерода и две π–связи – в результате перекрывания двух пар «чистых» р- орбиталей.
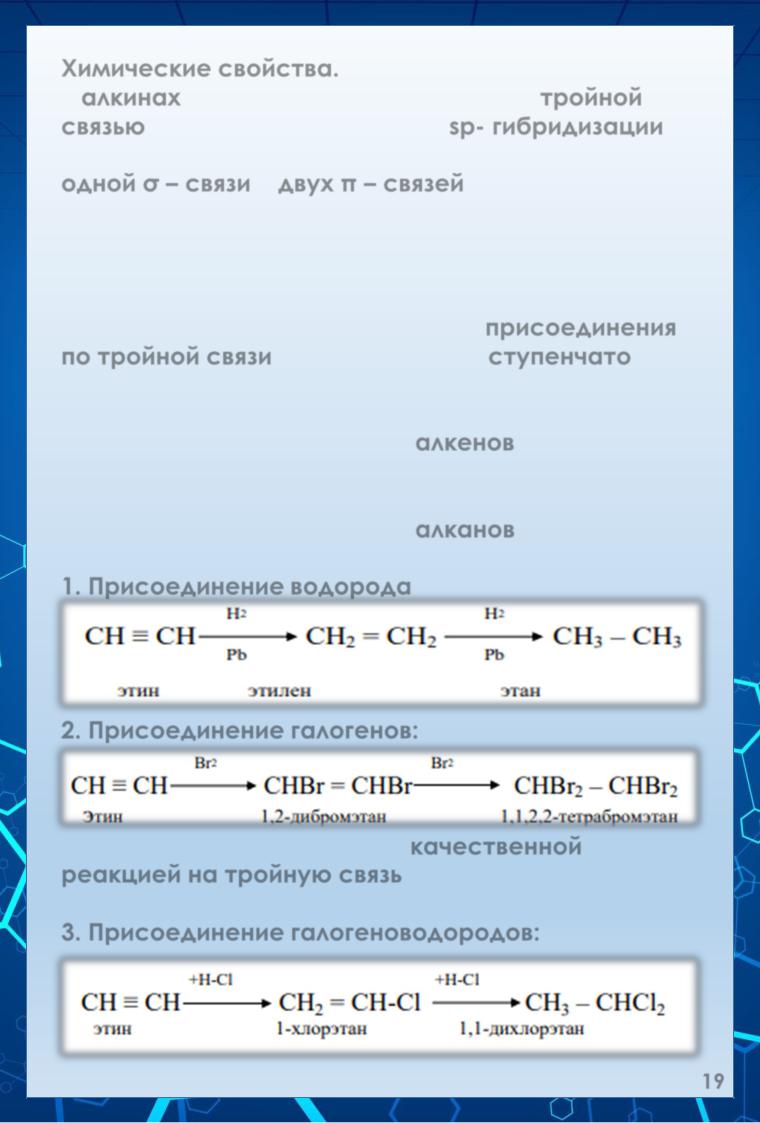
Для алкинов характерны реакции присоединения по тройной связи, последние идут ступенчато.
1)Сначала разрывается одна π – связь и присоединяется одна молекула реагента с образованием производных алкенов.
2)Затем разрывается вторая π – связь и присоединяется вторая молекула реагента с образованием производных алканов.
1.Присоединение водорода (р-ция гидрирования):
2.Присоединение галогенов:
Реакция с бромом является качественной реакцией на тройную связь; в результате реакции желтая окраска брома или его р-ров исчезает.
3. Присоединение галогеноводородов:
19

4. Присоединение воды (реакция М. Кучерова). В присутствии солей ртути (II) в сернокислом
растворе по месту тройной связи присоединяется она молекула воды с обр-ем винилового спирта:
Спирты, содержащие гидроксильную группу у атома углерода с двойной связью, неустойчивы. В момент их образования происходит перегруппировка: водород гидроксильной группы переходит к соседнему углеродному атому, двойная связь при этом разрывается и возникает двойная связь между углеродом и кислородом (правило Эльтекова).
Гомологи ацетилена при гидратации образуют кетоны:
5. Реакция окисления.
Алкины окисляются легче, чем алкены.
При взаимодействии ацетилена с раствором перманганата калия образуется щавелевая к-та:
Фиолетовая окраска KMnO4 при этом исчезает –
качественная реакция на тройную связь. |
20 |
