
634
.pdfВопросы и задания подготовки к семинару по теме 7
1.Какой потенциал называется электродным? Уравнение Нернста.
2.Нарисуйте и объясните схему возникновения двойного электрического слоя на границе металл - раствор. Какую роль играют молекулы растворителя в возникновении двойного электрического слоя?
3.Что такое нормальный (стандартный) электродный потенциал? Как его определяют? Почему величины стандартных электродных потенциалов являются относительными, а не абсолютными?
4.Как устроен водородный электрод? Приведите схему, напишите электрохимические реакции, протекающие в нем, и укажите область его применения.
5.Как устроен каломельный электрод? Приведите схему, напишите электродные реакции, протекающие в нем, укажите область его применения.
6.Как устроен хлорсеребряный электрод? Приведите схему, напишите электродные реакции, протекающие в нем, укажите область его применения.
7.Как устроен хингидронный электрод? Приведите схему, напишите электродные реакции, протекающие в нем, укажите область его применения.
8.Что представляет собой гальванический элемент? Нарисуйте схему медно-цинкового гальванического элемента. Напишите уравнения реакций в молекулярной и ионной форме, характеризующих работу гальванического элемента.
101
9.Что представляет собой концентрационный гальванический элемент? Нарисуйте схему концентрационного медного гальванического элемента.
10.Что такое диффузный потенциал? Как и почему его устраняют?
11.Нарисуйте схему установки для измерения ЭДС компенсационным методом. Объясните принцип ее работы.
12.Какие электроды называются мембранными? На примере стеклянного электрода объясните возникновение скачка потенциала. Приведите схему стеклянного электрода и уравнение Нернста для него.
13.В чем заключается принцип потенциометрического измерения рН? Приведите схему хингидроннохлорсеребряной цепи. Выведите формулу для расчета рН раствора.
14.Что такое окислительно-восстановительные (редокс)- потенциалы? Приведите уравнение Нернста для редокспотенциала. Как и для чего определяют редокспотенциалы почв? Связь редокс-потенциала почвы с ее плодородием.
Тема 8. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ
Молекула вещества в поверхностном слое обладает избыточной поверхностной энергией F вследствие некомпенсированности межмолекулярных сил.
F S, (8.1)
где σ - поверхностная энергия, или поверхностное натяжение,
Дж/м2 или Н/м;
S - поверхность раздела фаз, м 2.
102

При постоянной поверхности раздела (S = const) самопроизвольное уменьшение свободной поверхностной энергии (F → 0) возможно за счет уменьшения поверхностного натяжения. Это может быть достигнуто путем поглощения молекулами поверхностного слоя других веществ из внешней среды.
Явление самопроизвольного поглощения вещества на поверхности раздела называется адсорбцией. Вещество, на поверхности которого идет адсорбция, называется адсорбентом, а вещество, которое поглощается, называется
адсорбатом или адсорбтивом.
Г |
X |
моль м2 |
или |
Г |
Х |
моль кг, (8.2) |
|
|
|||||
S |
т |
где Г - адсорбция,
S - поверхность адсорбента, т - масса адсорбента.
Адсорбция на границе жидкость – раствор
Адсорбция на границе жидкость - раствор определяется
уравнением Гиббса:
|
C |
d |
||
Г |
|
|
|
, (8.3) |
R T |
|
|||
|
dC |
|||
где С - концентрация адсорбента, кмоль/м3;
R = 8,314∙103 Дж/кмоль∙К - универсальная газовая постоянная; Т - термодинамическая температура, К;
d |
- |
поверхностная |
активность |
(изменение |
|
|
|||||
dC |
|||||
|
|
|
|
поверхностного натяжения с концентрацией при неизменной поверхности).
103

d 0, Г 0 - адсорбция отрицательная. dC
d 0, Г 0 - адсорбция положительная.
dC
Вещества с положительной адсорбцией снижают поверхностное натяжение растворителя и называются
поверхностно - активными веществами (ПАВ).
Типичными ПАВ являются жирные кислоты, соли высших жирных кислот (мыла), СМС, высшие спирты и амины и т.д. ПАВ добавляют к порошкам, эмульсиям пестицидов, чтобы увеличить смачиваемость обрабатываемых поверхностей.
Вещества с отрицательной адсорбцией повышают поверхностное натяжение растворителя и называются
поверхностно - неактивными веществами (Hg, CS2, CHCl3
и др.).
Пример 8.1. Определить адсорбцию раствора, содержащего 50 мг/л пеларгоновой кислоты С8Н17СООН при 100С. Поверхностное натяжение раствора 57,00∙10-3 Н/м, поверхностное натяжение чистой воды 72,22∙10-3Н/м.
Решение
57,00 10 |
3 Н |
; |
С 50 |
мг |
0,05 кг |
м3 |
; |
|
|
|
м |
|
|
л |
|
|
|
0 |
72,22 10 3 Н м ; |
t 100 C. |
|
|
|
|||
1. Молярная концентрация С8Н17СООН:
CM MC 0,05158 3,16 10 4 кмоль м3 .
2. Термодинамическая температура:
T = 2730 + t0 = 273 0 + 100 = 283K. 3. Поверхностная активность С8Н17СООН:
104

|
d |
|
|
0 |
57 10 3 72,22 10 |
3 |
кмоль |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
48,16 |
Н м2 |
. |
||
|
|
|
|
|
|
|
3,16 10 4 0 |
|
||||||||||
|
dC |
|
C C0 |
|
|
|
|
|
|
|||||||||
4. Адсорбция: |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
C |
|
|
d |
|
|
|
3,16 10 |
4 |
|
|
|
9 кмоль |
|||
Г |
|
|
|
|
|
|
|
|
|
( 48,16) 6,47 10 |
||||||||
R T |
dC |
8,314 103 |
283 |
|
|
м2 . |
||||||||||||
Г > 0 и σ < σ0, адсорбция положительна. Пеларгоновая кислота - ПАВ.
Адсорбция на границе твердое тело - раствор
Для твердых тел отсутствуют методы непосредственного определения поверхностного натяжения. Поэтому уравнение Гиббса (8.3) в данном случае не применимо и используется эмпирическое уравнение
Фрейндлиха:
|
Х |
1 |
|
||
|
|
|
|
||
Г |
К С п , (8.4) |
||||
т |
|||||
|
|
|
|
||
где Г - адсорбция; Х - количество адсорбируемого вещества;
т- масса адсорбента;
Ки п - константы;
С - равновесная концентрация.
Постоянные К и (1/n) находят, логарифмируя уравнение
(8.4):
lg mX lg K 1n lg C. (8.5)
105
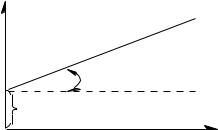
lg (X/m)
|
|
lg K = OA; (1/n) = tg |
A |
|
|
lg K |
|
|
|
|
|
|
|
lg C |
|
|
Рис. 11. Изотерма адсорбции в логарифмических координатах.
Пример 8.2. К 100 см 3 растворов уксусной кислоты различной концентрации при 200С добавили по 3 г активированного угля. Концентрации кислоты до и после адсорбции определяли нитрованием 50 см 3 раствора 0,1н раствором КОН в присутствии фенолфталеина. Определить значение адсорбции для каждого раствора кислоты, используя данные титрования:
№ |
Vк, см 3 |
V0, см 3 |
|
т, г |
|
пробы |
объем |
0,1н NaOH, израсходованный на |
масса |
||
|
кислоты |
титрование кислоты, |
активирован- |
||
|
|
до адсорбции |
|
после |
ного угля |
|
|
|
|
адсорбции |
|
1 |
50 |
5,5 |
|
1,2 |
3 |
2 |
50 |
10,6 |
|
3,65 |
3 |
3 |
50 |
23,0 |
|
10,2 |
3 |
|
|
|
|
|
|
Построить график изотермы адсорбции. Определить коэффициенты К и 1/n в уравнении Фрейндлиха.
Решение
1.Нормальности и титры растворов уксусной кислоты до адсорбции:
106

Cн0 |
|
Сн |
0 |
V |
T 0 |
|
Сн0 |
Э |
к |
|
|
|
0 |
; |
к |
|
, |
||||||
|
|
|
|
|
|
||||||
к |
|
Vк |
к |
|
1000 |
|
|
||||
|
|
|
|
|
|
||||||
где Снк0 и Сн0 - нормальности уксусной кислоты и NaOH; Vк и V0 - объемы уксусной кислоты и NaOH, мл;
Тк - титр уксусной кислоты, г/см 3; Эк - эквивалент уксусной кислоты (60).
0 |
|
5,5 0,1 |
1,1 10 |
2 |
|
|
|
|
|
0 |
|
1,1 10 2 60 |
6,6 |
10 |
4 |
г |
|
|
|
||||||||||||
Cн1 |
|
|
|
, |
|
|
T1 |
|
|
|
|
|
|
|
|
см |
3 ; |
|
|||||||||||||
50 |
|
|
|
|
|
|
|
1000 |
|
|
|
|
|||||||||||||||||||
0 |
|
10,6 0,1 |
2,12 10 |
2 |
|
|
|
0 |
|
|
2,12 10 2 60 |
1,272 10 |
3 г |
|
|||||||||||||||||
Сн2 |
|
|
|
|
|
|
|
; |
|
|
T2 |
|
|
|
|
|
см3 |
; |
|||||||||||||
50 |
|
|
|
|
|
|
|
|
1000 |
|
|
|
|||||||||||||||||||
0 |
|
23,0 0,1 |
4,6 10 |
2 |
|
|
|
|
0 |
|
|
4,6 10 2 |
60 |
|
2,76 10 |
3 |
г |
|
|||||||||||||
Сн3 |
|
|
|
|
|
|
|
; |
|
T3 |
|
|
|
|
|
|
см3 . |
|
|||||||||||||
50 |
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|||||||||||||||||
2.Нормальности и титры растворов уксусной кислоты после адсорбции:
Сн1 |
|
1,2 0,1 |
2,4 10 |
3 |
, |
|
T1 |
|
2,4 10 3 60 |
1,44 10 |
4 |
г |
|
; |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
50 |
|
|
|
|
|
1000 |
|
|
см 3 |
|
||||||||||||||||
Сн2 |
|
|
3,65 0,1 |
7,3 |
10 |
3 , |
T2 |
7,3 10 3 60 |
4,38 |
10 |
4 г |
|
3 ; |
|||||||||||||
|
50 |
|
|
|
|
1000 |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
см |
|
||||
|
|
10,2 0,1 |
2,04 10 |
2 |
|
|
|
2,04 10 2 |
60 |
1,224 10 |
3 |
г |
||||||||||||||
Сн3 |
|
|
|
|
|
|
, |
T3 |
|
|
|
|
|
|
см 3 . |
|||||||||||
50 |
|
|
|
|
1000 |
|
|
|
|
|
||||||||||||||||
3. Адсорбированное количество уксусной кислоты:
X |
(T 0 |
Т ) В Сн |
|
1000 100 |
, |
к |
к |
0 |
|
||
|
|
|
Vк т
где Х - адсорбция уксусной кислоты 100г активированного угля, ммоль/100г;
В - объем раствора кислоты, взятый для адсорбции, мл; (Тк0-Тк) - объем 0,1н NaOH, эквивалентное количеству СН3СООН, адсорбированному из 50 мл раствора;
b- объем раствора кислоты, взятый для титрования;
107

т - масса адсорбента; Сн0 - нормальность основания.
X1 (6,6 1,44) 10 4 100 0,1 1000 100 3,44 10 2 ммоль экв г ; 50 3
Х 2 (12,72 4,38) 10 4 100 0,1 1000 100 5,56 10 2 ммоль экв г ; 50 3
Х3 (2,76 1,244) 10 3 100 0,1 1000 100 10,11 10 2 ммоль экв г . 50 3
4. Равновесные концентрации растворов уксусной кислоты:
C1
С2
С3
C |
T |
к |
1000 Cн |
, ммоль экв |
. |
|
|
|
b |
л |
|
|
|
|
|
|
|
1,44 10 4 1000 0,1 |
2,88 |
10 4 |
|||||||
|
|
50 |
|
|||||||
|
|
|
|
|
|
|
|
|
||
|
|
4,38 10 |
4 1000 0,1 |
8,76 |
10 4 |
|||||
|
|
|
50 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
1,244 10 |
3 1000 0,1 |
24,88 10 |
|||||||
|
|
|
50 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
ммоль экв л ;
ммоль экв л ;
4 ммоль экв л .
5. График изотермы адсорбции:
|
1 |
|
|
|
|
1 |
|
||
|
|
|
lg X lg K |
lg C. |
|||||
X K C n |
|
||||||||
|
|||||||||
|
|
|
|
|
|
|
n |
||
lg X1 |
= |
-1,46; |
lg C1 |
= |
-3,5406; |
||||
lg X2 |
= |
-1,25; |
lg C2 |
= |
-3,0575; |
||||
lg X3 |
= |
-0,995; lgC3 |
= |
-2,6041. |
|||||
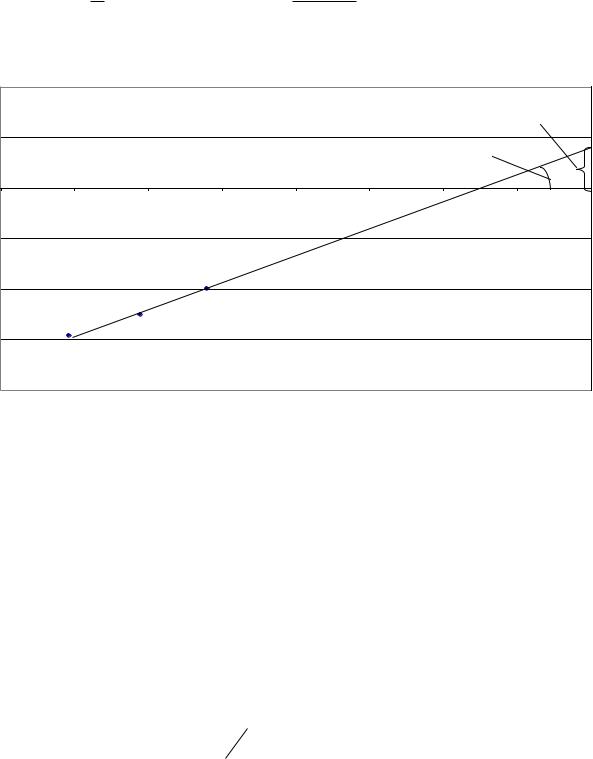
Непосредственные измерения на построенном графике lgK и φ или аналитическое решение системы уравнений
1,46 lg K 3,5406 1n
0,995 lg K 2,6041 1n
относительно неизвестных lg K и 1n , дает следующий результат:
108
|
lg K 0,298 |
|
K 100,298 1,9861; |
|
|
||||
|
1 |
0,4965 |
|
n |
1 |
2,014. |
|
|
|
|
n |
|
|
|
0,4965 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
lgK |
|
|
|
|
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
-4 |
-3,5 |
-3 |
-2,5 |
|
-2 |
-1,5 |
-1 |
-0,5 |
0 |
lgX |
|
|
|
|
|
|
|
|
-0,5 |
|
|
|
|
|
|
|
|
|
-1 |
|
|
|
|
|
|
|
|
|
-1,5 |
|
|
|
|
|
|
|
|
|
-2 |
|
|
|
|
|
lgC |
|
|
|
|
|
Рис. 12. Изотерма адсорбции в логарифмических |
|
|||||||
координатах к примеру 8.2 |
|
|
|
|
|
|
|||
Пример 8.3. Рассчитайте, пользуясь уравнением Фрейндлиха, количество бензойной кислоты, которое может быть поглощено 100 г почвы, если в почвенном растворе установилась концентрация 2,7 ммоль/л. Константы уравнения Фрейндлиха: К = 4,5; (1/n) = 0,4.
Решение
C 2,7 |
ммоль |
; |
К 4,5; |
1 |
0,4. |
|
|||||
|
л |
|
|
п |
|
|
|
|
|
|
1. Логарифм адсорбции Фрейндлиха:
109

Г 4,5 С0,4 ;
lg Г lg 4,5 0,4 lg C lg 4,5 0,4 lg 2,7
0,6532 0,4 0,4314 0,8257.
2.Адсорбция бензойной кислоты:
Г 100,8257 6,7 г100г почвы. Литература: [1], глава XI, c. 267 -291.
Варианты заданий к теме 8
1.Рассчитать по уравнению Фрейндлиха количество уксусной кислоты, адсорбированное 100 г почвы, используя данные таблицы:
№ |
Cкислоты, |
|
К |
1 |
|
|
|
|
|
|
|||
|
n |
|||||
вар. |
ммоль л |
|
|
|
||
|
|
|
|
|
||
|
|
|
|
|
|
|
1. |
15,5 |
|
9,5 |
0,22 |
||
2. |
20 |
|
9,5 |
0,22 |
||
3. |
40 |
|
9,5 |
0,22 |
||
4. |
33,5 |
|
5,4 |
0,65 |
||
5. |
79 |
|
4,5 |
0,50 |
||
6. |
75 |
|
9,5 |
0,25 |
||
7. |
14 |
|
9,5 |
0,22 |
||
8. |
25 |
|
6,5 |
0,40 |
||
9. |
12,5 |
|
9,5 |
0,50 |
||
10. |
3,5 |
|
9,5 |
0,25 |
||
11. |
35 |
|
9,5 |
0,22 |
||
12. |
79 |
|
9,5 |
0,50 |
||
13. |
25 |
|
4,5 |
0,65 |
||
14. |
12,5 |
|
9,5 |
0,22 |
||
15. |
14 |
|
9,5 |
0,50 |
||
|
|
|
|
|
|
|
|
|
110 |
|
|
|
|
