
- •Механика и молекулярная физика
- •Преобразования Галилея и механический принцип относительности.
- •Основное уравнение молекулярно-кинетической теории идеального газа
- •Определение температуры в статистической физике в статистической физике температура определяется как производная от энергии системы по её энтропии:
- •Распределение Максвелла молекул идеального газа по скоростям.
Основное уравнение молекулярно-кинетической теории идеального газа
Основное уравнение молекулярно-кинетической теории идеального газаустанавливает связь между макроскопической величиной - давлением, которое может быть измерено, например манометром, и микроскопическими величинами, характеризующими молекулу:
![]()
где р - давление, m0- масса молекулы, п - концентрация (число молекул в единице объема), v2- средний квадрат скорости молекул.
Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы
![]()
можно записать:
![]()
Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева):
PV = nRT
где n – число молей газа;
P – давление газа (например, в атм;
V – объем газа (в литрах);
T – температура газа (в кельвинах);
R – газовая постоянная (0,0821 л·атм/моль·K).

ИЗОПРОЦЕССЫ
Изопроцессы — равновесные процессы, в которых один из основных параметров сохраняется.
ИЗОБАРНЫЙ ПРОЦЕСС-
термодинамический
процесс,
происходящий в системе при постоянном
давлении
и постоянной массе идеального газа.
(![]() )
Для
изобарного процесса в идеальном газе
справедлив закон Гей-Люссака:
при
постоянном давлении объем данной массы
газа прямо пропорционален его
термодинамической температуре:
)
Для
изобарного процесса в идеальном газе
справедлив закон Гей-Люссака:
при
постоянном давлении объем данной массы
газа прямо пропорционален его
термодинамической температуре:![]() или
или ![]() .
Работа
газа при изобарном расширении:
.
Работа
газа при изобарном расширении:
![]() .
Изменение
внутренней энергии:
.
Изменение
внутренней энергии:![]() Количество
полученного тепла в соответствии с
первым началом термодинамики:
Количество
полученного тепла в соответствии с
первым началом термодинамики:![]() .
Молярная
теплоемкость при изобарном процессе:
.
Молярная
теплоемкость при изобарном процессе:![]() .
.
ИЗОХОРНЫЙ ПРОЦЕСС
(![]() )-термодинамический
процесс,
который происходит при постоянном
объёме.
Для осуществления изохорного процесса
в газе или жидкости достаточно нагревать
(охлаждать) вещество в сосуде, который
не изменяет своего объёма.
Изохорный
процесс в идеальном газе описывается
законом Шарля:
при постоянном объеме
давление данной массы газа прямо
пропорционально его термодинамической
температуре:
)-термодинамический
процесс,
который происходит при постоянном
объёме.
Для осуществления изохорного процесса
в газе или жидкости достаточно нагревать
(охлаждать) вещество в сосуде, который
не изменяет своего объёма.
Изохорный
процесс в идеальном газе описывается
законом Шарля:
при постоянном объеме
давление данной массы газа прямо
пропорционально его термодинамической
температуре:
![]() или
или ![]() .
Работа
газа при изохорном процессе равна
нулю:
.
Работа
газа при изохорном процессе равна
нулю: ![]() .
Все
полученное тепло идет на изменение
внутренней энергии в соответствии с
первым началом термодинамики:
.
Все
полученное тепло идет на изменение
внутренней энергии в соответствии с
первым началом термодинамики:
![]() .
Молярная
теплоемкость при изохорном процессе:
.
Молярная
теплоемкость при изохорном процессе:![]() .
.
ИЗОТЕРМИЧЕСКИЙ
ПРОЦЕСС (![]() )-термодинамический
процесс,
происходящий в физической системе при
постоянной температуре.
Изотермический
процесс в идеальном газе подчиняется
закону Бойля - Мариотта:
для данной
массы газа при неизменной температуре
произведение значений давления и объема
есть величина постоянная:
)-термодинамический
процесс,
происходящий в физической системе при
постоянной температуре.
Изотермический
процесс в идеальном газе подчиняется
закону Бойля - Мариотта:
для данной
массы газа при неизменной температуре
произведение значений давления и объема
есть величина постоянная:
![]() или
или ![]() .
.
Работа газа при
изотермическом расширении:
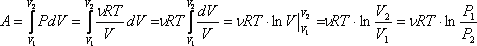 .
Изменение
внутренней энергии при изотермическом
процессе равно нулю:
.
Изменение
внутренней энергии при изотермическом
процессе равно нулю:![]() .
Все
полученное тепло идет на совершение
работы в соответствии с первым началом
термодинамики:
.
Все
полученное тепло идет на совершение
работы в соответствии с первым началом
термодинамики:![]() .
.

Основное уравнение МКТ. Статистическое толкование температуры. Барометрическая формула. Распределения Максвелла и Больцмана.
Основное уравнение мкт имеет вид
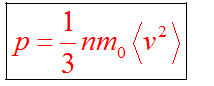

Определение температуры в статистической физике в статистической физике температура определяется как производная от энергии системы по её энтропии:
![]() ,
,
где S — энтропия, E — энергия термодинамической системы. Введённая таким образом величина T является одинаковой для различных тел при термодинамическом равновесии. При контакте двух тел тело с большим значением T будет отдавать энергию другому.
Барометрическая формула — зависимость давления или плотности газа от высоты в поле тяжести.
Для идеального
газа,
имеющего постоянную температуру
![]() и
находящегося в однородном поле тяжести
(во всех точках его объёмаускорение
свободного падения
и
находящегося в однородном поле тяжести
(во всех точках его объёмаускорение
свободного падения
![]() одинаково),
барометрическая формула имеет следующий
вид:
одинаково),
барометрическая формула имеет следующий
вид:
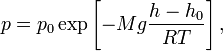
где
![]() —
давление газа в слое, расположенном на
высоте
—
давление газа в слое, расположенном на
высоте![]() ,
,![]() —
давление на нулевом уровне (
—
давление на нулевом уровне (![]() ),
),![]() —молярная
масса
газа,
—молярная
масса
газа,
![]() —газовая
постоянная,
—газовая
постоянная,
![]() —абсолютная
температура.
Из барометрической формулы следует,
что концентрация молекул
—абсолютная
температура.
Из барометрической формулы следует,
что концентрация молекул
![]() (или
плотность газа) убывает с высотой по
тому же закону:
(или
плотность газа) убывает с высотой по
тому же закону:
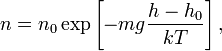
где
![]() —
масса молекулы газа,
—
масса молекулы газа,![]() —постоянная
Больцмана.
—постоянная
Больцмана.
Данное выражение
называется барометрической формулой.
Она позволяет найти атмосферное давление
в зависимости от высоты, или высоту,
если известно давление.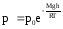
Закон Больцмана о распределении частиц во внешнем потенциальном поле.
Если
воспользоваться выражением р = nkT,
то можно привести барометрическую
формулу к виду:
здесь n
– концентрация молекул на высоте h,
n0
– то же у поверхности Земли. Так как М
= m0NA
, где m0
– масса
одной молекулы, а R
= k
NA,
то мы получим П = m0gh
– это потенциальная энергия одной
молекулы в поле тяготения. Поскольку
kT~‹εпост›,
то концентрация молекул на определенной
высоте зависит от соотношения П и ‹εпост›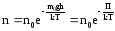
Полученное выражение называется распределением Больцмана для внешнего потенциального поля. Из него следует, что при постоянной температуре плотность газа (с которой связана концентрация) больше там, где меньше потенциальная энергия его молекул.
