
khim
.docxСтроение атома.
В результате
проведенных исследований было установлено,
что в атоме каждого элемента (кроме 1H)
присутствуют протоны, нейтроны
и электроны, причем протоны и нейтроны
сосредоточены в ядре атома, а
электроны - на его периферии (в
электронной оболочке). Число
протонов в ядре равно числу электронов
в оболочке атома и отвечает порядковому
номеру этого элемента в Периодической
системе. Электронная оболочка атома
представляет собой сложную систему.
Она делится на подоболочки с разной
энергией (энергетические уровни);
уровни, в свою очередь, подразделяются
на подуровни, а подуровни включают
атомные орбитали, которые могут
различаться формой и размерами
(обозначаются буквами s, p, d,
f и др.).Квантовая механика –
наука изучающая законы движения
микрообъектов. Микро – очень малые
массы и линейные размеры (электрон,
протон), Макро – очень больших масс.
Следует иметь в виду, что закономерность
движения объектов в микромире существенно
отличаются от привычных нам закрыть
движения объектов в макромире. Эти
отличия могут быть сформулированы в
виде 3-х основных сложений квантовой
механики: 1)Принцип квантования
– В микросистемах энергия поглощается
и выделяется непрерывно и дискретно
(в виде отдельных порций – квантов).
Энергия кванта – E=hv.
Зависимость энергии излучения от
длины излучения – спектр. Опытным
путём установлено, что спектр атома
имеет дискретную природу, состоит из
большого количества узких светящихся
линий, разделёнными чёрными промежутками,
внутри которых атом не поглощает и не
выделяет энергию. Микрообъекты выделяют
и поглощают энергию ступенчато,
причём передвигаться между ступеньками
этих лестниц только скачком, поглощая
или выделяя hV (квант)в
точности равной разницы энергии 2-х
ступенек (квантовый резонанс, «совпадение
частот»).2) Корпускулярно волновой
дуализм (двойственный) - принцип,
согласно которому любой объект может
проявлять как волновые(
длина волны, фаза, энергия), так и
корпускулярные
( масса, линейные размеры, импульс)
свойства. Любой микрообъект обладает
двойственной природой. Электронный
ветер доказывает, что электрон имеет
импульс и массу, а с другой стороны поток
электронов ведут себя как волна, которую
можно зафиксировать радио приёмником.
Соотношение «Луи де Бойля»:
 .Волновая
функция :
.Волновая
функция : –мельчайший объем пространства,
характеризует вероятность нахождения
электрона в пространстве. Область
пространства, в которой вероятно
нахождение электрона в атоме –
орбиталь. Описать её можно при
помощи набора целочисленных параметров
– квантовые числа.Множественность
линий наблюдаемой в спектре атомов
свидетельствует о том, что электрон
принимает участие в разных видах
движения, каждому из которых соответствует
своя энергия. Электрон в атоме находится
на орбитале, которые отличаются друг
от друга своими размерами (радиус, форма,
направление в пространстве). Главное
квантовое число – n=1,2,3…..,
характеризует систему основ энергетических
уровней атома, а так же размеры (радиус)
электронного облака. Орбитальное
квантовое число–
–мельчайший объем пространства,
характеризует вероятность нахождения
электрона в пространстве. Область
пространства, в которой вероятно
нахождение электрона в атоме –
орбиталь. Описать её можно при
помощи набора целочисленных параметров
– квантовые числа.Множественность
линий наблюдаемой в спектре атомов
свидетельствует о том, что электрон
принимает участие в разных видах
движения, каждому из которых соответствует
своя энергия. Электрон в атоме находится
на орбитале, которые отличаются друг
от друга своими размерами (радиус, форма,
направление в пространстве). Главное
квантовое число – n=1,2,3…..,
характеризует систему основ энергетических
уровней атома, а так же размеры (радиус)
электронного облака. Орбитальное
квантовое число–
 =0,1,2,3…..
(n-1),
где n
– главное квантовое число. Характеризует
систему основных энергетических
подуровней атома, а так же форму
электронного облака.
=0,1,2,3…..
(n-1),
где n
– главное квантовое число. Характеризует
систему основных энергетических
подуровней атома, а так же форму
электронного облака.

Для
 =0 s- подуровень, s- орбиталь – орбиталь
сфера
=0 s- подуровень, s- орбиталь – орбиталь
сфера
 =1 p- подуровень, p- орбиталь – орбиталь
гантель
=1 p- подуровень, p- орбиталь – орбиталь
гантель
 =2 d- подуровень, d- орбиталь – орбиталь
сложной формыs-
облако p
– облака
f-подуровень,
f-орбиталь – орбиталь еще более сложной
формы
=2 d- подуровень, d- орбиталь – орбиталь
сложной формыs-
облако p
– облака
f-подуровень,
f-орбиталь – орбиталь еще более сложной
формы
d - облака
Магнитное
квантовое число – характеризует
разрешённую ориентацию в пространстве
(направление) орбиталей разной формы.
m= - …0…+
…0…+
Спиновое
квантовое число
 -
приобретает для электрона два
фиксированных значения(
-
приобретает для электрона два
фиксированных значения( )
и характеризует магнитный момент,
возникающий при вращении электрона
вокруг своей оси.
)
и характеризует магнитный момент,
возникающий при вращении электрона
вокруг своей оси.
Номер периода – n, Порядковый номер – заряд ядра и общее число электронов в атоме, Номер группы – число электронов на валютном слое.
Правило минимума энергии – В любой системе наиболее устойчивой является состояние с наименьшей энергией.Следствие:Нельзя заполнять электронами орбитали с более высокой энергией, не заполнив предварительно орбитали с низкой энергией.
1S < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s.
Запрет Паули - В атоме не может быть двух электронов с одинаковым набором всех квантовых числа. Следствие:Одна орбиталь может вместить в себе максимум 2 электрона, при чём их спиновые квантовые числа должны быть противоположны.
Правило Хунда – В пределах электронного подуровняэлектроны располагаются так, чтобы их суммарный спин был максимальный.Следствие:Орбитали подуровня заполняются электронами сначала по одному, затем по второму.
*************************************************************************************Периодический закон
Номер периода – n, Порядковый номер – заряд ядра и общее число электронов в атоме, Номер группы – число электронов на валютном слое.S-элементы (жёлтый) – укоторых заполняется электронами S-орбиталь.P-элементы(розовый) – P-орбиталь , d-элементы (морская волна) – d-орбиталь, f-элементы (голубой) –f-орбиталь. Валентная оболочка для атома является важной, так как именно она отвечает за всю совокупность химических и физических свойств элемента.Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы. Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях. Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические - присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями. По группам справа налево металлические свойства ослабевают, а сверху в низ – усиливаются.
Периодический закон – Свойства элементов, а так же свойства и формы соединения элементов находиться в периодической зависимости от величины заряда их атомных ядер. Свойства должны не только повторяться, но и закономерно изменяться.
Периодически
изменяющиеся свойства элементов:
1) Радиус атома: Расстояние
от ядра до области вероятного нахождения
электрона последнего квантового числа.
Вдоль по периоду радиус атома уменьшается,
по сколько растёт заряд ядра, растёт и
количество электронов в валентной
оболочке. По группам сверху вниз радиус
– увеличивается, так как увеличивается
количество квантовых слоёв.2)
Энергия ионизации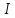 –
это энергия, которую нужно затратить
для того чтобы оторвать электрон от
невозбуждённого атома, чтобы превратить
его в положительный.Является мерой
восстановительных свойств. Вдоль по
периоду
–
это энергия, которую нужно затратить
для того чтобы оторвать электрон от
невозбуждённого атома, чтобы превратить
его в положительный.Является мерой
восстановительных свойств. Вдоль по
периоду
 –
возрастает, так как радиус уменьшается,
а притяжение увеличивается, поэтому
значит надо затратить больше
–
возрастает, так как радиус уменьшается,
а притяжение увеличивается, поэтому
значит надо затратить больше
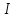 ,
чтобы её преодолеть. В группах сверху
вниз
,
чтобы её преодолеть. В группах сверху
вниз
 уменьшается, так как увеличивается
радиус, а притяжение становится меньше,
а восстановительные свойства
увеличиваются.3)
Сродство электронов
уменьшается, так как увеличивается
радиус, а притяжение становится меньше,
а восстановительные свойства
увеличиваются.3)
Сродство электронов
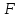 –
энергия выделения(поглощения) при
присоединение электрона к нейтральному
атому. 4)
Электро-отрицательность ОЭО–
полу сумма
–
энергия выделения(поглощения) при
присоединение электрона к нейтральному
атому. 4)
Электро-отрицательность ОЭО–
полу сумма
 и
и
 ,
способность элемента оттягивать
электронную область, мера их
восстановительных свойств.Электро-отрицательность-
по периоду увеличивается, а в подгруппе
уменьшается.
,
способность элемента оттягивать
электронную область, мера их
восстановительных свойств.Электро-отрицательность-
по периоду увеличивается, а в подгруппе
уменьшается.
*************************************************************************************Химическая связь
Химическая связь – форма совместного существования атомов в молекулах, кристаллах и других состояний вещества. Она образуется, так как она энергетически выгодна. По своей природе она представляет собой электростатическую силу притяжения между отрицательно заряженными электронами и положительно заряженными ядрами.
Кривые
потенциальной энергии межатомного
взаимодействия.
Разрыхление – силы притяжения и
отталкивания совпадают по направлению
отталкивания. Равенство сил притяжения
и отталкивания (образуют химические
связи) – фундаментальные параметры хим
связи, а именно,
 -
энергия химической связи (которая
образуется при образование связи, либо
с противоположным знаком, та энергия
которую может затратить, чтобы связь
разорвать).
-
энергия химической связи (которая
образуется при образование связи, либо
с противоположным знаком, та энергия
которую может затратить, чтобы связь
разорвать). -
длина химической связи(межъядерное
расстояние).Ковалентная
связь –
понимают химическую связь по средствам
общих электронных пар локализованных
в пространстве между ядрами. Существует
два основных механизма образования
К.С.,а именно, обменный
и донорно-акцепторный
механизм.Обменный
механизм
– при нём связывающая электронная пара
образуется при перекрыванииорбиталей
атомов содержащие не спаренные электроны.
Донорно-акцепторный механизм – при нём
происходит перекрывание орбитали атома
содержащий пару электронов (донор) и
орбитали атома не содержащий электроны
(пустой атом – акцептор).
-
длина химической связи(межъядерное
расстояние).Ковалентная
связь –
понимают химическую связь по средствам
общих электронных пар локализованных
в пространстве между ядрами. Существует
два основных механизма образования
К.С.,а именно, обменный
и донорно-акцепторный
механизм.Обменный
механизм
– при нём связывающая электронная пара
образуется при перекрыванииорбиталей
атомов содержащие не спаренные электроны.
Донорно-акцепторный механизм – при нём
происходит перекрывание орбитали атома
содержащий пару электронов (донор) и
орбитали атома не содержащий электроны
(пустой атом – акцептор).
 (акцептор)и
(акцептор)и
 (донор)
Свойства химической связи не зависит
от механизма его образования. Характерной
особенностью К.С.: направленность,
насыщаемость, полярность, поляризуемость.
А) Направленность связи-
обусловливает молекулярное строение
органических веществ и геометрическую
форму их молекул. Углы между двумя
связями называют валентными. Б)Насыщаемость
– способность атомов образовывать
ограниченное число ковалентных
связей.1)Степень окисления –
формальный электрический заряд, который
возник бы на атоме, если бы соединение
состояло из ионов. Базис (молекула должна
быть нейтральной, а характер степени
окисления – насыщаемость). 2)Валентность
– понимают число двух центровых и двух
электронных связей, которых может дать
элемент.Способность элементов образовывать
химические связи определяется количеством
его валентных орбиталей, способных
разместить на себе электронные пар, а
вовсе не количеством валентных электронов.
В)Полярностьсвязиобусловлена
неравномерным распределением электронной
плотности вследствие различий в
электро-отрицательностях атомов. По
этому признаку ковалентные связи
подразделяются на неполярные и полярные.
Г) Поляризуемостьсвязи выражается
в смещении электронов связи под влиянием
внешнего электрического поля, в том
числе и другой реагирующей частицы.
Поляризуемость определяется подвижностью
электронов. Электроны тем подвижнее,
чем дальше они находятся от ядер. σ-Связь
– ковалентная связь, возникающая при
перекрывание орбиталями вдоль линии
соединения центра атомов.π-Связь
– ковалентная связь,возникающая при
перекрывание орбиталями не вдоль , а
перпендикулярно линии соединения центра
атомов. Ковалентная связь называется
неполярной,
если ковалентная связь образуется между
атомами различных элементов, то общее
электронное облако смещено в сторону
одного из атомов. В этом случае ковалентная
связь является полярной.Теория
локализированных электронных пар
– теория позволяющая предсказать
геометрическую структуру молекулы.
Суть: если в молекуле более, чем одна
электронная пара, то эти пары располагаются
в пространстве так, чтобы отталкивание
было минимальным,арасстояние –
максимальным. 1 пара – линейная;
2 пары – линейная, но пары направлены
в различные стороны
(донор)
Свойства химической связи не зависит
от механизма его образования. Характерной
особенностью К.С.: направленность,
насыщаемость, полярность, поляризуемость.
А) Направленность связи-
обусловливает молекулярное строение
органических веществ и геометрическую
форму их молекул. Углы между двумя
связями называют валентными. Б)Насыщаемость
– способность атомов образовывать
ограниченное число ковалентных
связей.1)Степень окисления –
формальный электрический заряд, который
возник бы на атоме, если бы соединение
состояло из ионов. Базис (молекула должна
быть нейтральной, а характер степени
окисления – насыщаемость). 2)Валентность
– понимают число двух центровых и двух
электронных связей, которых может дать
элемент.Способность элементов образовывать
химические связи определяется количеством
его валентных орбиталей, способных
разместить на себе электронные пар, а
вовсе не количеством валентных электронов.
В)Полярностьсвязиобусловлена
неравномерным распределением электронной
плотности вследствие различий в
электро-отрицательностях атомов. По
этому признаку ковалентные связи
подразделяются на неполярные и полярные.
Г) Поляризуемостьсвязи выражается
в смещении электронов связи под влиянием
внешнего электрического поля, в том
числе и другой реагирующей частицы.
Поляризуемость определяется подвижностью
электронов. Электроны тем подвижнее,
чем дальше они находятся от ядер. σ-Связь
– ковалентная связь, возникающая при
перекрывание орбиталями вдоль линии
соединения центра атомов.π-Связь
– ковалентная связь,возникающая при
перекрывание орбиталями не вдоль , а
перпендикулярно линии соединения центра
атомов. Ковалентная связь называется
неполярной,
если ковалентная связь образуется между
атомами различных элементов, то общее
электронное облако смещено в сторону
одного из атомов. В этом случае ковалентная
связь является полярной.Теория
локализированных электронных пар
– теория позволяющая предсказать
геометрическую структуру молекулы.
Суть: если в молекуле более, чем одна
электронная пара, то эти пары располагаются
в пространстве так, чтобы отталкивание
было минимальным,арасстояние –
максимальным. 1 пара – линейная;
2 пары – линейная, но пары направлены
в различные стороны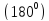 ;
3 пары – треугольная структура
;
3 пары – треугольная структура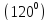 ;
4 пары – тетраэдр
;
4 пары – тетраэдр ; 5 пар – треугольная би-пирамида; 6 пар
– октаэдр. Ионная связь –
химическая связь по средствам
электростатического взаимодействия
заряженных частиц (ионов), с положительным
зарядом – катионы (с отрицательным –
анионы), возникшие в процессах ионизации
нейтральных атомов. Ионная связь не
насыщаема и не направлена. Структура
– твёрдые кристаллические (октаэдрическая
и тетраэдрическая координация ионов)
вещества. Характерная черта ионов
кристалла – большая хрупкость, не
способность сопротивляться
пластичности.Можно представить как
частный случай Ковалентной связи (если
атомы с большой разностью в
электро-отрицательности). Металлическая
связь - связь реализуется в металлах.
Высокая тепло и электропроводность,
высокая пластичность.Атомы металлов
являются электронно дефицитными, то
есть количество электронов меньше, чем
пустых орбиталей.Можно представить
частным случаем ковалентной связи, если
решётку катионов представить в виде
электронного облака, которое свободно
перемещается по всему объёму металла,
при условии её делокализации. Водородная
связь – обязана своим возникновением,
способностям положительно заряженного
иона
; 5 пар – треугольная би-пирамида; 6 пар
– октаэдр. Ионная связь –
химическая связь по средствам
электростатического взаимодействия
заряженных частиц (ионов), с положительным
зарядом – катионы (с отрицательным –
анионы), возникшие в процессах ионизации
нейтральных атомов. Ионная связь не
насыщаема и не направлена. Структура
– твёрдые кристаллические (октаэдрическая
и тетраэдрическая координация ионов)
вещества. Характерная черта ионов
кристалла – большая хрупкость, не
способность сопротивляться
пластичности.Можно представить как
частный случай Ковалентной связи (если
атомы с большой разностью в
электро-отрицательности). Металлическая
связь - связь реализуется в металлах.
Высокая тепло и электропроводность,
высокая пластичность.Атомы металлов
являются электронно дефицитными, то
есть количество электронов меньше, чем
пустых орбиталей.Можно представить
частным случаем ковалентной связи, если
решётку катионов представить в виде
электронного облака, которое свободно
перемещается по всему объёму металла,
при условии её делокализации. Водородная
связь – обязана своим возникновением,
способностям положительно заряженного
иона
 проникать
в электронную оболочку соседних атомов,
образующие химические связи по
донорно-акцепторному механизму. Пример
–
вода.************************************************************************************
проникать
в электронную оболочку соседних атомов,
образующие химические связи по
донорно-акцепторному механизму. Пример
–
вода.************************************************************************************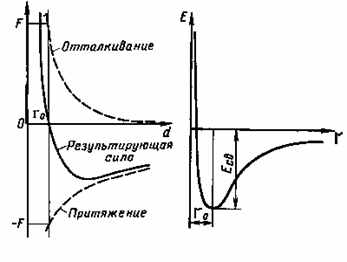


Энергетика химических процессов
Энергетика
химических процессов – наука, изучающая
энергетические эффекты химических
реакций. Любая химическая реакция
сопровождается тем или иным значение
теплового эффекта. Реакции входе которых
выделяется тепло – экзотермические,
поглощается – эндотермические. Энергия
– способность совершать работу. Смысл
любой науки – совершение работы,
превратить в конкретно полезную для
человека. Основной закон энергетики –
закон сохранения энергии.Энергия не
возникает не из чего и не исчезает
бесследно, она только переходит из
одного вида в другой. Тенденции
взаимодействия любых объектов: 1)
Объединительная - Стремление
простых объединяться в более сложные;
2) Разъединительная (наоборот).
Химические противоположности: + и -,
притяжение и отталкивание, металл и
неметалл, донор и акцептор, восстановитель
и окислитель, основание и кислота.
Химический процесс – сгусток противоречий,
для этого необходимо, чтобы 2 объекта
столкнулись, а старые химические связи
в исходных веществах должны быть
разрушены (эндотермический процесс);
только после этого возможны новые
химические связи в продуктах(экзотермический
процесс). Внутренняя энергия –
совокупность всех видов энергии движения
частиц внутри системы за исключением
потенциальной и кинетической, как
единого целого. Внутренняя энергия –
хаотичные столкновения, колебания,
вращения.
![]() Энтальпия
(порядок) – стремление простых
объединяться в сложные. H = U + PV
– энтальпия (внутренняя энергия
расширения системы, мера работоспособности
системы).
Энтальпия
(порядок) – стремление простых
объединяться в сложные. H = U + PV
– энтальпия (внутренняя энергия
расширения системы, мера работоспособности
системы).![]() - тепловой эффект химической реакции.
В термодинамической системе
выделяющуюся теплоту химического
процесса условились считать отрицательной
(экзотермический процесс, ΔH < 0),
а поглощение системой теплоты соответствует
эндотермическому процессу, ΔH > 0.
Можно рассчитать по закону Гесса:
- тепловой эффект химической реакции.
В термодинамической системе
выделяющуюся теплоту химического
процесса условились считать отрицательной
(экзотермический процесс, ΔH < 0),
а поглощение системой теплоты соответствует
эндотермическому процессу, ΔH > 0.
Можно рассчитать по закону Гесса:
 ,
Частный случай закона сохранения
энергии; Тепловой эффект сложного
многостадийного процесса зависит от
начального состояния (исходное вещество)
и конечного состояния (продукт реакции)
и не зависит от числа промежуточных
стадий процессов. Энтальпией
образования химических соединения
называют энтальпию реакции образования
одного моля сложноговещества из простых
веществ. В качестве простых веществ
выбирают химические элементы в их
естественном фазовом и химическом
состоянии пристандартных условиях (P =
101,325 кПа) и взяты для температуры T = 298
K. Термохимические уравнения - это
химические уравнения, в которых указан
тепловой эффект.Стандартные тепловые
данные есть в справочнике.Под энтальпией
гидратации — ΔHгидр, понимается
теплота, которая выделяется при переходе
1 моля ионов из вакуума в раствор.Энергия
связи (для данного состояния системы) —
разность между полной энергией
связанного состояния системы тел или
частиц и энергией состояния, в котором
эти тела или частицы бесконечно удалены
друг от друга и находятся в состоянии
покоя:
,
Частный случай закона сохранения
энергии; Тепловой эффект сложного
многостадийного процесса зависит от
начального состояния (исходное вещество)
и конечного состояния (продукт реакции)
и не зависит от числа промежуточных
стадий процессов. Энтальпией
образования химических соединения
называют энтальпию реакции образования
одного моля сложноговещества из простых
веществ. В качестве простых веществ
выбирают химические элементы в их
естественном фазовом и химическом
состоянии пристандартных условиях (P =
101,325 кПа) и взяты для температуры T = 298
K. Термохимические уравнения - это
химические уравнения, в которых указан
тепловой эффект.Стандартные тепловые
данные есть в справочнике.Под энтальпией
гидратации — ΔHгидр, понимается
теплота, которая выделяется при переходе
1 моля ионов из вакуума в раствор.Энергия
связи (для данного состояния системы) —
разность между полной энергией
связанного состояния системы тел или
частиц и энергией состояния, в котором
эти тела или частицы бесконечно удалены
друг от друга и находятся в состоянии
покоя:
![]() Энтальпийные
диаграммы. Сведения, с которыми мы имели
дело в рассмотренном выше примере, могут
быть представлены в графической форме
с помощью энтальпийной диаграммы (рис.
5.10). Верхний уровень на этой диаграмме
называется исходным уровнем. Он
соответствует значению энтальпии Н° =
0 и условно изображает свободные элементы
в их стандартных состояниях. Для
эндотермических реакций исходный
уровень оказывается расположенным в
нижней части диаграммы. На энтальпийной
диаграмме коноды изображаются наклонными
прямыми. Поскольку на графиках изобар
коноды располагаются горизонтально,
т.е. положение их легко определить, а на
энтальпийной диаграмме - наклонно под
разными углами к оси абсцисс, то для
удобства построений энтальпийную
диаграмму обычно совмещают с графиком
изобарных температурных кривых.
Энтропия (степень беспорядка или
степень свободы) – охарактеризовывает
разъединительную тенденцию, то есть -
есть не только объединение, но и
разъединение объектов. Энтропия зависит
от: 1) Температуры системы, чем больше ,
тем выше беспорядок. 2) Объем – чем
больше, тем выше беспорядок. 3) Давление
и агрегатное состояние.
Энтальпийные
диаграммы. Сведения, с которыми мы имели
дело в рассмотренном выше примере, могут
быть представлены в графической форме
с помощью энтальпийной диаграммы (рис.
5.10). Верхний уровень на этой диаграмме
называется исходным уровнем. Он
соответствует значению энтальпии Н° =
0 и условно изображает свободные элементы
в их стандартных состояниях. Для
эндотермических реакций исходный
уровень оказывается расположенным в
нижней части диаграммы. На энтальпийной
диаграмме коноды изображаются наклонными
прямыми. Поскольку на графиках изобар
коноды располагаются горизонтально,
т.е. положение их легко определить, а на
энтальпийной диаграмме - наклонно под
разными углами к оси абсцисс, то для
удобства построений энтальпийную
диаграмму обычно совмещают с графиком
изобарных температурных кривых.
Энтропия (степень беспорядка или
степень свободы) – охарактеризовывает
разъединительную тенденцию, то есть -
есть не только объединение, но и
разъединение объектов. Энтропия зависит
от: 1) Температуры системы, чем больше ,
тем выше беспорядок. 2) Объем – чем
больше, тем выше беспорядок. 3) Давление
и агрегатное состояние.
 Изобарно
изотермический потенциал. Энергия
Гиббса.- суммарный эффект энтальпийного
и энтропийного фактора.
Изобарно
изотермический потенциал. Энергия
Гиббса.- суммарный эффект энтальпийного
и энтропийного фактора.
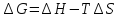 ,
кроме того
,
кроме того
 .
Процесс возможен, если .
.
Процесс возможен, если .
 наиболее
вероятна экзотермические процессы,
ведущие с увеличение объёма системы
(взрыв). .
наиболее
вероятна экзотермические процессы,
ведущие с увеличение объёма системы
(взрыв). . – принципиально не возможен
(жареный лёд
– принципиально не возможен
(жареный лёд
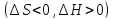 .
. –
Химическоеравновесие.
–
Химическоеравновесие.
*************************************************************************************Химическое
равновесие – особое состояние обратимой
химической реакции, при которой скорость
прямой реакции становиться равной
скорости обратимой, при этом
 .
Большинство реакцией –обратимы,
поэтому состояние химического равновесия
для них актуально, поэтому нужно научиться
этим состоянием управлять. Реакции,
которые протекают только в одном
направлении и завершаются полным
превращением исходных реагирующих
веществ в конечные вещества, называются
необратимыми.Обратимыми называются
такие реакции, которые одновременно
протекают в двух взаимно противоположных
направлениях.Необратимые реакции
протекают до полного расходования
одного из исходных веществ, т. е. если
одно из получающихся веществ выпадает
в осадок или выделяется в виде газа.
Условия для этого: температура,
концентрация, катализаторы, давление.
.
Большинство реакцией –обратимы,
поэтому состояние химического равновесия
для них актуально, поэтому нужно научиться
этим состоянием управлять. Реакции,
которые протекают только в одном
направлении и завершаются полным
превращением исходных реагирующих
веществ в конечные вещества, называются
необратимыми.Обратимыми называются
такие реакции, которые одновременно
протекают в двух взаимно противоположных
направлениях.Необратимые реакции
протекают до полного расходования
одного из исходных веществ, т. е. если
одно из получающихся веществ выпадает
в осадок или выделяется в виде газа.
Условия для этого: температура,
концентрация, катализаторы, давление. , в условии равновесия -
, в условии равновесия -
 Закон действующих масс:
Закон действующих масс:
 -
константа химического равновесия(В
условии химического равновесия, отношение
произведений концентраций продуктов
реакции с произведением концентрации
произведённого вещества, в степенях их
стехиометрических коэффициентов –
есть величина постоянная, и называется
-
константа химического равновесия(В
условии химического равновесия, отношение
произведений концентраций продуктов
реакции с произведением концентрации
произведённого вещества, в степенях их
стехиометрических коэффициентов –
есть величина постоянная, и называется
 -
константа химического равновесия).Для
реакции, протекающей в изобарно-изотермических
условиях, в некотором неравновесном
исходном состоянии энергии
Гиббса или химические
потенциалы реагирующих веществ и
продуктов реакции в общем случае не
одинаковы, их разность (ΔGT)
может быть рассчитана по уравнению:
-
константа химического равновесия).Для
реакции, протекающей в изобарно-изотермических
условиях, в некотором неравновесном
исходном состоянии энергии
Гиббса или химические
потенциалы реагирующих веществ и
продуктов реакции в общем случае не
одинаковы, их разность (ΔGT)
может быть рассчитана по уравнению:
![]()
где
![]() —
отношение парциальных давлений участников
реакции в исходном состоянии в степенях,
равных их стехиометрическим коэффициентам;
R — универсальная
газовая постоянная. Это уравнение
называют уравнением изотермы химической
реакции. Оно позволяет рассчитать
изменение энергии Гиббса при протекании
процесса и определить направление
протекания реакции:
—
отношение парциальных давлений участников
реакции в исходном состоянии в степенях,
равных их стехиометрическим коэффициентам;
R — универсальная
газовая постоянная. Это уравнение
называют уравнением изотермы химической
реакции. Оно позволяет рассчитать
изменение энергии Гиббса при протекании
процесса и определить направление
протекания реакции:
при π <Kp ΔG< 0 — реакция идёт в прямом направлении, слева направо;
при π = Kp ΔG = 0 — реакция достигла равновесного состояния;
при π >Kp ΔG> 0 — реакция идёт в обратном направлении.
Химическим
равновесием можно управлять. Алгоритмом
этого управления служитпринципЛеШателье:
Если на систему, находящуюся в
состоянии равновесия, произвести
какую-либо внешнее воздействие
(температура, концентрация, давление),
то в системе протекут такие процессы,
уменьшающие эффект внешнего воздействия.
В результате возникнет колебательный
процесс, который вновь приведёт систему
состояние равновесия.Для того чтобы
затормозить прямую реакцию, нужно
увеличить
 ,
для этого достаточно ввести в систему
один из продуктов данной реакции. Для
того чтобы сдвинуть реакцию вправо,
необходимо увеличить концентрацию
исходных веществ (А и В).Электролитическая
диссоциация (константа ионизации)
слабых электролитов, согласно теории
Аррениуса, является обратимой
реакцией, то есть схематически её можно
представить уравнениями (для одновалентных
ионов):
,
для этого достаточно ввести в систему
один из продуктов данной реакции. Для
того чтобы сдвинуть реакцию вправо,
необходимо увеличить концентрацию
исходных веществ (А и В).Электролитическая
диссоциация (константа ионизации)
слабых электролитов, согласно теории
Аррениуса, является обратимой
реакцией, то есть схематически её можно
представить уравнениями (для одновалентных
ионов):
KA ↔ K+ + A−, где: KA — недиссоциированное соединение; K+ — катион; A− — анион.
Константу равновесиятакой реакции можно выразить уравнением:
|
|
где:
[KA] — концентрация недиссоциированного соединения в растворе;
[K+] — концентрация катионов в растворе;
[A−] — концентрация анионов в растворе.
Константу равновесия применительно к реакции диссоциации называют константой диссоциации.
Вода является очень слабым электролитом: лишь незначительная часть молекул воды диссоциирует на ионы:H2O ↔ H+ + OH¯Экспериментально установлено, что произведение концентраций ионов H+ и OH¯ в воде и разбавленных водных растворах электролитов является величиной постоянной и называется ионным произведением воды (Kw)КИП.
Kw = [H+] + [OH¯] = 10-14,
[H+] = [OH¯] = 10-7 моль/л
Для удобства условились выражать кислотность раствора как отрицательный логарифм концентрации водородных ионов. Эту величину называют водородным показателем и обозначают pH.pH = -lg[H+] мера, характеризующая химическую среду. В зависимости от соотношения концентраций ионов H+ и OH¯ различают три вида реакции среды:
кислая среда: [H+] > [OH¯]; [H+] > 10-7 моль/л; pH< 7;
нейтральная среда: [H+] = [OH¯] = 10-7 моль/л; pH = 7;
щелочная среда: [H+] < [OH¯]; [H+] < 10-7 моль/л; pH>7;
Индикаторы
– изменяют свою окраску в зависимости
от pH среды, наиболее частые: Лакмус –
кислота(красный) – щелочь(синий) –
нейтральная среда(фиолетовый); Метилоранж
– кислота(красный) – щёлочь(жёлтый) –
нейтральная среда(оранжевый); Фенолфталеин
– кислота(бесцветный) –щёлочь(малиновый)
–нейтральная ср.(бесцветный)
*************************************************************************************Химическая
кинематика – наука изучающая
скорости и механизм протекания
реакций.Скорость химических
реакций – изменение концентрации
реагирующего вещества за единицу
времени.
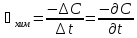 ,
где С – концентрация (число частиц на
единицу объёма для гомогенных реакций,
или число частиц приходящихся на единицу
площади разделов фаз для гетерогенных
реакций). Скорость химических
реакцийзависит от: 1)
химической природы реагирующих веществ;,
2) зависит от концентрации
(при увеличение концентрации скорость,
как правило, увеличивается, так как
при увеличении числа концентрации-
возрастает их вероятность столкновения
между собой); 3) зависит от
температуры (при увеличении температуры,
скорость химической реакции тоже
увеличивается, увеличивается степень
беспорядка (энтропия) и увеличивается
вероятность столкновения частиц между
собой);4) зависит от наличия
в системе особых веществ, катализаторов
– резко увеличивающие или затормаживающие
химическую реакцию. Для произвольной
химической реакции aA +bB + cC = dD + eE + fF +
… в рамках теории столкновения, закон
скорости можно записать: v
= k[A]a[B]b[C]сk
– константа скорости химической
реакции при концентрации реагирующего
вещества 1 единица.
,
где С – концентрация (число частиц на
единицу объёма для гомогенных реакций,
или число частиц приходящихся на единицу
площади разделов фаз для гетерогенных
реакций). Скорость химических
реакцийзависит от: 1)
химической природы реагирующих веществ;,
2) зависит от концентрации
(при увеличение концентрации скорость,
как правило, увеличивается, так как
при увеличении числа концентрации-
возрастает их вероятность столкновения
между собой); 3) зависит от
температуры (при увеличении температуры,
скорость химической реакции тоже
увеличивается, увеличивается степень
беспорядка (энтропия) и увеличивается
вероятность столкновения частиц между
собой);4) зависит от наличия
в системе особых веществ, катализаторов
– резко увеличивающие или затормаживающие
химическую реакцию. Для произвольной
химической реакции aA +bB + cC = dD + eE + fF +
… в рамках теории столкновения, закон
скорости можно записать: v
= k[A]a[B]b[C]сk
– константа скорости химической
реакции при концентрации реагирующего
вещества 1 единица.
 ,
где z – общее число
столкновений в данной системе,
,
где z – общее число
столкновений в данной системе,
 –
энергия активации,
–
энергия активации,
 энтропия
активации. Активирующий комплекс
– одной из узловых понятий теории
Столкновений является представления
о активирующем комплексе, возникающий
в момент столкновения реагирующих
частиц между собой ( и потому его
существование весьма кратковременно)
и характеризующийся тем, что старые
химические связи в исходных веществах
начинают разрываться, но ещё не полностью
разорваны, а новые химические связи
начинают образовывается, но ещё не
полностью образовались.Энергия
активации – энергия для того
чтобы привести реагирующую систему в
состояние активирующего комплекса.
Активация всегда выше начального
состояния, так как для разрыва старых
связей нужно затрачивать энергию. Чем
больше
энтропия
активации. Активирующий комплекс
– одной из узловых понятий теории
Столкновений является представления
о активирующем комплексе, возникающий
в момент столкновения реагирующих
частиц между собой ( и потому его
существование весьма кратковременно)
и характеризующийся тем, что старые
химические связи в исходных веществах
начинают разрываться, но ещё не полностью
разорваны, а новые химические связи
начинают образовывается, но ещё не
полностью образовались.Энергия
активации – энергия для того
чтобы привести реагирующую систему в
состояние активирующего комплекса.
Активация всегда выше начального
состояния, так как для разрыва старых
связей нужно затрачивать энергию. Чем
больше
 ,
тем меньше
,
тем меньше
 .Энтропия
активации
.Энтропия
активации – Характеризующие число
геометрически правильных столкновений,
необходимых для реализации данного
переходного состояния. Геометрически
правильное столкновение
– Характеризующие число
геометрически правильных столкновений,
необходимых для реализации данного
переходного состояния. Геометрически
правильное столкновение

