
- •Раздел I. Особенности термодинамики, как науки.
- •I.1. Основные определения термодинамики.
- •Пример 3. Химические реакции и фазовые превращения:
- •Правило знаков для потенциалов:
- •I.2. Теплота, работа, внутренняя энергия.
- •I.3. Равновесные и неравновесные взаимодействия. Статические и нестатические процессы.
- •I.4. Состояния системы. Уравнения состояния системы.
- •I.5. Реальные свойства газа. Уравнение состояния реального газа.
- •I.6. Работа и теплота. Свойства работы и теплоты.
- •I.7. Характеристические функции.
- •Мнемонический приём для термодеформационной системы:
- •I.8. Дифференциальные соотношения термодинамики.
- •Раздел II. Теория теплоёмкостей однородных систем.
- •II.1. Классификация теплоемкостей по единицам количества вещества и видам процессов.
- •II.2. Общая формула теплоёмкостей однородных систем.
- •II.3. Внутренняя энергия и теплоёмкость идеального газа.
- •II.4. Зависимость теплоёмкостей от давления, объёма и температуры.
- •II.5. Зависимость теплоёмкостей от температуры. Истинная и средняя теплоёмкости.
- •Раздел III. Вычисление энтропии.
- •III.1. Три группы формул для вычисления энтропии.
- •III.2. Уравнение адиабаты реального газа в общем виде.
- •Раздел IV. Политропный (политропический) процесс.
- •IV.1. Уравнение политропы. Определение показателя политропы.
- •IV.2. Работа, теплота и внутренняя энергия в политропном процессе.
- •IV.3. Изменение энтропии в политропном процессе.
- •Раздел V. Исследование изопроцессов. Работа, теплота, внутренняя энергия в изопроцессах.
- •Раздел VI. Второй закон термодинамики.
- •V рис. 18. Произвольный прямой обратимый цикл.
II.4. Зависимость теплоёмкостей от давления, объёма и температуры.
Ранее было получено,
dQ = T dS
dQ = c dT
Приравняем эти выражения и выразим массовую теплоемкость с :
![]() откуда,
как частные случаи, запишем массовые
изохорные и изобарные теплоемкости
откуда,
как частные случаи, запишем массовые
изохорные и изобарные теплоемкости
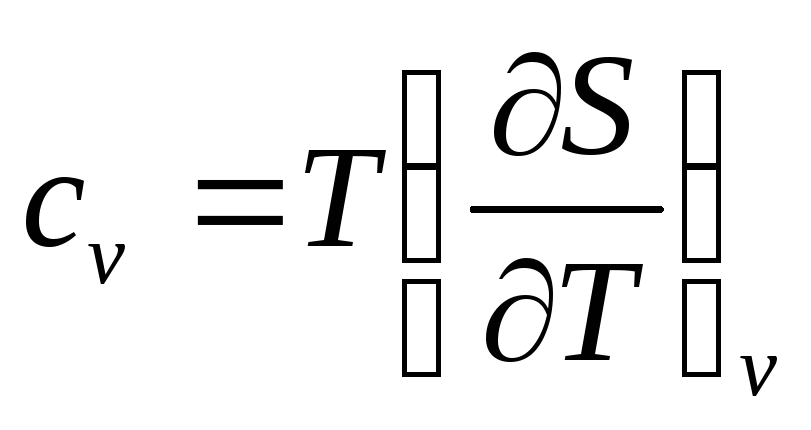 (88)
(88)
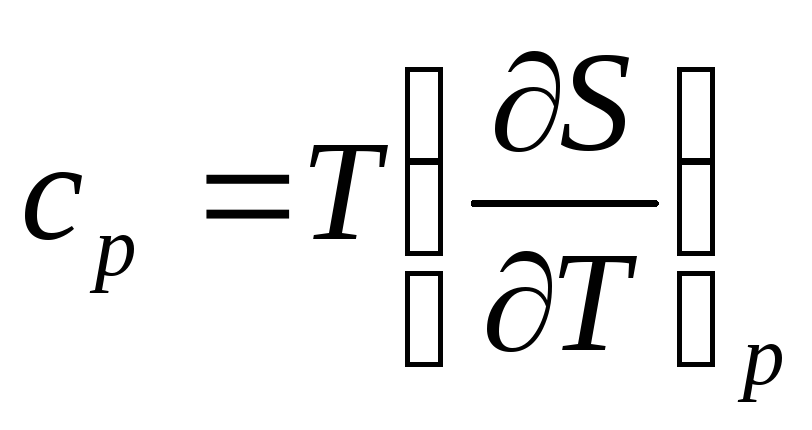 (89)
(89)
Исследуем зависимость массовой изохорной теплоёмкости от величины объёма при Т=const. Из (88)
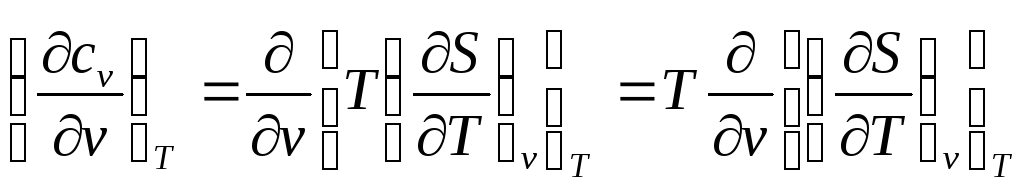 (90)
(90)
Так
как
 не
относится не к одному из типов
дифференциальных соотношений
термодинамики, то поменяем порядок
дифференцирования:
не
относится не к одному из типов
дифференциальных соотношений
термодинамики, то поменяем порядок
дифференцирования:
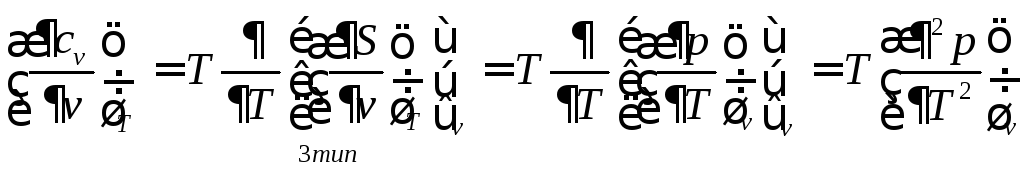 (91)
(91)
Таким
образом, изохорная теплоёмкость зависит
от величины объёма системы (сv=cv(v)),
если в уравнении состояния газа давление
от температуры зависит нелинейно, т.е.
![]() const.
Если давление газа в уравнении состояния
зависит от температуры линейно, то cv
cv(v).
const.
Если давление газа в уравнении состояния
зависит от температуры линейно, то cv
cv(v).
Исследуем зависимость изобарной теплоёмкости от величины давления при T=const. Из (89)
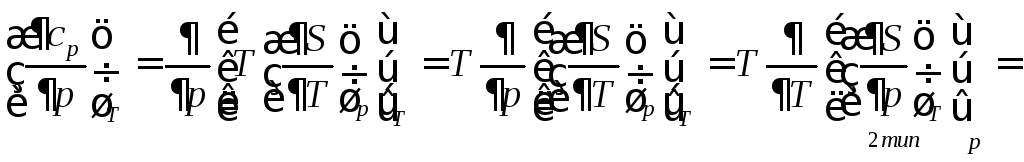
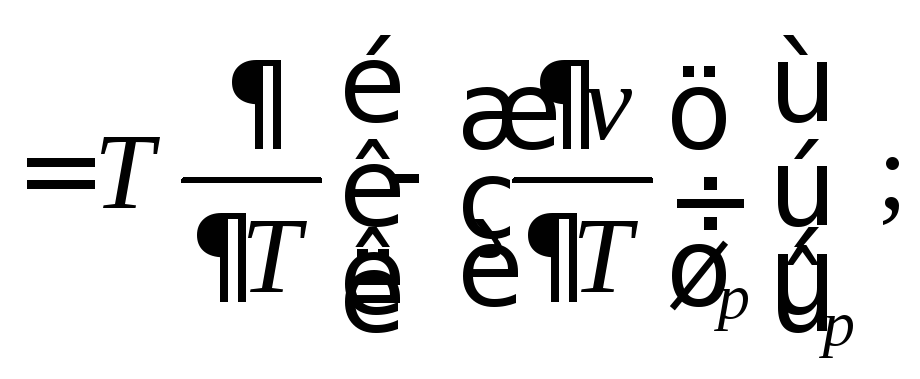
Окончательно
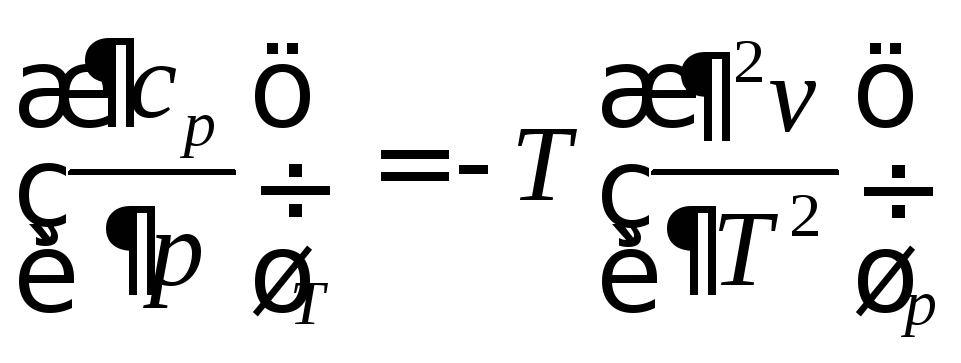 (92)
(92)
Таким образом, изобарная теплоёмкость зависит от величины давления, если удельный объём в уравнении состояния зависит от температуры нелинейно, т.е.
при
![]() const
cp=cp(p)
const
cp=cp(p)
И наоборот,
п ри
ри![]() =const,
cp=cp(p)
=const,
cp=cp(p)
В последнем случае не нужно опытным путем определять изобарную теплоемкость в лабораторных установках при различных значениях давления.
Все полученные в этом параграфе формулы относятся как к реальным, так и идеальным газам.
Исследуем идеальный газ, используя формулы (91), (92):
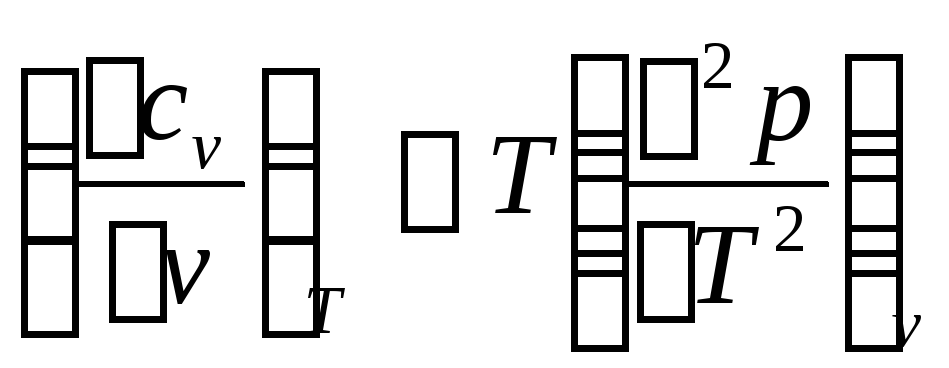 ,
,
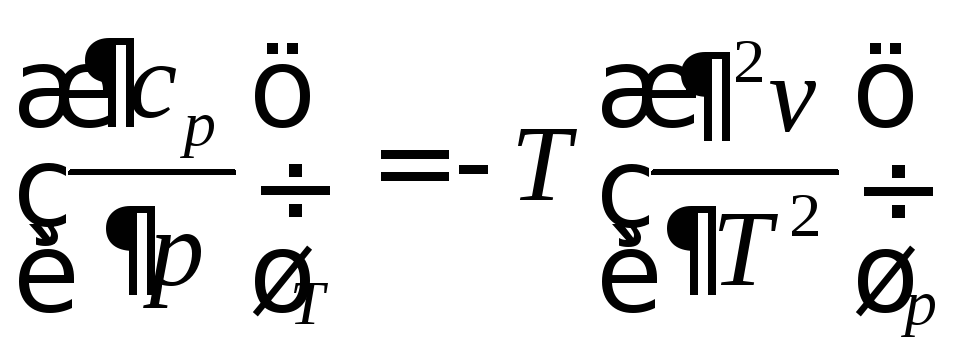 .
.
Из
(77) для идеального газа
![]() .
.
Тогда
из (91) 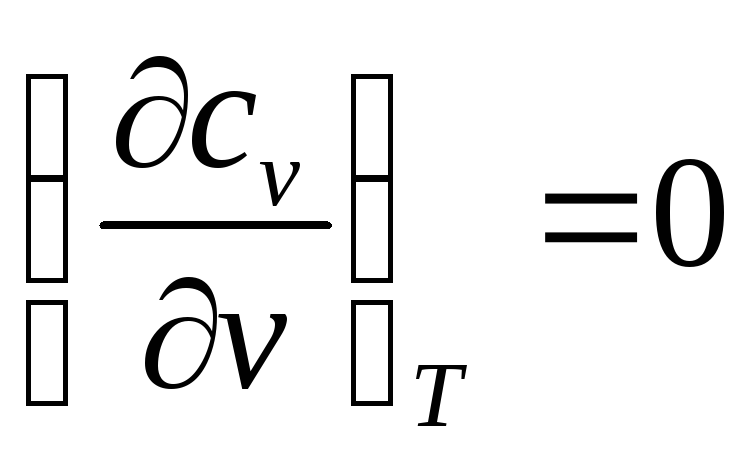 ,
следовательно, изохорная теплоёмкость
идеального газа от величины объёма не
зависит (cv
cv(v)).
,
следовательно, изохорная теплоёмкость
идеального газа от величины объёма не
зависит (cv
cv(v)).
Исследуем зависимость изобарной теплоёмкости от величины давления:
Из
(78)
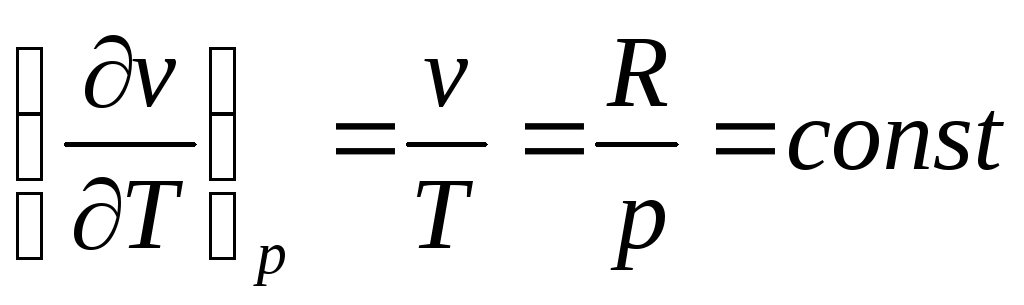 .
Тогда из (91)
.
Тогда из (91) ,следовательно,
изобарная теплоемкость идеального газа
от величины давления не зависит (cp
cp(p)).
,следовательно,
изобарная теплоемкость идеального газа
от величины давления не зависит (cp
cp(p)).
Исследуем
зависимость изохорной теплоёмкости от
величины давления, то есть найдем
![]() ,
представив ее в виде произведения двух
частных производных
,
представив ее в виде произведения двух
частных производных
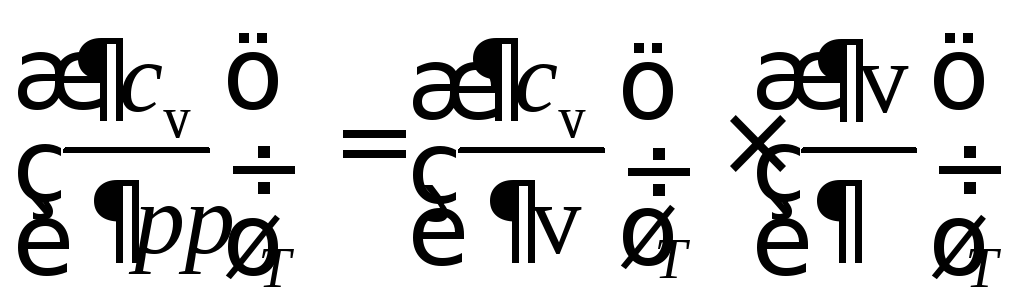 .
Так как
.
Так как
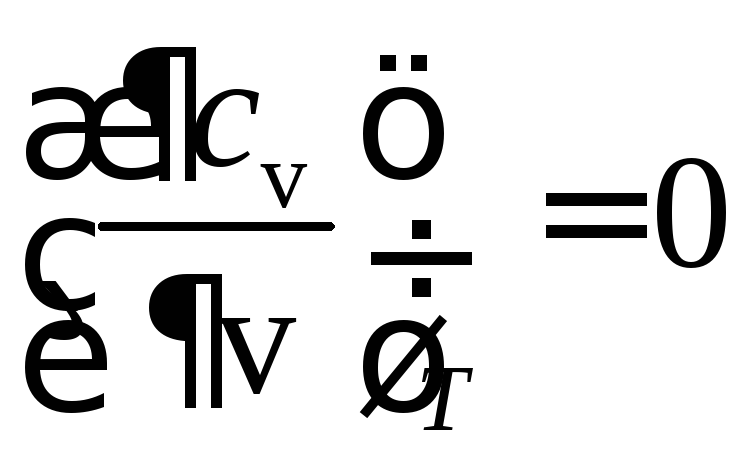 ,
а сжимаемость
,
а сжимаемость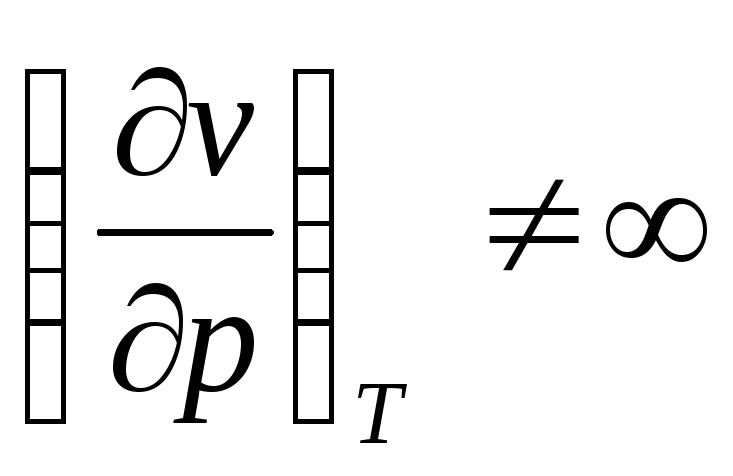 , то
, то
![]() или
или![]()
Исследуем зависимость изобарной теплоемкости от величины объема:
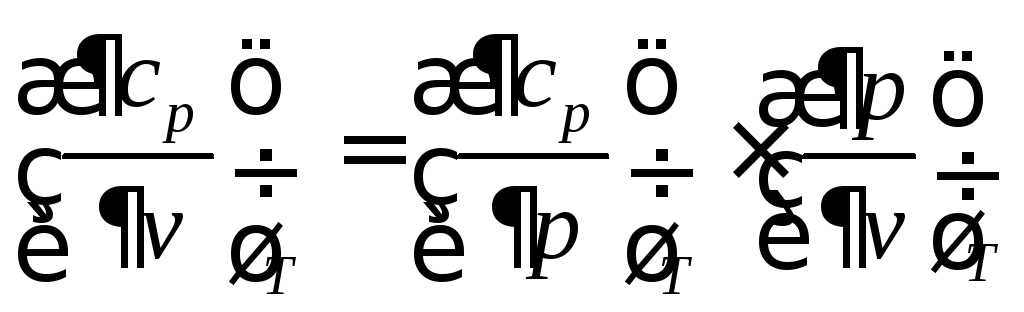 ,
так как
,
так как
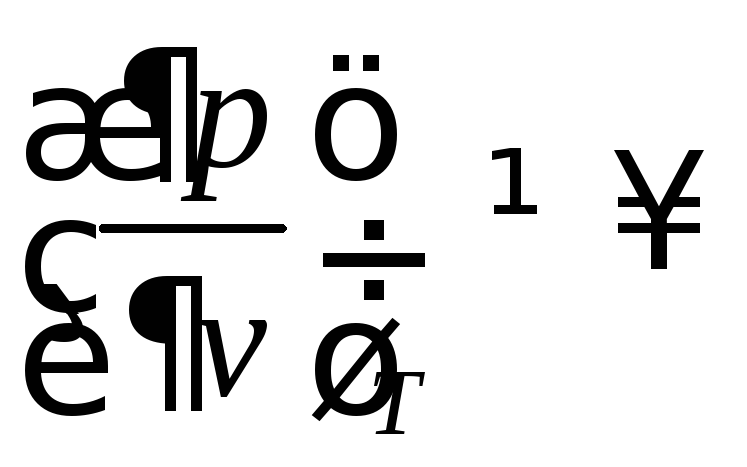 ,
а
,
а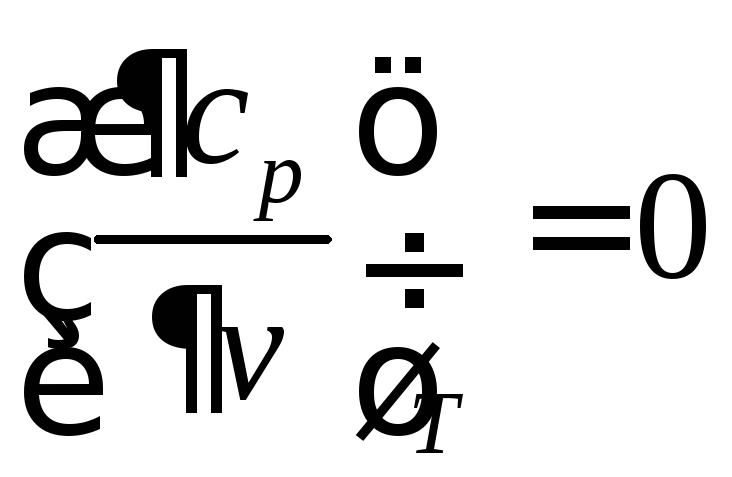 или
или![]()
Исследуем зависимость изохорной и изобарной теплоёмкости от величины температуры:
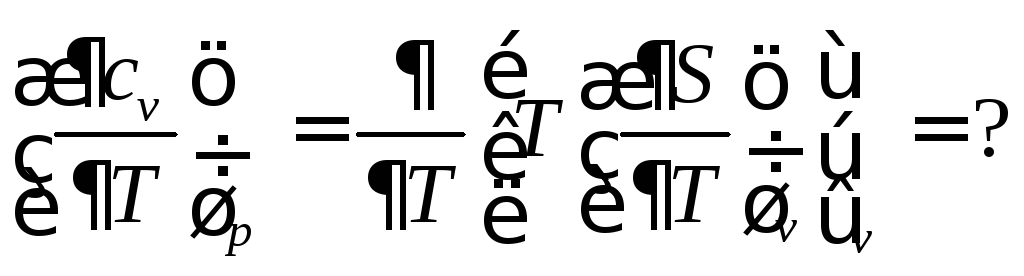
Поменять порядок дифференцирования и применить затем дифференциальные соотношения термодинамики в этом случае не удается, то есть термодинамика на этот вопрос не отвечает. Получить зависимость изохорной теплоёмкости от температуры можно либо опытным путём, либо с помощью какой-либо физической теории.
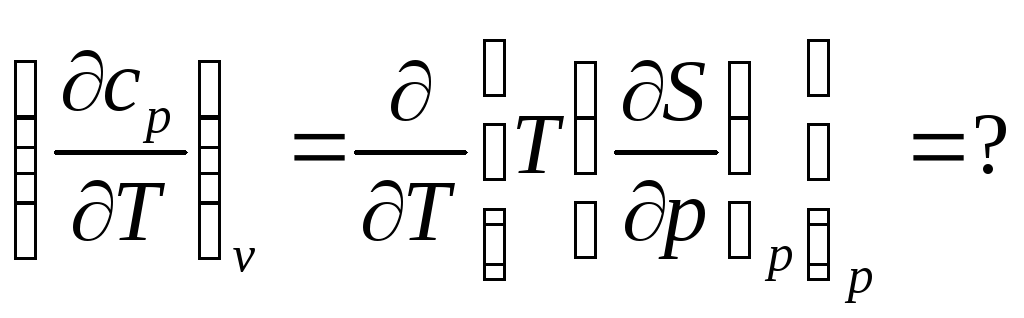
Как и в предыдущем случае термодинамика на этот вопрос не отвечает. Зависимость изобарной теплоемкости от температуры определяется либо опытным путём, либо с помощью какой-либо физической теории.
II.5. Зависимость теплоёмкостей от температуры. Истинная и средняя теплоёмкости.
Опытные значения зависимости теплоёмкостей от температуры представляются в виде таблиц, графиков и эмпирических зависимостей. У большинства технических газов cv и cp возрастают с ростом температуры.
Из физики известно, что температура газа не связана колебательным движением атомов и молекул, а зависит от кинетической энергии их поступательного движения. Подводимая к газу теплота по мере роста температуры перераспределяется всё более и более в пользу колебательного движения и поэтому прирост температуры на одинаковый подвод теплоты замедляется.
с








с0

t

рис.8.
Зависимость теплоемкости от температуры.
На рис.8 опытные данные обозначены в виде звездочек. Сплошная линия – аппроксимирующая их кривая, подчиняющаяся уравнению
c=c0 + at + bt2 + dt3 +… (93)
Здесь c0, a, b, d и т.д – эмпирические коэффициенты (коэффициенты, полученные опытным путем). Аппроксимирующая кривая проводится с использованием метода наименьших квадратов или других аналогичных математических методов. В инженерных расчетах ограничиваются первыми двумя слагаемыми в правой части (93), то есть полагают зависимость теплоемкости от температуры линейной:
c=c0 + at (94)
В частности
cv=c0v + at (95)
cр=c0р + at (96)
Все ранее полученные формулы, включая 94,95,96, относятся к истинной теплоемкости, то есть теплоемкости для конкретной (заданной) температуры
В практических расчётах часто требуется знать среднее значение теплоёмкостей в заданном интервале температур от t1 до t2
Обозначим
среднюю теплоемкость как
![]() ,
или
,
или![]()
С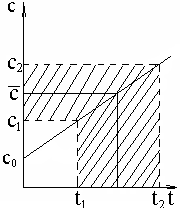 редняя
теплоемкость, в соответствие с рис.9
редняя
теплоемкость, в соответствие с рис.9
определяется как средняя линия трапеции.


![]()

С
 учетом (94)
учетом (94)
рис.9.
К
определению средней теплоемкости![]()
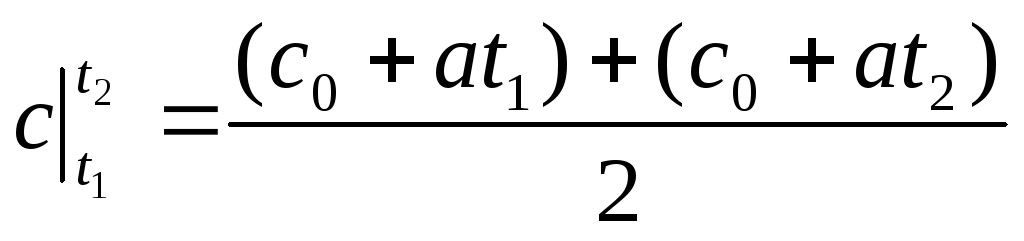
или окончательно
 (97)
(97)
Конкретные значения С0 и а содержатся в справочной литературе по теплофизическим характеристикам веществ. Связь между средним и истинным теплоемкостями выражается формулой
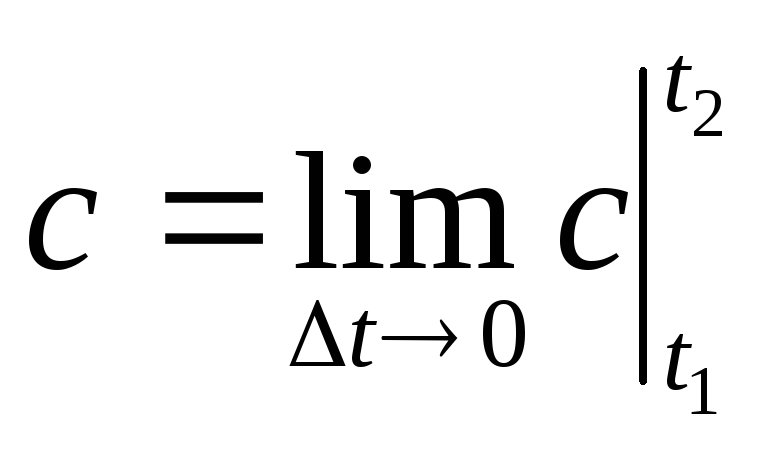 (98)
(98)
В тех случаях, когда зависимость теплоёмкости от температуры не удаётся удовлетворительно аппроксимировать зависимостью c=c0+at, можно воспользоваться формулой для нелинейной зависимости:
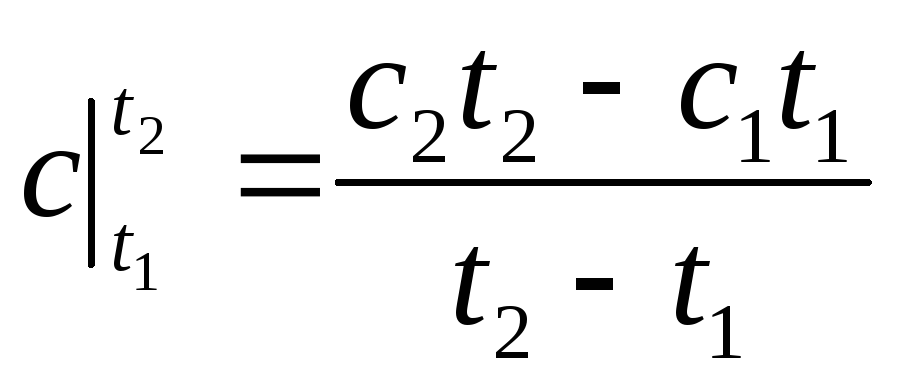 (99)
(99)
Для оценочных (не очень точных) расчетов, когда отсутствуют опытные данные для теплоемкости в виде таблиц или эмпирических формул, можно воспользоваться результатами молекулярно-кинетической теории газов.
Из молекулярно-кинетической теории газов известно соотношение
U
= 12,56T
![]() (100)
(100)
Здесь U - внутренняя энергия одного киломоля идеального газа, Т - абсолютная термодинамическая температура, К.
Для массовой изохорной теплоемкости идеального газа, ранее было получено (73):
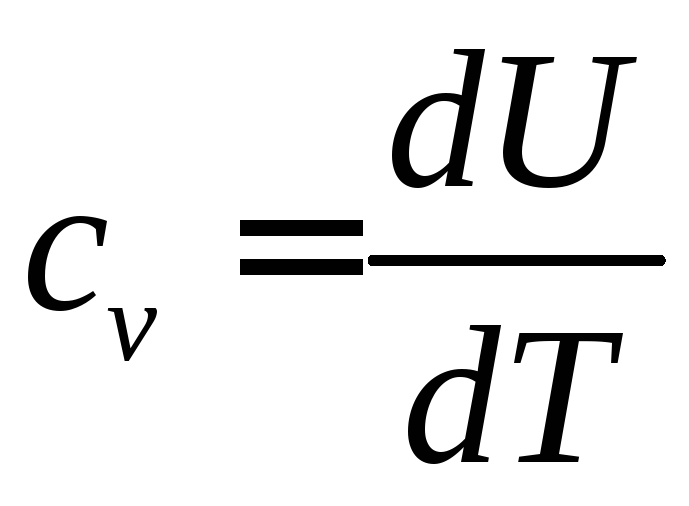
Так
как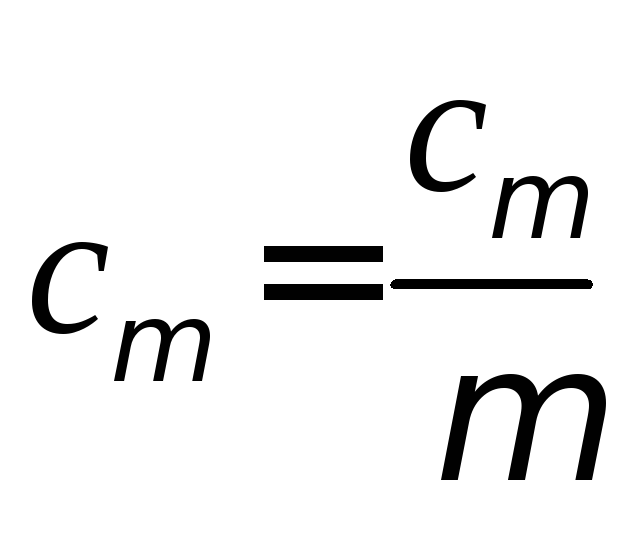 и
и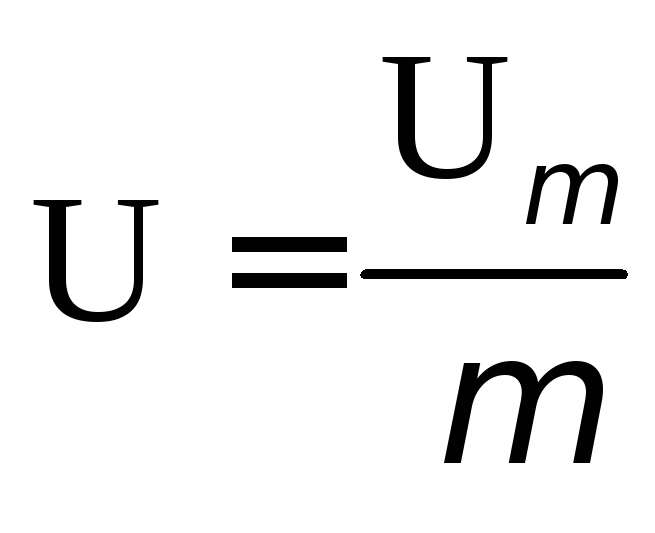 ,
томолярная
изохорная теплоемкость равна
,
томолярная
изохорная теплоемкость равна
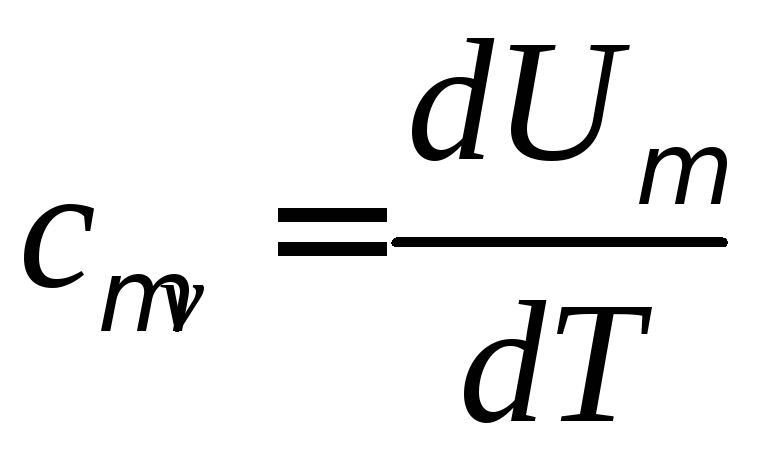 (101)
(101)
Подставляя (100) в (101) получим
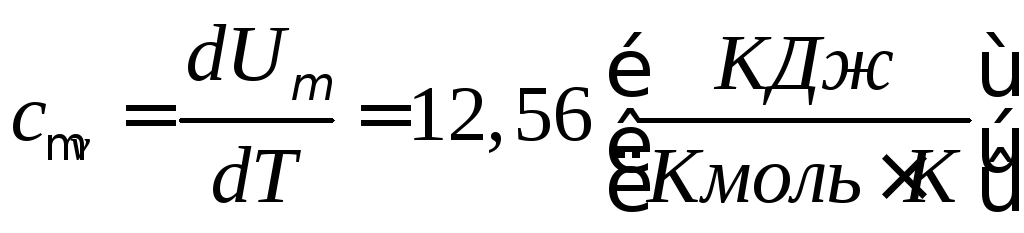 (102)
(102)
Молярную
изобарную теплоемкость сµp
найдем из уравнения Майера: cp
- cv
= R
= 8,314 ![]() ,
откуда
,
откуда
cp=cv+R=12,56+8,314
20,93![]() (103)
(103)
Как следует из (102) и (103), по молекулярно-кинетической теории газов теплоемкости не зависят от температуры, то есть берутся средним значением и во всем диапазоне температур. Именно в этом заключается оценочный характер этих значений.
Понятию идеального газа в большей степени соответствуют одноатомные газы при малых давлениях. На практике же, чаще всего приходится иметь дело с двухатомными, трехатомными и более атомными газами.
Например, воздух – двухатомный газ, так как он по объёму на 79% состоит из азота (N2) и на 21% из кислорода (O2).
Для оценочных расчетов можно пользоваться следующей таблицей:
|
Газ |
cv,
|
cp,
|
|
Одноатомный |
1 |
20,93 |
|
Двухатомный |
2 |
29,31 |
|
Трех и более атомный |
29,31 |
37,68 |
Примечание: в этой таблице, во второй и третьей строчках теплоемкости скорректированы по результатам опытов.
У реальных газов, в отличие от идеального, теплоёмкости могут зависеть не только от температуры, но и от объёма и давления.

 2,56
2,56 0,93
0,93