
Exam / OTVETY_KLIN_FARMA
.pdf
Механизм всасывания: Лекарственные средства могут проникать через клеточные мембраны следующими способами:
•Пассивная диффузия(из области с высокой концентрации в низкую )
•Облегченная пассивная диффузия (с помощью молекулыпереносчика)
•Активный транспорт (перенос веществ против градиента концентрации,с затратой энергии)
•Пиноцитоз(поглощение вещества клеткой ,с помощью захвата )
Характер связывания с белками-Для препаратов, которые должны распространяться по телу через кровь, эффективность может зависеть от степени его связывания с белками плазмы крови. Чем меньше препарат связывается, тем больший он оказывает эффект. Основными белками крови, с которыми связываются лекарства, являются альбумины, липопротеины, гликопротеины и глобулины (α, β, γ).
59. Основные принципы рациональной антибактериальной терапии.
Основные принципы рациональной антибактериальной терапии. 10 принципов рационального применения антимикробных средств в амбулаторной практике
1.Антимикробный препарат следует назначать только при наличии обоснованных показаний.
2.Выбор оптимального режима антибактериальной терапии следует осуществлять с учетом фармакокинетики и фармакодинамики антибиотика и подразумевает назначение адекватного антибиотика в адекватной дозе при планируемой адекватной длительности терапии.
3.При выборе антимикробного препарата необходимо знать региональную ситуацию с антибиотикорезистентностью наиболее актуальных возбудителей и учитывать наличие у пациента риска инфицирования данными устойчивыми возбудителями.
4.Избегать назначения антимикробных препаратов низкого качества и с недоказанной эффективностью.
5.Избегать необоснованного профилактического назначения антибактериальных, антифунгальных и противовирусных средств.
6.Первичную оценку эффективности антимикробной терапии следует проводить в интервале 48–72 часа после начала лечения.
7.Объяснять пациентам вред несоблюдения предписанного режима антибактериальной терапии и опасности самолечения антибиотиками.
8.Способствовать соблюдению пациентами предписанного режима применения антимикробного препарата (препарат, суточная доза, кратность приема, длительность применения).
9.Использовать в практической работе возможности микробиологической лаборатории и активно внедрять экспресс-методы по этиологической диагностике инфекций.
10.Использовать в качестве руководства Практические рекомендации экспертов, основанные на доказательной медицине.
60.Особенности применения лекарственных средств у беременных.

На основании данных клинических и экспериментальных исследований ЛС по степени риска для плода подразделяют на категории от А (нет доказательств риска) до D (риск доказан), выделяют также категорию Х (абсолютно противопоказанные беременным).
Лекарственные средства, абсолютно противопоказанные в период беременности (категория
X)
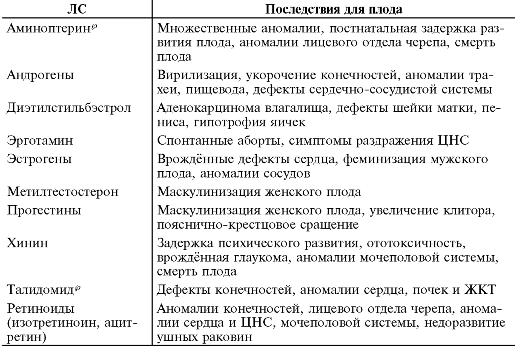
ЛС, относимые к категории D, оказывают необходимое терапевтическое действие, но предпочтение в определённых ситуациях следует отдать другим ЛС со сходными фармакологическими свойствами (но не входящим в категорию D) и лишь по жизненным показаниям их можно назначать беременным (табл. 6-3).
Таблица 6-3. Лекарственные средства, обладающие тератогенным действием(категорияD)

Окончание табл. 6-3
Особенности фармакокинетики лекарственных средств у беременных
Особенности всасывания. Во время беременности снижены сократительная и секреторная функции желудка, что приводит к замедлению всасывания плохо растворимых ЛС. В то же время всасываемость других ЛС может быть повышена в результате увеличения времени нахождения в кишечнике, вызванного снижением его моторики. Индивидуальные различия в адсорбции ЛС у беременных зависят от срока беременности, от состояния сердечнососудистой системы, ЖКТ и физико-химических свойств ЛС.
Особенности распределения. Во время беременности изменения объёма циркулирующей крови, количества воды, жира, клубочковой фильтрации, содержания белков в плазме влияют на скорость и эффективность распределения ЛС.
•Увеличение объёма внеклеточной жидкости, объёма циркулирующей крови, почечного кровотока и клубочковой фильтрации у беременной, а также поступление ЛС в организм плода и амниотическую жидкость приводят к снижению концентрации некоторых ЛС в плазме крови беременных (по сравнению с небеременными).
•Во время беременности и в ранний послеродовой период (с 15-й недели беременности и до 2 нед после родов) отмечено уменьшение связывания ЛС с белками плазмы, прежде всего с альбуминами, что обусловлено снижением их количества (15-30%), конкуренцией за связывание с белками между ЛС и ненасыщенными жирными кислотами, концентрация которых во время беременности значительно возрастает. Снижение степени связывания с белками приводит к тому, что концентрация свободной фракции ЛС значительно повышается (например, диазепама - более чем в 3 раза).
Особенности метаболизма. Во время беременности отмечают разнонаправленное изменение активности многих печёночных ферментов, участвующих в фазах метаболизма I и II ЛС, причём для ряда ферментов эта активность варьирует в зависимости от сроков беременности (например, активность изофермента цитохрома Р-450 3А4 повышена в течение всего срока беременности). Снижение же активности изофермента цитохрома Р-450 1А2 приводит к прогрессивному увеличению периода полувыведения кофеина (в I триместре беременности он ра-
вен 5,3 ч, во II - 12 ч и в III - 18 ч). На интенсивность печёночного метаболизма влияет изменение гормональной регуляции, соотношения величины сердечного выброса и печёночного кровотока.
Особенности выведения. В результате значительного увеличения скорости клубочковой фильтрации у беременных (70%) и снижения степени связывания с белками элиминация ЛС возрастает. В поздние сроки беременности на скорость почечной элиминации существенное влияние оказывает положение тела. Патологически протекающая беременность вносит дополнительные изменения в фармакокинети-
ку ЛС.

61.Особенности применения лекарственных средств у пациентов с заболеваниями печени и почек (печеночная, почечная недостаточность, изменения дозирования лекарств).
ФАРМАКОКИНЕТИЧЕСКИЕ ОСОБЕННОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРИ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТИ
Почечная недостаточность влияет на лекарственное распределение, уменьшая системный клиренс, почечное выведение, связь с белками и распределение в тканях. Кроме того, воздействует на выведение ЛС и внепочечное распределение ЛС, метаболизирующихся печенью. Хотя снижение почечных метаболических ферментов при ПН ответственно за уменьшение лекарственного клиренса, но всё же больший вклад вносят изменения в транспортных системах. Если почки выводят активный препарат в неизменённом виде, то необходимо провести коррекцию дозы препарата в зависимости от уровня функционирования почек, особенно для ЛС с низким терапевтическим индексом.
При ПН происходит накопление продуктов - уремических токсинов, обычно устраняемых почками. Уремические токсины у больных с ХПН вызывают тромбоцитарную дисфункцию, гипертонию, сердечную недостаточность, дефектную связь белка с ЛС, нарушения в щитовидной железе, ингибирование метаболизма в печени, неврологическую симптоматику. Органические анионы - индоксил сульфат (IS), 3-карбокси-4-метил-5-пропил-2- фуранпропаноиновая кислота (CMPF), индолацетат (IA) и гипуровая кислота (НА) накапливаются в плазме при ХПН. Гипуровая кислота ингибирует переработку глюкозы в мышцах. Повышение уровня гипуровой кислоты коррелирует с неврологической симптоматикой у больных с ХПН, и она, также как и CMPF вызывает повышение уровня, который ассоциируют не только с неврологической дисфункцией, но и с нарушениями функции щитовидной железы. Показано, что CMPF, фуран вместе с другими уремическими токсинами, блокирует связь ЛС с белками и их канальцевую экскрецию. Накопление уремических токсинов усугубляет течение ПН. Это подтверждают работы на лабораторных животных (табл. 9-1).
Таблица 9-1. Изменение транспортёров при ПН
С развитием ПН количество транспортных систем уменьшается, а уремические токсины ингибируют почечную экскрецию различных ЛС и эндогенных органических кислот путём блокирования ОАТ. ПН влияет на все фазы метаболизма как печёночного, так и почечного.
• Фаза I метаболизма в печени. ПН ассоциирует со снижением активности и экспрессии Р-

450 вторично за счёт снижения mRNA.
• В почках изоферменты Р-450 (1А1, 1А2, 2Е1) находятся в проксимальных почечных канальцах, поскольку количество их невелико, то они не вносят клинически значимого вклада в метаболизм ЛС. Фаза II метаболизма-глюкуронирование и ацетилирование. Уремические токсины угнетают глюкуронирование и ацетилирование даже при сохранённой функции Р-450. Для ЛС с низким метаболизмом (например, эпросартан, розувастатин) это имеет огромное значение. Следует отметить, что в почках происходит глюкуронирование таких ЛС как парацетамол, зидовудин (азидотимидин♠), морфин, сульфаниламиды, фуросемид, хлорамфеникол.
Показано, что уремические токсины угнетают следующие транспортные системы: ОАТ1, ОАТ3, ОАТр2, ОАТР-С. В экспериментальных работах на крысах было показано, что уремические токсины CMPF и IS ингибируют ОАТР2 и hOАТР-С гепатоцитов. Содержание этих белков значительно меньше при ХПН. Кроме того, уремические токсины при ХПН уменьшают активность эффлюксного кишечного транспортёра P-gp. Показано, что у крыс при ХПН происходит угнетение P-gp и MRP2 в кишечнике, в то время как ОАТр2 и ОАТр3 остаются неизмёнными, т.е. инфлюксный механизм преобладает над эффлюксным. Кроме того, у крыс при ХПН происходит увеличение уровня MRP2 в почках и MRP3 в печени, что может служить серьёзным защитным механизмом. Ингибирование транспортёров ведёт к неблагоприятным взаимодействиям. Уремические токсины ингибируют почечное выведение большинства ЛС. ОАТ1 и ОАТ3 выводят эти уремические токсины, но сами токсины ингибируют транспортёры (см. табл. 9-1). Было предложено использовать эндотелеин 1 (ЕТ1) как маркёр уремического токсина. ЕТ1 значительно снижает транспорт циклоспорина и метотрексата, так как подавляет их транспортёры - P-gp и MRP2. При ПН количество ЕТ1 увеличивается. ЕТ1 индуцирует ингибирование эффлюксных транспортёров, ответственных за выведение циклоспорина, цисплатина, радиоконтрастных веществ, считающихся нефротоксичными.
9.1.1. Печёночный клиренс у пациентов с почечной недостаточностью
Многие ЛС, элиминирующиеся печенью, демонстрируют уменьшение выведения у пациентов с ПН, что невозможно объяснить уменьшением ренального клиренса. Ву и Бенет (2005) предложили классификацию ЛС, в зависимости от их растворимости и проходимости
[Biopharmaceutics Classification System (BCS)]. Данная классификация может помочь определить путь элиминации ЛС, эффект эффлюксных и инфлюксных транспортёров при всасывании и распределении ЛС, в зависимости от пути введения.
Использование этой системы классификации может быть полезным в понимании и предсказании механизмов уменьшенного печёночного клиренса при ПН.
Таблица 9.2. BCS-классификация ЛС со сниженным печеночным клиренсом у пациентов с ПН
Использование этой системы может быть полезным в понимании и предсказании механизмов уменьшенного печеночного клиренса при почечной недостаточности.
Согласно BCS-системе, класс I ЛС экстенсивно метаболизируется в печени, а роль транспортёров вообще незначительна. Следовательно, при почечной недостаточности уменьшение печеночного клиренса этих ЛС, типа пропранолола, верапамила, имодипина (см. таб. 9.2) наиболее вероятно произошло бы из-за уменьшенной деятельности фермента. Изменения в деятельности транспортёра не затронули бы печёночого клиренса этого класса ЛС. ЛС класса II также экстенсивно метаболизируются, но роль эфлюксных и инфлюксных транспортёров также важна для печёночной элиминации. Следовательно, уменьшение печёночной элиминации ЛС, типа церивастатина, ловастатина может произойти из-за изменений в транспортёрах и в деятельности фермента, и в результате взаимодействия фермента и транспортёра, печёночная элиминация может быть изменена, даже когда нет почечной недостаточности. Для ЛС класса III, типа эпростан, розувастатин, где важны эффлюксные и инфлюксные транспортёры для элиминации ЛС, уменьшение печёночного
(жёлчного) клиренса произошло бы из-за уменьшенной функции транспортёров, без заинтересованности метаболических ферментов.
Так как ФК многих ЛС изменяется при почечной недостаточности, то необходимо использовать три правила: 1) использовать препараты с внепочечным выведением; 2) использовать номограммы, руководства, рекомендации по выбору доз; 3) использовать лекарственный мониторинг. Номограммы составлены с учетом уровня креатинина в сыворотке крови, массы тела и роста больного. Определив клиренс, врач пользуется соответствующими рекомендациями по дозированию и/или кратности назначения соответствующего препарата.
При ПН корректировку режима дозирования осуществляют с помощью расчёта клиренса эндогенного креатинина (С/кр). В норме клиренс эндогенного креатинина составляет 80-120 мл/мин. При ПН снижение доз используемых препаратов более эффективно, чем удлинение интервалов введения, так как в крови длительно поддерживается низкая концентрация препарата. Функциональное состояние почек необходимо учитывать при применении ЛС, имеющих узкий терапевтический коридор - аминогликозиды, СГ, аминофиллин (эуфиллин*), антикоагулянты, новокаин. Необходимо подбирать дозы пожилым пациентам со сниженной массой тела. У таких пациентов ориентируются на скорость клубочковой фильтрации, так как содержание креатинина в сыворотке может быть нормальным. При нарушении функции почек выведение метаболитов ЛС может быть ускорено, так как при ПН количество несвязанного препарата с белками плазмы возрастает. Возможно, быстрое выведение ЛС при ХПН связано с ускорением метаболизма в печени. На связь ЛС с белками плазмы также влияет гипоальбуминемия, непосредственно изменение структуры альбуминов, а также соединения, мешающие связыванию препарата с белками плазмы. Факторы, определяющие реакцию на ЛС при ПН:
•степень нарушения функции почек;
•токсичность препарата;
•пути метаболизма ЛС;
•фармакокинетика;
•зависимость эффекта от дозы.
9.1.2. Коррекция дозы лекарственных средств при почечной недостаточности
Индекс fu - фракция ЛС, выводимая почками в неизменённом виде; fu=1, если почки выводят препарат полностью; fu=0, если почки

не выводят препарат. Для коррекции дозы ЛС при ПН необходимо:
•проверить значение fu препарата или его активного метаболита, выводимого через почки в неизменённом виде;
•рассчитать Cl креатинина (Cr) по формуле Коккрофта-Голта с учётом массы тела, возраста и пола больного:
 У женщин показатель Cl креатинина умножают на 0,85, так как мышечная масса меньше. Необходимо вычислить массу тела в норме, если у пациента ожирение. При расчёте в единицах мл/мин нужно 50 000 заменить на 815. Формула неприменима к детям до 12 лет. В
У женщин показатель Cl креатинина умножают на 0,85, так как мышечная масса меньше. Необходимо вычислить массу тела в норме, если у пациента ожирение. При расчёте в единицах мл/мин нужно 50 000 заменить на 815. Формула неприменима к детям до 12 лет. В
норме Cl креатинина Cr >1,5 мл/с; если Cr <0,06 ммоль/л, то необходимо подставить Cr=0,06. У пожилых пациентов почечный клиренс более медленный. Следовательно, клиренс препаратов с высоким индексом fu уменьшается с возрастом. В формуле учитывают, что пожилые пациенты могут иметь маленький показатель клиренса креатинина при нормальном уровне креатинина в сыворотке.
Таблица 9-3. Препараты, требующие коррекции дозы при ПН
Окончание таблицы 9-3

* - метаболит с высоким fu.
Для препаратов, выводящихся через почки в неизмененном виде, следует использовать формулу, где fu близко к 1:
 При этом уменьшение дозы, принимаемой в единицу времени, обозначают DR (dose-rate).
При этом уменьшение дозы, принимаемой в единицу времени, обозначают DR (dose-rate).
При условии, что препарат выводится не только через почки в неизмененном виде, необходимо корректировать дозу только той части препарата, которая выводится в неизмененном виде ( fu). Общая формула, в которой учитывается fu, метаболизируемая фракция (1 - fu) и уровень функционирования почек, т.е. для 0,5 < fu <1:
 Это особенно важно для препаратов с низким терапевтическим индексом. При тяжёлой ПН не рекомендуют антимикробные препараты, которые преимущественно выводят почки. Если всё же их исполь-
Это особенно важно для препаратов с низким терапевтическим индексом. При тяжёлой ПН не рекомендуют антимикробные препараты, которые преимущественно выводят почки. Если всё же их исполь-
зуют, то перед введением каждой дозы нужно определить уровень препарата в крови. Антимикробную терапию при быстром нарастании ПН, тяжёлой уремии, диализе нельзя корректировать по уровню креатинина, а также необходимо следить за концентрацией антибиотика в крови. Антимикробные препараты, выводимые почками и печенью при лёгкой и умеренной ПН (уровень креатинина сыворотки ниже 3 мг%), назначают в обычных дозах. При умеренной и тяжёлой ПН увеличивают интервалы между введениями. При тяжёлой ПН противопоказан нитрофурантоин и все тетрациклины (кроме, доксициклина); не рекомендуют сульфаниламиды и аминосалициловую кислоту. В качестве профилактики острой почечной недостаточности (ОПН) неэффективны и даже вредны петлевые диуретики, агонисты дофаминовых рецепторов, натрийуретические пептиды, антагонисты аденозина (теофиллин), а также антагонисты кальция.
