

Связь энтропии с термическими величинами
|
|
|
|
|
|
|
|
|
S k ln W |
(1) |
W2 |
|
|
|
||||||||||
|
|
S S2 S1 |
k lnW2 |
k lnW1 |
k ln |
(2) |
|
|||||||||||||||||
|
|
W1 |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
W2 |
|
(V2 ) |
N A |
|
|
|
|
|
|
(V2 ) N A |
|
(V2 ) |
||||||||||||
W |
|
(V ) |
|
(3) |
S k ln |
|
|
|
|
|
kNA ln |
|
|
(4) |
||||||||||
|
|
|
(V ) |
|
(V ) |
|||||||||||||||||||
1 |
|
1 |
|
|
|
|
|
|
|
|
|
|
1 |
|
1 |
|
||||||||
При равновесном (обратимом) изотермическом |
|
|
|
|
||||||||||||||||||||
расширении |
Qобр |
RT ln |
(V2 ) |
|
и |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
(V1 ) |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
(V ) |
|
Qобр |
|
(5) |
Подставим (5) в (4). Получим (6) |
||||||||||||||||||
ln (V ) |
RT |
|
S kN |
|
Qобр Qобр |
(6) |
|
|
|
|||||||||||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
А |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
RT |
T |
|
|
|
|
|||||||
Модуль 2 Лекция 12 |
1 |

|
Q |
dS |
Qобр |
|
S |
обр |
|
||
|
Т |
|||
Т |
||||
|
|
Величина, численно равная отношению количества тепла δQобр, полученного
системой в изотермическом процессе, к температуре Т процесса, называется
приведенным количеством тепла (приведенной теплотой).
Энтропия – скалярная физическая величина, характеризующая состояние термодинамической системы, приращение которой при обратимом процессе равно количеству приведенного тепла, полученному системой в этом процессе.
Модуль 2 Лекция 12 |
2 |

P
обр
1
Q dU A
2 |
dU Q A |
|
|
необр |
dUобр Qобр Aобр |
0 |
|
|
|
||
|
V |
|
|
|
|
|
|
dU необр Qнеобр Aнеобр |
Но dUобр=dUнеобр (при Т=const dU=0),а
δАобр>δАнеобр
Следовательно, δQобр > δQнеобр |
3 |
Модуль 2 Лекция 12 |

dS |
Т |
Т |
dS |
Т |
|
Qобр |
Qнеобр |
|
Qнеобр |
|
|
|
|
|
Если Q 0 то dS 0
необратимый (адиабатический процесс)
dS>0 необратимый процесс dS=0 обратимый процесс
Модуль 2 Лекция 12 |
4 |

Связь энтропии с
Sпараметрами состоянияSS
 V
V  P T
P T
Энтропия – количественная мера степени молекулярного беспорядка.
Энтропия – величина статистическая.
Чем больше беспорядок в системе, тем больше ее энтропия
Модуль 2 Лекция 12 |
5 |

Существует два метода вычисления энтропии:
а) статистический (S=k·lnW),
б) термодинамический dS Qобр
Т
(с помощью интеграла приведенных теплот).
Прибора, непосредственно измеряющего энтропию, не существует.
Модуль 2 Лекция 12 |
6 |

Связь энтропии с параметрами состояния
Q dU PdV } dS dU PdV |
|
Q TdS |
T |
S dU |
PdV |
||
2 |
|
2 |
|
1 |
T |
1 |
T |
Модуль 2 Лекция 12 |
7 |

Связь энтропии с параметрами состояния
|
|
S dU |
PdV |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
1 T |
|
1 |
|
T |
|
|
|
|
|
|
|
|
||||
1. |
V=const |
2 m iR dT |
|
m |
|
|
|
|
|
T |
|
|
|
m |
|
P |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
2 |
||
S М 2 T |
M |
|
(CV ) ln |
|
M |
(CV ) ln |
P |
|||||||||||||||||
|
|
|
T |
|
||||||||||||||||||||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
1 |
|
2. |
P=const |
S |
m |
(CP ) ln |
T2 |
|
m |
(CP ) ln V2 |
|
|
||||||||||||||
|
|
M |
|
|
||||||||||||||||||||
|
|
|
M |
T1 |
|
|
|
|
|
V1 |
|
|
||||||||||||
3. |
T=const |
S |
m |
RlnV2 |
|
m |
Rln |
|
P1 |
|
|
|
||||||||||||
|
|
|
P |
|
|
|||||||||||||||||||
|
|
|
|
|
M |
V |
|
|
|
M |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|||
4. |
δQ=0 |
∆S=0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Модуль 2 Лекция 12 |
8 |

Обобщенная формулировка второго начала термодинамики
1.Все процессы в природе необратимы, т.е. самопроизвольно (без вмешательства извне) протекают в одном направлении.
2.В адиабатически замкнутой системе энтропия при любом процессе (обратимом или необратимом) не может убывать.
3.Невозможен процесс, единственным результатом которого является переход тепла от холодного тела к горячему.
Второе начало термодинамики справедливо только для замкнутых (теплоизолированных) систем. Энтропия незамкнутых систем может изменяться произвольным образом.
Модуль 2 Лекция 12 |
9 |
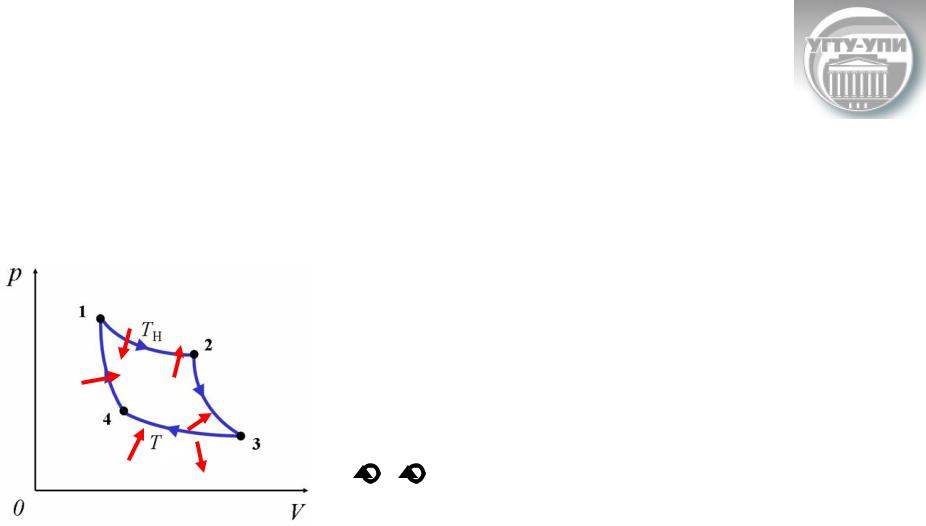
Цикл Карно
Цикл Карно – равновесный цикл, состоящий из двух изотерм и двух адиабат
1-2 ТН=const. Рабочее тело получает от нагревателя тепло QН и
совершает работу А12>0, т.е. отдает энергию окружающим телам. |
|
|
|
|||||||||||||||||
|
m |
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
A12 Q1 |
|
RT1 |
ln V1 |
|
|
|
|
A23 |
m |
iR (TН Т |
|
|||||||||
M |
2-3 |
Q |
=0 |
хол ) 0 |
||||||||||||||||
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
23 |
|
|
|
M 2 |
|
|
|
|
||||
|
QН |
А12 |
3-4 |
Tхол=const |
A Q |
|
|
m |
RT lnV4 0 |
|||||||||||
|
|
|
|
M |
||||||||||||||||
|
|
|
|
|
|
34 |
|
2 |
|
|
|
|
2 |
V3 |
||||||
А41 |
|
|
4-1 Q41=0 |
A |
|
m iR |
(T Т ) А 0 |
|||||||||||||
|
|
|
||||||||||||||||||
|
M 2 |
|||||||||||||||||||
|
|
|
А23 |
|
|
41 |
|
|
Н |
|
хол |
|
23 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
А34 |
A = Q |
A12+A23-A34-A41=QН-Qхол |
A=Q=QН-Qхол |
||||||||||||||||
|
хол Q |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
хол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
КПД тепловой машины – отношение работы, совершаемой ею за цикл, к количеству тепла, полученному ею за цикл
|
А |
QН Qхол 1 |
Qхол |
|
QН |
QН |
|||
|
QН |
Модуль 2 Лекция 12 |
10 |

|
|
Для моля: |
|
|
a |
|
|
P |
|
|
(V ) b RT |
(V ) |
2 |
||
|
|
|
|
Уравнение Ван-дер-Ваальса
(P |
m2 |
|
a |
)(V |
m |
b) |
m |
RT |
|
M 2 V 2 |
M |
M |
|||||||
|
|
|
|
||||||
Для произвольной массы газа
Модуль 2 Лекция 12 |
11 |
