
- •Введение в органическую химию
- •3. Изомерия органических веществ
- •4. Особенности углерод-углеродных связей
- •5. Электронные эффекты в органических молекулах
- •1.4. Номенклатура органических соединений
- •Алифатические углеводороды
- •1. Предельные углеводороды (алканы)
- •1.1. Номенклатура и изомерия алканов
- •1.2. Методы получения алканов.
- •1.3. Химические свойства алканов
- •1.4. Применение алканов
- •2. Этиленовые углеводороды (алкены)
- •2.1. Номенклатура и изомерия алкенов
- •2.2. Способы получения алкенов
- •2.3. Химические свойства алкенов
- •2.4. Применение алкенов
- •3. Диены
- •3.1. Электронное строение сопряженных диенов
- •3.2.Химические свойства сопряженных диенов
- •3.3. Применение сопряженных диенов
- •3.4. Получение диенов
- •4. Углеводороды с одной тройной связью (алкины)
- •4.1. Номенклатура и изомерия алкинов
- •4.2. Методы получения алкинов
- •4.3. Химические свойства алкинов
- •4.4. Применение ацетилена
- •Ароматические углеводороды
- •Спирты и фенолы
- •2. Изомерия и номенклатура спиртов
- •3. Методы получения спиртов:
- •7. Фенолы
- •Карбонильные соединения (альдегиды и кетоны)
- •1. Классификация карбонильных соединений
- •3. Методы получения альдегидов и кетонов
- •4. Физические свойства
- •5. Химические свойства
- •5.1. Реакции присоединения:
- •5.3. Реакции с участием атома водорода в α-положении
- •5.4. Окисление альдегидов и кетонов
- •Карбоновые кислоты
- •1. Классификация карбоновых кислот
- •2. Номенклатура и изомерия
- •4. Физические свойства
- •5. Химические свойства
- •7.1. Жиры
- •Оксикислоты. Оксокислоты
- •1. Оптическая изомерия
- •1.1. Оптически активные соединения с одним асимметрическим атомом углерода.
- •1.2. Проекционные формулы Фишера
- •1.3. Оптически активные соединения с несколькими
- •1.4. Генетические ряды
- •2. Оксикислоты
- •2.2. Физические и химические свойства
- •3.Оксокислоты
- •4. Ацетоуксусный эфир. Таутомерия
- •Углеводы
- •I. Моносахариды
- •3. Альдозы. Изомерия. Генетические ряды
- •4. Циклические формы моносахаридов. Таутомерия.
- •5. Кетозы
7. Фенолы
Фенолами называют производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, непосредственно связанных с бензольным кольцом.
Физические свойства. Большинство фенолов при комнатной температуре – кристаллические вещества. Они обладают характерным запахом, довольно плохо растворимы в холодной воде, но хорошо – в горячей.
Химические свойства. В фенолах неподеленная пара атома кислорода гидроксильной группы образует с ароматическим кольцом единую π-систему. Вследствие этого электронная плотность у атома кислорода уменьшается, а в бензольном кольце увеличивается. Полярность связи O—H повышается и атом водорода становится более подвижным. Кислотность фенола существенно выше, чем у предельных спиртов, он реагирует не только с ативными металлами, но и с щелочами:

 OH
ONa
OH
ONa



 +
NaOH
+ H2O
+
NaOH
+ H2O
фенол фенолят натрия
Реакции электрофильного замещения в феноле протекают значительно легче, чем в ароматических углеводородах вследствие донорного влияния гидроксильной группы. Так, при действии бромной воды на фенол без присутствия катализатора на бром замещаются сразу три атома водорода:
OH OH



 Br
Br
Br
Br

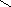
 +
3 Br2
+ 3 HBr
+
3 Br2
+ 3 HBr

Br
2,4,6-трибромфенол
При нагревании фенола с формальдегидом происходит реакция поликонденсации и образуется фенолформальдегидная смола – высокомолекулярное соединение с разветвленной структурой типа
OH OH OH












 . . .
− CH2
CH2
CH2
CH2
. . .
. . .
− CH2
CH2
CH2
CH2
. . .


CH2 CH2
| |
Способы получения.
Из галогенбензолов:
 Cl
ONa
Cl
ONa



p, t
 +
2 NaOH + NaCl + H2O
+
2 NaOH + NaCl + H2O
При обработке образовавшегося фенолята натрия кислотой получают фенол.
2. Из ароматических сульфокислот. Реакция проводится при сплавлении сульфокислот с щелочами. Первоначально образующиеся феноляты обрабатывают сильными кислотами для получения свободных фенолов. Этот метод обычно применяют для получения многоатомных фенолов.
SO3H ONa




 +
6 NaOH + 2 Na2SO3
+ 4 H2O
+
6 NaOH + 2 Na2SO3
+ 4 H2O
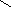

SO3H ONa
3. При каталитическом окислении изопропилбензола (кумола) кислородом воздуха образуются фенол и ацетон:
H3C−CH−CH3 OH



 H2SO4
H2SO4
 +
O2
+ CH3−C−CH3
+
O2
+ CH3−C−CH3
||
O
В настоящее время это основной промышленный способ производства фенола.

