
- •6. Хімічна кінетика
- •7. Хімічна рівновага
- •У посудині об’ємом 0,2 л помістили 0,3 г н2о та 0,8 г йоду. Після встановлення рівноваги в посудині одержано 0,7 г hi. Визначити константу рівноваги реакції.
- •У реакторі об’ємом 0,5 л відбувається реакція
- •8. Склад і приготування розчинів
- •100 Г розчину - 4,5 г NaOh;
- •220,5 Г розчину - х г NaOh;
- •9. Розчини неелектролітів
- •10. Розчини електролітів. Визначення pН розчинів. Добуток розчинності
При сталій температурі відбувається реакція 2NO2(г.) ↔ N2O4(г.), КС = 0,32. Розрахувати рівноважні концентрації всіх речовин, якщо вихідна кількість NO2 складала 1,15 моля, об’єм реактора дорівнює 5,75 л.
Визначити константу рівноваги реакції 4HCl(г.) + O2(г.)«2H2O(г.) + 2Cl2(г.), якщо вихідні кількості реагентів були 2,4 моля НСlта 1,2 моля О2, а в момент рівноваги приТ= соnstзалишилось 0,8 моля НСl, який не прореагував. Об’єм реактора 4 л.
Розрахувати константу рівноваги реакції N2(г.) + 3H2(г.) ↔ 2NH3(г.), якщо при деякій температурі у реактор об’ємом 10 л введено 0,05 моля N2та 0,52 моля Н2, а на момент рівноваги утворилось 0,04 моля амоніаку.
У реакторі об’ємом 0,5 л відбувається реакція
CН4(г.) + H2O(г.) ↔ CO(г.) + 3H2(г.). Визначити константу рівноваги, якщо в початковий момент було 0,05 моля CН4 та 0,04 моля H2O, а на момент рівноваги прореагувало 50 % вихідної кількості метану.
При деякій температурі відбувається реакція
СS2(г.) + О2(г.) ↔ 2SО2(г.) + СО2(г.). Розрахувати константу рівноваги та ви-хідні концентрації реагентів, якщо у стані рівноваги кількості речовин склали 0,5; 0,3 та 0,6 моля відповідно для СS2, О2 та СО2, а об’єм реактора 0,5 л.
У реактор об’ємом 11,42 л для проведення реакції 2SО2(г.) + О2(г.) ↔ 2SО3(г.) введені 2,43 моля SО2 та 2,17 моля О2. У момент рівноваги кількість SО2 зменшилася на 1,85 моля. Визначити константу рівноваги.
Враховуючи, що для реакції4HCl(г.) + O2(г.) « 2H2O(г.) + 2Cl2(г.) DН0реак таDS0реак не залежать від температури, знайти температуру, при якій константа рівноваги цієї реакції дорівнює одиниці.
Стандартна зміна енергії Гіббса для реакції A + 2B ↔ АВ при 298 К дорівнює 8 кДж/моль. Вихідні концентрації СА вих = СВ вих = 1 моль. Знайти константу рівноваги реакції та рівноважні концентрації всіх речовин.
Користуючись таблицями, визначити константи рівноваги наступних реакцій при 298 К та при 1000 К (залежністю DН0реак і DS0реак від температури нехтувати): 1) CO2(г.) + С(графіт) ↔ 2CO(г.); 2) CO(г.) + H2O(г.) ↔ CO2(г.) + H2(г.). В який бік буде зміщуватись рівновага в реакції (2) при збільшенні тиску у два рази?
У реакторі об’ємом 0,5 л відбувається реакція СН4(г.) + Н2О(г.) СО(г.) + 3Н2(г.). Визначити константу рівноваги, якщо в початковий момент було 0,1 моля СН4 та 0,2 моля Н2О, а на момент рівноваги прореагувало 60 % вихідної кількості метану.
8. Склад і приготування розчинів
Розчини – гомогенна термодинамічно стійка система змінного складу, яка містить два або більше компонентів, між якими можуть відбуватися фізична та хімічна взаємодії. Кількісний склад розчинів виражають концентрацією або часткою. Концентрація – це співвідношення неоднотипних величин. Вона має розмірність моль/л, г/л (об’ємні концентрації) або моль/г, моль/кг (масові концентрації). Відношення однотипних величин називається часткою. Частка – безрозмірна величина.
Використовують масові (i) і мольні (xi) частки, які знаходять за формулами:
i = mi/mi; xi = ni/ni;
молярні (СМ, моль/л, М), нормальні або еквівалентні (Сн, моль екв/л, н., N) і моляльні (Сm, моль/кг) концентрації, які розраховуються за формулами:
CM = ni/V; Cн = ni екв/V; Сm = 1000ni/m = 1000mі/Mim,
де ni – кількість молів розчиненої речовини, моль; ni екв – кількість молів еквівалентів розчиненої речовини, моль; V – об’єм розчину, л; mi i Mi – маса і молярна маса розчиненої речовини, г, г/моль; m – маса розчинника, г; 1000 – кількість в одному кілограмі.
Приклад 1. Розрахувати нормальнiсть, моляльнiсть, мольну частку та молярну концентрацiю 20%-го розчину HСl (r = 1,1 г/мл).
Розв’язання
1. Cн(HCl) - ? CM(HCl) - ?
Один літр 20%-го розчину має масу 1000∙1,1 = 1100 г, в ньому мiститься 1100·20/100 = 220 г HCl, або 220/36,5 = 6,03 моля HCl, тобто CM(HCl) = = 6,03 моль/л.
Cн(HCl) = CM(HCl), тому що молярна маса еквівалента й молярна маса для НСl збігаються.
2. Сm(HCl) - ?
На 80 г води припадає 20 г НCl, або 20/36,5 моль HCl, звідси моляльна концентрацiя розраховується згідно з формулою
Сm(HCl)
![]() 6,85 г/1000 г Н2О.
6,85 г/1000 г Н2О.
3. x(HCl) – ?
х(НСl)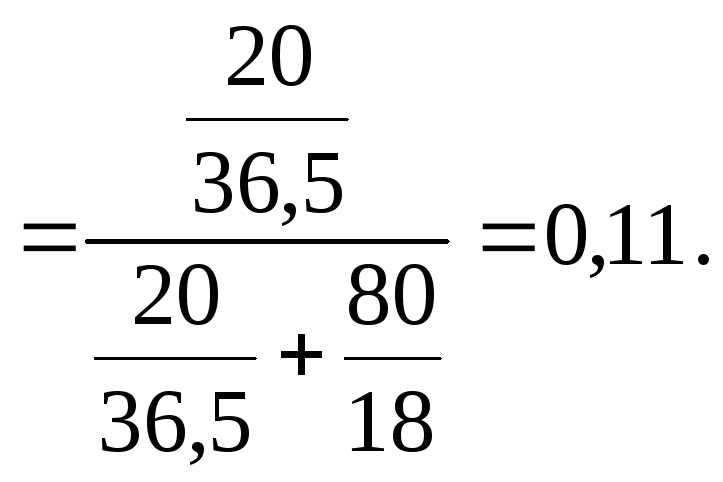
Відповідь: Cн(HCl) = 6,03 моль/л; CM(HCl) = 6,03 моль/л;
Сm(HCl) = 6,85 г/1000 г Н2О; x(HCl) = 0,11.
Приклад 2. Скiльки мiлiлiтрiв 12%-го розчину натрiй гідроксиду (r = 1,135 г/мл) потрiбно для приготування 210 мл 4,5%-го розчину NaOH (r = 1,05 г/мл)?
Розв’язання
1. m (210 мл розчину NaOH) - ?
m = Vr = 210 мл·1,05 г/мл = 220,5 г.
2. m (NaOH) у 220,5 г розчину - ?
