
- •Основные классы неорганических соединений
- •Классификация
- •Номенклатура
- •Получение
- •Химические свойства
- •Основания
- •Классификация.
- •Номенклатура.
- •Получение
- •Химические свойства
- •Кислоты
- •Классификация
- •Номенклатура
- •Получение
- •Химические свойства
- •Классификация
- •Номенклатура
- •Получение
- •Средние соли
- •Кислые соли
Получение
Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса. Соли бескислородных кислот, кроме того, могут быть получены при непосредственном взаимодействии металлов и неметаллов (Сl, S и т.д.).
Средние соли
Важнейшие способы получения средних солей в виде схемы представлены на рис. 1. Жирными линиями соединены классы неорг. веществ, представители которых, реагируя, образуют соли.
Не все эти способы применимы к каждой соли, например: соли бескислородных кислот нельзя получить, используя способы 3 и 5, а соли металлов, стоящих в ряду напряжений правее водорода нельзя получить, используя способ 2. И наоборот, существует множество способов получения отдельных солей, не включенных в этот перечень. Большинство способов получения солей основано на взаимодействии веществ с противоположными свойствами:
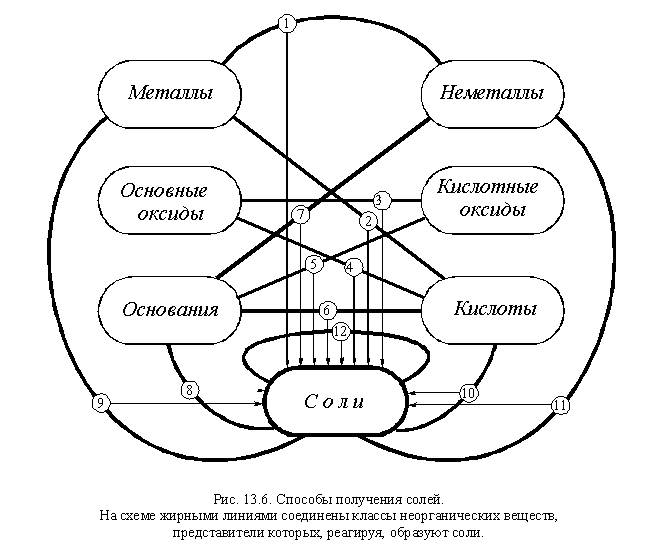
Рис.1. Способы получения средних солей.
Таким образом, соли можно получить 12 важнейшими способами:
1) при взаимодействии металлов с неметаллами:
2Na + Cl2 ® 2NaCl
2) при взаимодействии металлов с кислотами:
Zn + 2HCl ® ZnCl2 + H2
3) при взаимодействии основных оксидов с кислотными оксидами:
MgO + CO2 ® MgCO3
4) при взаимодействии основных оксидов с кислотами:
CuO
+ H2SO4
![]() CuSO4
+ H2O
CuSO4
+ H2O
5) при взаимодействии кислотных оксидов с основаниями:
Ba(OH)2 + CO2 ® BaCO3¯ + H2O
6) при взаимодействии оснований с кислотами:
Ca(OH)2 + 2HCl ® CaCl2 + 2H2O
7) при взаимодействии неметаллов с основаниями:
2KOHконц + Cl2 ® KClр-р + KClOр-р + H2O.
8) при взаимодействии оснований с солями:
Ba(OH)2 + Na2SO4 ® 2NaOH + BaSO4¯
9) при взаимодействии металлов с солями:
Fe + CuSO4 ® FeSO4 + Cu
10) при взаимодействии кислот с солями:
MgCO3 + 2HCl ® MgCl2 + H2O + CO2
BaCl2 + H2SO4 ® BaSO4¯ + 2HCl
11) при взаимодействии неметаллов с солями:
2K2SO3 + O2 ® 2K2SO4 (в растворе, медленно);
12) при взаимодействии солей друг с другом:
3CaCl2 + 2Na3PO4 ® Ca3(PO4)2¯ + 6NaCl
Кислые соли
1) взаимодействие кислоты с недостатком основания:
KOH + H2SO4 ® KHSO4 + H2O
2) взаимодействие основания с избытком кислотного оксида:
Ca(OH)2 + 2CO2 ® Ca(HCO3)2
3) взаимодействие средней соли с кислотой:
Ca3(PO4)2 + 4H3PO4 ® 3Ca(H2PO4)2
Основные соли
1) гидролиз солей, образованных слабым основанием и сильной кислотой
ZnCl2 + H2O ® Zn(OH)Cl + HCl
2) добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
AlCl3 + 2NaOH ® [Al(OH)2]Cl + 2NaCl
3) взаимодействие солей слабых кислот со средними солями
2MgCl2 + 2Na2CO3 + H2O ® [Mg(OH)]2CO3¯ + CO2 + 4NaCl
Химические свойства
Средние соли
1) растворимые соли могут реагировать с металлами:
2AgNO3 + Cu ® 2Ag + Cu(NO3)2
2) некоторые соли могут окисляться активными неметаллами:
2KI + Cl2 ® 2KCl + I2
3) растворимые соли могут реагировать с растворами щелочей:
Fe(NO3)3 + 3NaOH ® Fe(OH)3¯ + 3NaNO3
4) соли слабых кислот реагируют с сильными кислотами:
Na2SiO3 + 2HCl2 ® H2SiO3¯ + 2NaCl
5) в растворе соли могут реагировать между собой:
BaCl2 + Na2SO4 ® BaSO4¯ + 2NaCl,
AgNO3 + NaCl ®AgCl¯ + NaNO3
6) некоторые соли при нагревании легко разлагаются:
2KNO3
![]() 2KNO2
+ O2
,
2KNO2
+ O2
,
MgCO3
![]() MgO + CO2
,
MgO + CO2
,
7) соли, имеющие в своём составе катион слабого основания или анион слабой кислоты, подвергаются гидролизу:
Al2S3
+ 6H2O
![]() 2Al(OH)3¯
+ 3H2S
2Al(OH)3¯
+ 3H2S
FeCl3
+ H2O
![]() Fe(OH)Cl2
+ HCl
Fe(OH)Cl2
+ HCl
Na2S
+ H2O
![]() NaHS
+NaOH
NaHS
+NaOH
8) некоторые соли вступают в окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона.
2KMnO4 + 16HCl ® 2MnCl2 + 2KCl + 5Cl2 + 8H2O
Кислые соли
1) термическое разложение с образованием средней соли:
Ca(HCO3)2 ® CaCO3¯ + CO2 + H2O
2) взаимодействие со щёлочью (образование средней соли):
Ba(HCO3)2 + Ba(OH)2 ® 2BaCO3¯ + 2H2O
Основные соли
1) термическое разложение:
[Cu(OH)]2CO3(малахит) ® 2CuO + CO2 + H2O
2) взаимодействие с кислотой (образование средней соли):
Sn(OH)Cl + HCl
![]() SnCl2
+ H2O
SnCl2
+ H2O
Генетическая связь
между различными классами соединений
|
|

