
PC1E2010
.RTF
ФАЗОВОЕ РАВНОВЕСИЕ В ДВУХКОМПОНЕНТНЫХ СИСТЕМАХ
-
Идеальные растворы. Законы Рауля и Дальтона. Взаимосвязь составов паровой и жидкой фаз, диаграмма кипения для идеального раствора.
-
Запишите уравнение, выражающее правило рычага. Назовите входящие в это уравнение величины. Рассмотрите применение правила рычага на примере диаграммы кипения «температура – состав» (P=const) для двухкомпонентной системы без азеотропа (диаграмму выберите в справочнике). Покажите на диаграмме, до какой температуры следует нагреть жидкую систему произвольного состава х0, чтобы количества равновесных жидкой и паровой фаз были одинаковы?
-
Анализ диаграмм “давление-состав”, “температура-состав” и “состав пара-состав жидкости” для систем, не образующих азеотроп.
-
Равновесие “жидкость-пар” в двухкомпонентных системах. Диаграммы “давление-состав”, “температура-состав”, “состав пара-состав жидкости” для систем с положительными отклонениями от закона Рауля.
-
Диаграмма состояния двухкомпонентной системы
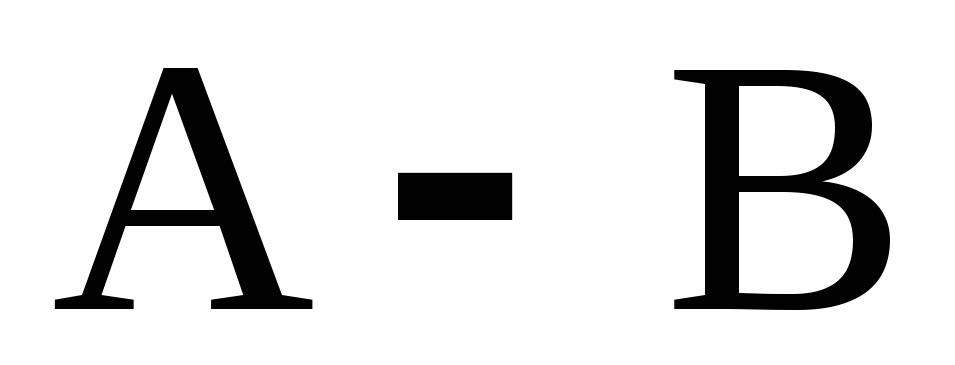 характеризуется минимумом на кривой
«температура-состав». Компонент
характеризуется минимумом на кривой
«температура-состав». Компонент
 является менее летучим, чем вещество
является менее летучим, чем вещество
 .
Укажите составы дистиллята и кубового
остатка при ректификации жидкой смеси,
с большим содержанием компонента
.
Укажите составы дистиллята и кубового
остатка при ректификации жидкой смеси,
с большим содержанием компонента
 по сравнению с азеотропной смесью.
по сравнению с азеотропной смесью.
-
Анализ диаграмм кипения “давление-состав” “температура-состав” и “состав пара-состав жидкости” для систем, образующих азеотроп.
-
Приведите диаграммы фазового равновесия

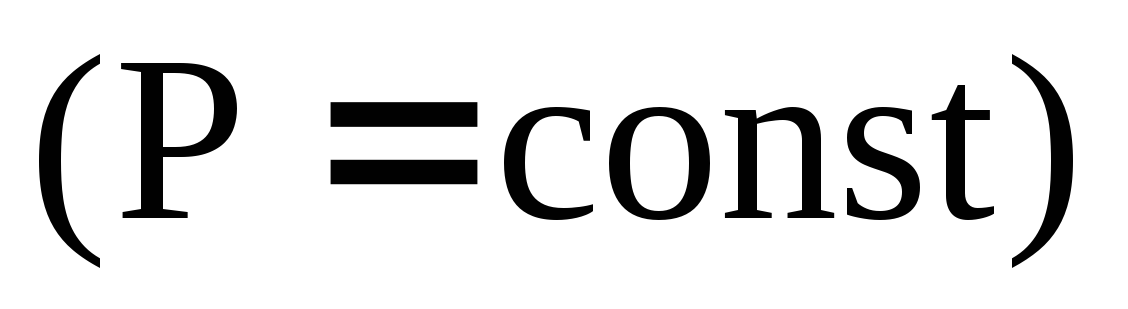 и
и
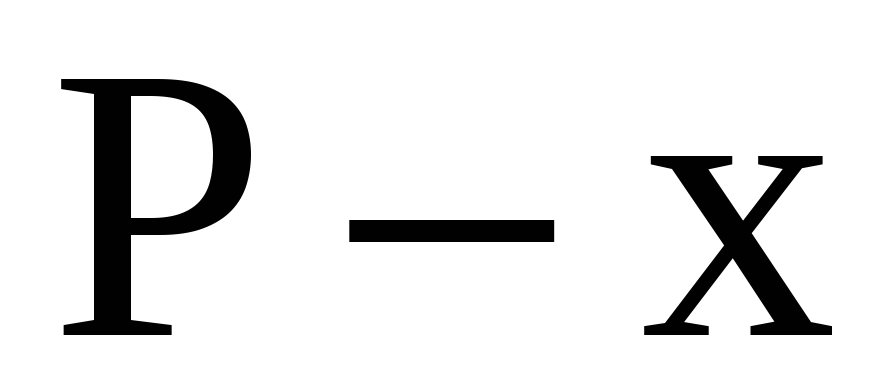
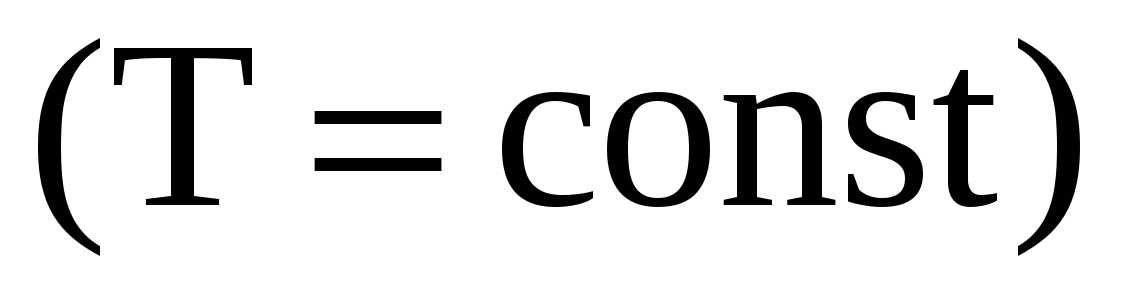 для системы
для системы
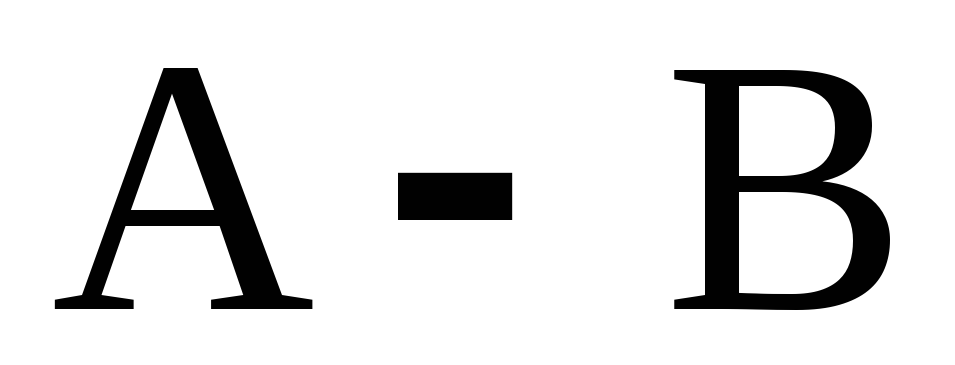 с высококипящим азеотропом. Изобразите
схематически (с помощью системы стрелок)
изменение фазового состава системы
при переходе из парообразного состояния
в жидкое для двух композиций, одна из
которых отвечает составу азеотропа, а
другая располагается слева от него.
Укажите температуры начала и окончания
фазовых превращений, составы 1-го
пузырька пара.
с высококипящим азеотропом. Изобразите
схематически (с помощью системы стрелок)
изменение фазового состава системы
при переходе из парообразного состояния
в жидкое для двух композиций, одна из
которых отвечает составу азеотропа, а
другая располагается слева от него.
Укажите температуры начала и окончания
фазовых превращений, составы 1-го
пузырька пара.
-
Изобразите схематически диаграмму кипения «температура – состав» (
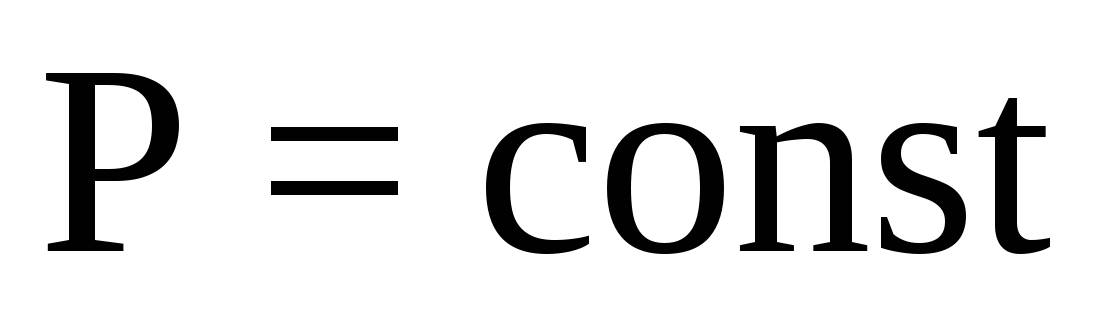 )
двухкомпонентной системы с азеотропом
и отрицательными (вариант:
«положительными»)отклонениями от
идеальности. Дайте краткую характеристику
диаграммы (назовите фазовые поля, линии,
характерные точки). Постройте график
зависимости равновесного состава пара
от состава жидкости для легколетучего
компонента.
)
двухкомпонентной системы с азеотропом
и отрицательными (вариант:
«положительными»)отклонениями от
идеальности. Дайте краткую характеристику
диаграммы (назовите фазовые поля, линии,
характерные точки). Постройте график
зависимости равновесного состава пара
от состава жидкости для легколетучего
компонента. -
Основы разделения жидких бинарных смесей перегонкой и ректификацией. Коэффициент разделения. Возможно ли двухкомпонентную систему, характеризующуюся наличием азеотропа (состав не совпадает с азеотропным), разделить на чистые компоненты? Приведите пояснение.
-
Анализ диаграммы кипения бинарных смесей с экстремумом на кривой
 .
Азеотропные смеси и возможности их
разделения на чистые компоненты.
.
Азеотропные смеси и возможности их
разделения на чистые компоненты. -
Изобразите диаграмму фазового равновесия
 для бинарной системы
для бинарной системы
 с
высококипящим азеотропом. Дайте краткую
характеристику диаграммы (фазовых
полей, линий, характерных точек). Какие
продукты окажутся в дистилляте и кубовом
остатке при ректификации жидкой системы,
более богатой компонентом
с
высококипящим азеотропом. Дайте краткую
характеристику диаграммы (фазовых
полей, линий, характерных точек). Какие
продукты окажутся в дистилляте и кубовом
остатке при ректификации жидкой системы,
более богатой компонентом
 по сравнению с азеотропной смесью.
по сравнению с азеотропной смесью. -
Для приведённой в справочнике диаграммы кипения системы (дана ссылка на диаграмму) опишите фазовые превращения при изобарном нагревании от t = … до t = … двух растворов с концентрациями … и … мольн.%, укажите температуры начала и окончания фазовых превращений. На какие составные части может быть разделена система состава …. мольн.% в результате процесса ректификации?
-
Равновесие “жидкость – пар” в двухкомпонентных системах с полной взаимной растворимостью в жидкой фазе. Законы Гиббса-Коновалова. Азеотропные смеси.
-
Законы Гиббса-Коновалова. Разделение жидких смесей перегонкой и ректификацией.
-
Диаграммы кипения бинарных систем с полной взаимной растворимостью компонентов. Законы Гиббса-Коновалова. Применение правила фаз к исследованию диаграмм кипения.
-
Равновесие “жидкость – пар” в системах двух несмешивающихся жидкостей. Зависимость общего давления и состава пара от состава жидкой фазы. Перегонка с водяным паром. Расходный коэффициент водяного пара.
-
Системы практически несмешивающихся друг с другом жидкостей. Связь общего давления и состава паровой фазы с давлениями компонентов системы. Температура кипения раствора. Перегонка с водяным паром. Расходный коэффициент водяного пара.
-
Ограниченная растворимость компонентов в жидком состоянии. Диаграмма с верхней критической температурой растворения, анализ диаграммы. Определение состава критической точки полного смешения компонентов. Правило Алексеева.
-
Ограниченная взаимная растворимость жидкостей. Диаграмма «температура – состав» при
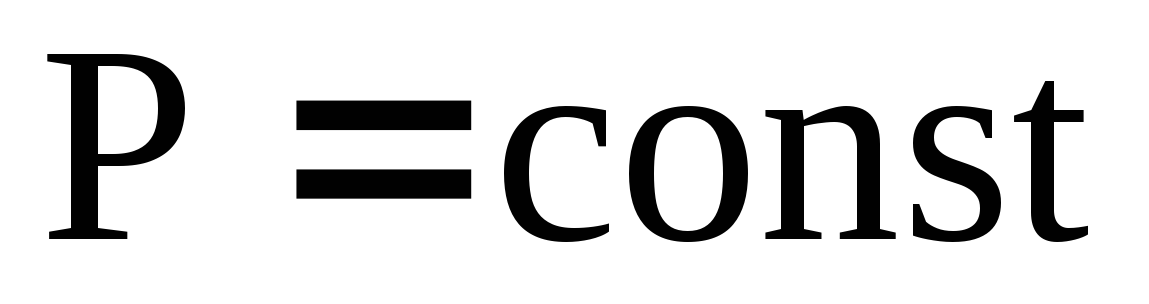 для системы с верхней критической
температурой растворения. Влияние
температуры на взаимную растворимость
жидкостей. Применение правила рычага.
для системы с верхней критической
температурой растворения. Влияние
температуры на взаимную растворимость
жидкостей. Применение правила рычага.
12
