
Тиоцианаты(Роданиды)
Получение: Осн. методы получения HNCS-взаимод. RNCS с KHSO4 или ионный обмен водных р-ров NH4NCS. Родан (тиоциан) обычно получают по р-циям:
Cu(SCN)2 : CuSCN + 0,5(SCN)2 Hg(SCN)2 + Вr2 : HgBr2 + (SCN)2
Тиоцианаты щелочных металлов и аммония получают при улавливании цианистых соед., содержащихся в коксовом газе, р-рами соответствующих полисульфидов. Кроме того, NH4NCS получают взаимод. NH3 с CS2, a KNCS и NaNCS-сплавлением KCN или NaCN с серой. Другие тиоцианаты синтезируют обменной р-цией сульфатов, нитратов или галогенидов металлов с тиоцианатами бария, К или Na, взаимод. гидроксидов или карбонатов металлов с HNCS.
Физические и химические свойства- Тиоциановая к-та (роданисто-водородная к-та) HNCS - желтоватая жидкость с т. пл. -110°С; длины связей (нм) 0,09887 (H—), 0,21164 (N—С) и 0,15605 (С—S), угол HNC 134,98°. В водных р-рах (устойчивы при концентрации HNCS менее 5%) сильно диссоциирована (рКа 0,85 при 18 °С), в конц. р-рах разлагается с образованием т. наз. ксантенового водорода (ф-ла I) и др. продуктов:
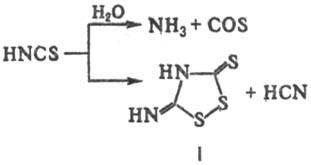
Наиб. характерные р-ции-окисление, восстановление, га-логенирование, а также обменные р-ции с др. тиоцианатами, напр.:
NH4NCS + О2 + Н2O : NH4HSO4 + HCN
KNCS + Fe : KCN + FeS
NaNCS + Zn + HC1 : CH3NH2 · HC1 + NaCl + ZnCl2
KNCS + Br2 + H2O : BrCN + K2SO4 + HBr
2KNCS + Pb(NO3)2 : Pb(SCN)2 + 2KNO3
Тиоцианаты образуют комплексные соед., в к-рых.металл в зависимости от донорно-акцепторных св-в лиганда может координироваться как по атому N, так и по атому S. Тиоцианаты щелочных металлов и аммония разлагаются при натр., напр.:
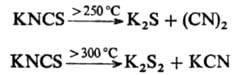
Термич. изомеризация NH4NCS положена в основу пром. получения тиомочевины:
![]()
Применение: Тиоцианаты используют в произ-ве тиомочевины, в качестве реагентов при крашении и печатании тканей, компонентов проявителей в фотографии, аналит. реагентов в роданометрии и меркуриметрии, для приготовления прядильных р-ров в произ-ве акриловых волокон, для получения орг. тиоциа-натов, как стабилизаторы горения в произ-ве ВВ, инсектициды и фунгициды. Тиоцианатные комплексы используют в фотометрич. анализе для определения Со, Fe, Bi, Mo, W, Re, в технологии редких металлов для разделения Zr и Hf, Th и Ti, Ga и Аl, Та и Nb, Th и La, для получения спектрально чистого La. Тиоцианаты Nb(V) и Ta(V)-катализаторы р-ции Фриделя - Крафтса. См. также Аммония тио-цианат, Натрия тиоцианат.
Литература
-
Brotherton Т. К., Lynn J. W., The synthesis and chemistry of cyanogen, «Chemical reviews», 1959
-
Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994.
-
Бобков С.С.,Смирнов С.К.,Синильная кислота,М.,!970 г
-
Смирнов С.К.,Химия Псевдогалагенидов,К.,1981г
-
Соловьев С.Н.,Начало химии .Химия элементов и их соединений(часть 1),М.,2011г
