
- •Основы молекулярной физики
- •Архангельск
- •Рассмотрены и рекомендованы к изданию
- •Рекомендации по решению задач расчетно-контрольных заданий
- •Уравнение состояния идеального газа.
- •Основное уравнение молекулярно-кинетической теории газов.
- •Распределение молекул по скоростям и энергиям.
- •Скорость молекул газа.
- •Барометрическая формула. Распределение Больцмана.
- •Основные законы термодинамики.
- •Соотношение между ними определяется уравнением Майера:
- •Адиабатный процесс.
- •Первое начало термодинамики.
- •Второе начало термодинамики.
- •Явления переноса.
- •Поверхностное натяжение. Капиллярные явления.
- •Примеры решения задач
- •Подставив в эту формулу числовые значения величин, найдем
- •Произведя вычисления по этой формуле, найдем
- •Сделав подстановку значений величин, получим
- •После вычисления по формуле (4) найдем
- •Задачи расчетно-контрольных заданий
- •1. Уравнение состояния идеального газа.
- •4. Распределения Максвелла
- •11. Поверхностное натяжение.Капиллярные явления.
Явления переноса.
В молекулярно-кинетической теории выделяют три явления переноса:
- перенос массы – диффузия;
- перенос импульса – внутреннее трение;
- перенос энергии – теплопроводность.
Все явления описываются эмпирическими законами (для одномерного случая):
- диффузия – законом Фика:
![]()
где M– масса диффундирующей компоненты,переносимой через площадьS за времяt;n– концентрация компоненты; nx – градиент концентрации компоненты; m0 – масса молекулы; D – коэффициент диффузии,для газов, определяемый уравнением:
![]()
где l-cредняя длина свободного пробега,расстояние,которое проходит молекула между двумя последовательными столкновениями;v- средняя арифметическая скорость молекул:
![]()
где d - эффективный диаметр молекулы;n– концентрация молекул;
- внутреннее трение (вязкость) – законом Ньютона:

г
![]()
где - плотность газа;S – площадь элемента поверхности взаимодействия слоев; vx – градиент (поперечный) скорости течения слоев жидкости или газа;
Распределение скорости потока по сечению канала показано на рис.3, направление градиента скорости и потока импульса по сечению канала на рис. 4.


![]()






Рис.
3.
- теплопроводность – законом Фурье:
![]()
где S –поверхность,через которую переносится теплотаQ за время t;- коэффициент теплопроводности,определяемый по формуле (для газов):
![]()
где Tx – градиент температуры (направление потока теплоты совпадает с направлением падения температуры чтобы уменьшить существующий градиент температуры, рис. 5); сv– удельная теплоемкость при постоянном объеме; -плотность газа .




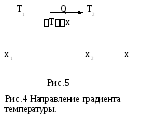
T2T1
Газ Ван-дер-Ваальса.
Уравнением Клапейрона-Менделееваявляется пригодным только для расчетов состояния только идеального газа. Усовершенствованным уравнением состояния газа можно считать уравнениеВан-дер-Ваальса, которое учитывает конечные размеры молекул и силы взаимодействия между ними ( изотермы идеального(1) и реального (2) газов показаны на рис.6). Сразу необходимо отметить,что и оно является приближенным,т.к. не существует способа точного вычисления сил взаимодействия между молекулами.
Уравнение Ван-дер-Ваальса имеет следующий вид:
- для одного моля газа
![]()
- для произвольного количества вещества
![]()
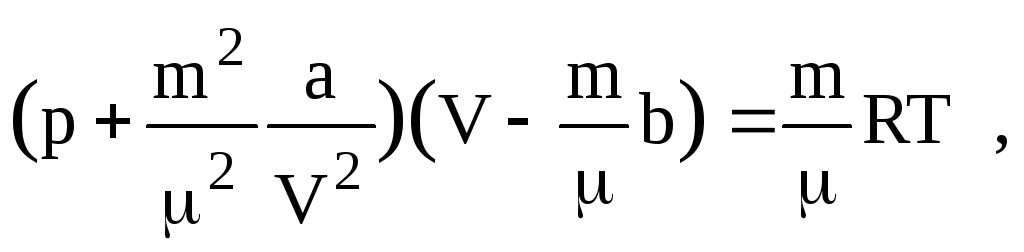
где, аV2 – поправочный член,учитывающий притяжение между молекулами;b– поправка,учитывающая размеры молекул и в неявном виде силы отталкивания между ними.
Анализ уравнения Ван-дер-Ваальса позволяет установить связь между параметрами критического состояния:объемом,давлением и температурой. Критическим называется состояние, при котором не существует механической разницы между жидким и газообразным состоянием вещества (на рис.6. – точка К). Связь между критическими параметрами, с учетом поправок а и bВан-дер-Ваальса имеет следующий вид:
- критический обьем одного моля газа Vкр=3b;
- критическое давление ркр= а(27b2);
- критическая температура Tкр= 8а(27Rb).
Р

*
V Рис.5.
Изотермы идеального (1) и газа
Ван-дер-Ваальса (2).
V
