
- •1 Колебательные движения.
- •2 Физический и математический маятники.
- •3 Сложение гармонических колебаний одинаково направленных и одной частоты.
- •4 Сложение взаимноперпенд. Колебаний одинаковой частоты.
- •5Свободные не затухающие колебания в эл. Колебательном контуре.
- •6 Затухающие мех. Колебания. Диф ур. Движения и его решение. График
- •7 Свободные затухающие колебания в эл. Колеб. Контуре. Диф. Ур. Расчет периода колебаний.
- •8 Вынужденные мех. Колебания. Диф. Уравнения движения и его решение. График колебаний.
- •9 Вынужденные колебания в эл. Магнитном контуре. Диф. Уравнение колебаний и его решение.
- •10Волновые процессы. Продольные и поперечные волны. Ур. Бегущей волны.
- •11Электормагнитные волны. Скорость распр. Энергия эмв
- •12 Интерференция света. Условия образования max и min.
- •13 Интерференция света от плоскопараллельной пленки. Кольца Ньютона.
- •14 Дифракция света. Принцип Гюйгенса-Фринеля. Метод зон Фринеля. Дифракция Фринеля на круглом отверстии и на диске.
- •15 Дифракция Фраунгофера на одной щели. Дифракционная решетка.
- •16 Поляризация света. Способы получения поляризованного света. Закон Малюса
- •17 Закон Брюстера. Эффект двойного лучепреломления.
- •18 Поляризационные призмы и поляроиды. Дихроизм. Вращение плоскости поляризации в оптически активных средах.
- •19 Закон теплового излучения (Киргофа, Стефана-Больцмана, Вина) формула Планка.
- •20 Внешний фотоэффект. Уравнение Энштейна для внешнего фотоэффекта.
- •21 Давление света. Эффект Комптона.
- •22 Модели атома Томпсона Резерфорда. Постулаты Бора. Классическая теория атома водорода и водородоподобных атомов
- •23Корпускулярно-волновой дуализм св-в веществ. Волны де-Бройля. Соотношение неопред. Гейзенберга
- •25 Атом в квантовой механике квантовые числа.
- •26Поглощение света, спонтанное и вынужденное излучение. Оптические квантовые генераторы (лазеры).
- •27 Металлы, полупроводники и диэлектрики с точки зрения зонной теории.
- •28 Собственная и приместная проводимость проводников.
- •29 Контакт электронного и дырчатого проводников полупров., диоды.
- •30 Строение атома ядра и энергия связи и дефект массы ядра. Закон распада.
- •31 Ядерные реакции. Деление тяжелых ядер. Цепная реакция деления. Понятие о ядерной энергетике
- •33 Элементарные частицы.
21 Давление света. Эффект Комптона.
Если
фотоны обладают импульсом, то свет
падающий на тело должен оказывать на
него давление ![]()
Фе – световой поток падающий на поверхность.
𝜌 – коэф-т отражения, с – скорость света
Если поверхность черная 𝜌=0, 𝜌=1 – зеркальная.
Эффект Камптона При падении света происходит рассеивание на свободных электронах, при этом электрон получает от падающих фотонов часть энергии и приходит в движение. Энергия отраженных фотонов становится меньше. В экспериментах наблюдается увеличение длины волны отраженного света по сравнению с падающим.
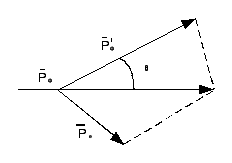
Выполняются закон сохранения энергии и импульса.
![]()
θ – угол рассеивания.\
![]()
![]()
22 Модели атома Томпсона Резерфорда. Постулаты Бора. Классическая теория атома водорода и водородоподобных атомов
Томсон – предположил, атом непрерывно заряженный «+» зарядом шар в который вкраплены электроны. Гормон. колебания электронов около положения равновесия явл. причиной излучения монохроматических волн атомами.
Резерфорд – планетарная модель атома
в центре ядро с «+» зарядом Ze и m практич. = ma, вокруг ядра по орбитам двигаются электроны образуя электрон. оболочку атома.
Недостатки:
1 движущийся вокруг ядра электрон может упасть на ядро
2 Электрон падая на ядро непрерывно излучает энергию т.е. спектр излучения сплошной, в действительности спектры линейны. Противоречия были устранены бором который сформулировал 2 постулата:
1 Существует стационарное состояние наход. в котором атом энергию не теряет
2 Поглощение или излучение происходит при переходе из одного стационарного состояния в другое
![]() 𝜗
– частота излучения, сооствет. переходу
атома из одного сост. в другое.
𝜗
– частота излучения, сооствет. переходу
атома из одного сост. в другое.
![]() – значение энергии стационарных
состояний атома.
– значение энергии стационарных
состояний атома.
Водород и водородоподобные системы.
![]() -
обобщенная формула Бальмера для атома
водорода.
-
обобщенная формула Бальмера для атома
водорода.
R – постоянная Рудберга.
𝜗 – частота перехода электрона с одной стационарной орбиты на другую.
к=1 – серия Лаймана. к=2 – Больцмана, к=3 - Тамена, к=4 – Брекита … n=k+1
Частота
излучения водородоподобных ионов сост.
из одного ядра и одного электрона: ![]() ,
2 –порядковый номер электрона в таблице
менделеева.
,
2 –порядковый номер электрона в таблице
менделеева.
Энергия ионизации атома водорода(водородоподобного иона) –Еmin которую необходимо затратить чтобы удалить электрон из атома.
23Корпускулярно-волновой дуализм св-в веществ. Волны де-Бройля. Соотношение неопред. Гейзенберга
Электроны и другие частицы материи наряду с корпускулярными обладают волновыми св-вами (корпускулы –св-ва частицы). Каждому объекту присущи корпускул. хар-ки – энергия, импульс, и волновые хар-ки частота и длина волны.
Соотношение
между хар-ками частиц также как и для
фотонов ![]() Любой частице, обладающей импульсом
(Р) сопоставляется волновой процесс с
длиной волны опред. по формуле де Бройля
Любой частице, обладающей импульсом
(Р) сопоставляется волновой процесс с
длиной волны опред. по формуле де Бройля
![]() ,
полная энергия частицы :
,
полная энергия частицы :![]()
Т.о. копускулярно-волновой дуализм – универсальное св-во материи
25 Атом в квантовой механике квантовые числа.
Состояние электрона в атоме описывает волновая функция Ψ удовлетворяющая стационарному уравнению Шреденгера
![]()
Главное квантовое число n определяет энергетические уровни электрона в атоме
n=1. 2. 3 …
l – орбитальное квантовое число которое при заданном n принемает значение l=0.1…(n-1)
Mл – магнитное квантовое число, которое при заданном l может принемать значение m1=0, ±1; ±2;…±l
Квантовые числа n и l хар-ют размер и форму электр. облика, а квант. число не хар-ет ориентации электронного облака в пространстве.
Ученые предположили что электрон обладает собственным механическим моментом импульса не связан с движением электрона в пространстве –спином.
Спин электрона – внутреннее неотъмлимое св-во электрона подобное его заряду и массе.
Принцип Паули.
В системе одинаковых ферлионов любые два из них не могут одновременно находиться в одном и том же состоянии.
Состояние электрона в атоме однозначно определяется набором четырех квантовых чисел: главного(n), орбитального (l), магнитного m1 и магнитного ажепвого ms
распределение электронов в атоме подчиняется принципу Паули: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел.
