
Organicheskaia_khimiia
.pdfщению безводного сульфата меди (ІІ) СuSО4 белого цвета в гидрат СuSО4 ·5 Н2О голубого цвета.
Азот в органическом веществе определяют путем сплавления азотсодержащего вещества (например, мочевины, анилина, ацетамида и др.) с металлическим натрием, вследствие этого происходит разложение вещества с образованием цианида натрия. Для обнаружения цианида натрия используют реакцию получения берлинской лазури.
Серу в органическом веществе определяют сплавлением
вещества (например, тиомочевины, сульфаниловой кислоты, белого стрептоцида, сухого белка и т. д.) с металлическим натрием, вследствие этого происходит образование сульфида натрия. Наличие сульфид-иона S2– обнаруживают качественными реакциями.
щениямиÏолесÃÓвеществ, или их разрушением.
Галогены в органическом веществе определяют по мето-
ду Бейльштейна или по методу Степанова.
Для получения полной информации о составе и строении
органических веществ наряду |
кла |
иче кими химическими |
методами анализа прим няют |
и |
пециальные – физико- |
химические методы иссл дования. Эти методы позволяют быстро, а г авное, с бо ьшой точностью установить самые тонкие особенности в строении органических соединений. Преимущества этих методов очевидны, с их помощью получают инф рмацию взаимном расположении атомов в молекуле и б их взаим действии; химические методы такой пол-
ной инф рмации не дают, так как они связаны или с превра-
Важнейшими из физико-химических методов являются: оптическая спектроскопия (в ультрафиолетовой, видимой и инфракрасной областях), ядерный магнитный резонанс (ЯМР), хроматография, масс-спектрометрия, рентгеноструктурный анализ.
Опыт 1. Определение углерода и водорода окислением вещества окисью меди
31
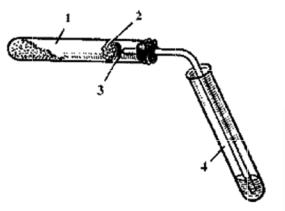
Для проведения опыта в пробирку 1 ( рис. 1) насыпают около 1 г порошка оксида меди (ІІ) и 0,2-0,3 г сахарозы (С12Н22О11). Оксид меди необходимо взять в избытке для того, чтобы сахароза б ыла полностью окислена.
В верхню ю часть пробирки помещают небольш ой комочек ваты, на который насыпают немного обезвоженного сульф ата меди (ІІ). П робирку 1 закрывают пробкой с газоотводно й трубкой, конец которой должен почти упираться в ва-
ту с |
сульфатом меди (ІІ). Свободный конец газоотводной |
трубки поме щают в пробирку 4 с известковой водой. |
|
|
ÏолесÃÓ |
Осторожно прогревают всю пробирку и фиксируют ре- |
|
зультаты опыта. |
|
Р исунок 1 – Прибор д я определения качественного |
|
|
элементн го с става органических соединений |
1 |
– смесь рганическ го вещества с оксидом меди (II); |
2 |
– вата; |
3 |
– безводный сульфат меди (II); |
4 |
– прием ная пробирка с известковой водой. |
Вопросы и задания
1. Запишите схему реакции окисления сахарозы оксидом меди (II). Назовите п лученные вещества.
2. Почему для окисления веществ, содержащих углерод и водород, в качестве окислителя используется CuO, а не оксид другого металла?
32
3. Что происходит с известковой водой? О содержании какого элемента в исследуемом веществе это свидетельствует? Напишите уравнение реакции.
4. Почему при продолжительном пропускании оксида углерода (IV) через известковую воду образовавшийся осадок растворяется? Напишите уравнение реакции.
4. Почему изменяется цвет сульфата меди? О содержании какого элемента в исследуемом веществе это свидетельствует? Напишите уравнение реакции.
5. Сделайте вывод об открытии углерода и водорода в органическихÏолесÃÓсоединениях.
Опыт 2. Открытие азота в органическом веществе сплавлением вещества с металлическим натрием
В сухую пробирку вносят несколько кристаллов мочевины (H2N–CO–NH2) и, наклонив пробирку горизонтально, небольшой кусочек металличе кого натрия, предварительно очищенного и высуш нного фильтровальной бумагой. Держа пробирку горизонтально, нагр вают натрий до его расплавления, а затем пробирку поворачивают вертикально, чтобы капля разогретого натрия упала на мочевину. Происходит вспышка, и в резу ьтате химической реакции образуется цианид натрия (NaCN). Пос вспышки пробирку нагревают еще 1-2 мин.
П сле хлаждения пробирки на воздухе в нее добавляют 3-5 капель этил в го спирта для удаления остатков металлического натрия.
Затем в пробирку приливают 1,5 мл дистиллированной воды и нагревают ее до полного растворения сплава при помешивании стеклянной палочкой.
На этом этапе цианид натрия переходит в раствор, который затем переливают в другую пробирку, фильтруя через маленький складчатый фильтр. Если органическое вещество разложилось частично, то жидкость будет окрашена в бурый цвет. В этом случае плавление исследуемого вещества с металлическим натрием необходимо повторить.
33
Вотдельной пробирке делают пробу на наличие щёлочи
вфильтрате. В пробирку помещаем 2 капли отфильтрованного раствора, добавляя к нему каплю спиртового раствора фенолфталеина. Если щёлочь присутствует, то наблюдается ма- линово-красное окрашивание.
К фильтрату добавляют 2-3 капли 5 % раствора сульфата железа (ІІ) и 1 каплю 1 % раствора хлорида железа (ІІІ).
Вслучае избытка цианида натрия в растворе будет обра-
зовываться гексацианоферрат (ІІ) натрия Na4[Fe(CN)6]:
Fe(OH) + 6NaCNизб = Na [Fe(CN) ] + 2NaOH
ПослеÏолесÃÓперемешивания2 содержимого4 пробирки6 его подкисляют 10 % соляной кислотой (5 капель).
Берлинская лазурь образуется при взаимодействии гексацианоферрата (ІІ) натрия с хлоридом трехвалентного железа, который появляется только в кислой среде:
3Na4[Fe(CN)6] + 4FeCl3 = Fe4[Fe(CN)6]3 + 12NaCl
Вщелочной среде обычно одержит я недиссоциированный гидроксид железа (ІІІ). Н обходимо отметить, что, если берлинской лазури образу тся оч нь мало, то раствор окрашивается в зеленый цв т, п р ходящий в синий при длительном стоянии.
Вопросы и задания
1. Какие пр дукты бразуются при сплавлении мочевины с металлическим натрием? Составьте схему реакции.
2. Выразите химическим уравнением процесс образования этилата натрия.
3. Выразите химическим уравнением процесс образования гидроксида натрия.
4. Запишите схемы реакций, происходящих на этапе эксперимента сульфатом железа (ІІ) и хлоридом железа (ІІІ).
5. Что происходит со смесью осадков гидроксидов железа (II) и (III)? Какое образуется соединение? По каким при-
знакам вы это поняли?
6. Сделайте вывод об открытии азота в органических соединениях.
34
Опыт 3. Открытие серы в органическом веществе сплавлением вещества с металлическим натрием
Принцип этого способа состоит в том, что при сплавлении металлического натрия с изучаемым органическим веществом происходит его разложение, и выделяющаяся сера образует с натрием соответствующий сульфид:
H2N–CS–NH2 + Na → Na2S + …
Далее сульфид-ион S2– обнаруживают обычными качественными реакциями.
Всухую пробирку помещают несколько крупинок тиомочевиныÏолесÃÓ(или сульфаниловой кислоты, белого стрептоцида, сухого белка т. д.) и небольшой кусочек металлического натрия. Далее проводят сплавление (тяга, защитные очки) так, как было описано в опыте 2 (определение азота).
Полученный раствор, содержащий сульфид натрия, разливают в три пробирки.
Впервую пробирку добавляют не колько капель 10 % уксусной кислоты, а зат м приливают 0,5 мл 2 % раствора ацетата свинца. Если образу т я коллоидный раствор, то его нагревают. Появление чёрного осадка, указывает на то, что исследуемое вещество сод ржало с ру.
Во вторую пробирку приливают 0,5 мл 2 % раствора
нитр пруссида натрия Na2[Fe(CN)5NO]. Наблюдается изменение краски с же т й на красно-фиолетовое окрашивание раств ра, к т р е п степенно переходит в бурое. Эта реакция значительно чувствительнее реакции с ацетатом свинца.
Na2S + Na2[Fe(CN)5NO] = Na4[Fe(CN)5NOS]
Втретью пробирку раствором добавляют 10 % соляную кислоту. Обратите внимание на запах выделяющегося газа.
Вопросы и задания
1. Составьте схему реакции между тиомочевиной и металлическим натрием.
2.На что указывает реакция с нитропруссидом натрия?
3.Какой газ выделялся в третьей пробирке? На наличие какого элемента в исследуемом соединении он указывает?
35
4.Составьте схемы реакций отражающих процессы происходящие в первой, второй и третьей пробирках.
5.Сделайте вывод по данному опыту.
Опыт 4. Определение галогенов в органических веществах. Реакция Бейльштейна на галогены
Для опыта необходимо взять медную проволоку (толщи- на1-2 мм) с петлей на конце. Конец проволоки прокаливают в бесцветном пламени горелки до прекращения окрашивания пламени и образования на поверхности черного налета. ОстывшейÏолесÃÓна воздухе петлей набирают несколько крупинок йодоформа или смачивают хлороформом, а затем снова вносят в пламя газовой горелки. Обратите внимание на цвет пламени, оно зелёное.
Для очистки проволоки, её смачивают соляной кислотой и прокаливают.
Вопросы и задания
1. Запишите уравн ние р акции образования оксида меди
(II).
2. Запишите схему р акции взаимодействия хлороформа (йодоформа) с оксидом м ди (II). Какое образовалось соединение?
3. Сделайте выв д б ткрытии галогенов в составе органических веществ по мет ду Бей ьштейна.
Опыт 5. Определение галогенов действием металлического натрия на спиртовой раствор органического вещества по методу Степанова
Чтобы определить галоген в органическом веществе методом Степанова, его восстанавливают в момент выделения водородом. Галоген отщепляется в виде аниона, и открыть его можно помощью качественной реакции с нитратом серебра. Необходимо помнить, что при выполнении опыта нельзя брать избыток йодоформа, так как йодоформ, не прореагировавший с водородом, при разбавлении реакционной смеси водой даёт стойкую белую эмульсию, которая в даль-
36
нейшем будет маскировать появление йодида серебра при проведении качественной реакции с нитратом серебра.
В пробирку наливают 2 мл этилового спирта и добавляют несколько крупинок йодоформа или другого галогенсодержащего органического вещества (тетрахлорид углерода, хлороформ и др.) В полученную смесь вносят небольшой кусочек металлического натрия. Начинается энергичная реакция. Сначала происходит взаимодействие между этиловым спиртом и металлическим натрием, в результате выделяется водород. Определить его можно, если поднести горящую лучину к отверстиюÏолесÃÓпробирки. Что вы наблюдаете?
Часть водорода в момент выделения участвует в восстановлении йодоформа. После окончания выделения водорода и полного растворения натрия к реакционной смеси добавляют 2 мл дистиллированной воды.
Избыток алкоголята натрия реагирует с водой с образованием гидроксида натрия. Необходимо отметить, что образующаяся йодоводородная ки лота в процессе восстановления йодоформа взаимод й тву т алкоголятом натрия, в результате чего образу тся йодид натрия.
После того, как добави и воду, получился щелочной раствор, который подкис яют несколькими каплями концентрированн й аз тн й кис оты (контроль по лакмусовой бумаге) и к кисл му раств ру добав яют несколько капель 1 % раствора нитрата серебра. Происходит качественная реакция между й дид м натрия и нитратом серебра, с помощью которой открываем галоген в виде аниона (в составе йодида серебра).
Вопросы и задания
1. Выразите химическими схемами взаимодействие этилового спирта металлическим натрием, восстановление йодоформа и образование гидроксида натрия.
2. Почему в данном опыте нельзя брать избыток йодоформа? Как его избыток может отразиться на проведении качественной реакции с нитратом серебра?
37
3. Сделайте вывод об открытии галогенов в органическом веществе по методу Степанова
Контрольные вопросы
1. Какие физико-химические методы исследования вы знаете?
2. Что такое качественный элементный анализ?
3. По каким признакам можно определить присутствие в органическом веществе углерода и водорода при сожжении?
4. Объясните последовательно, как происходит определение азота в органическом веществе? Поясните процессы,
плавленияÏолесÃÓтвёрд го вещества, сделать вывод о степени чистоты исследуем го единения.
происходящие в ходе опыта схемами реакций.
5. Объясните способ открытия серы в органическом ве-
ществе. Напишите схемы химических реакций.
6. Какие способы определения галогенов в органических
веществах вы знаете? Напишите хемы реакций.
Лабораторная работа № 2 |
||
|
Способы очистки и выд л ния органических |
|
|
|
со дин ний |
Цель: |
знак миться |
сновными методами выделения и |
очистки |
рганических |
веществ, определить температуру |
Реактивы и материалы: твердое термоустойчивое вещество, набор растворителей (вода, этанол, ацетон, хлороформ, четырехлористый углерод, бензол, толуол, гексан, диэтиловый эфир, петролейный эфир, этилацетат, диоксан, ледяная уксусная кислота).
Оборудование: набор пробирок, пробиркодержатель, спиртовка, круглодонная колба на 100 мл, стакан на 100 мл, обратный холодильник, «кипелки», стеклянная палочка, баня, плитка, воронка Бюхнера, колба Бунзена, фильтровальная
38
бумага, стеклянная воронка, прибор для определения температуры плавления, капилляр, стеклянная трубка длиной 80-90 см, резиновое колечко, асбестовая сетка, делительная воронка.
Органические вещества, которые встречаются в природе или получаемые в лабораториях и на заводах, обычно представляют собой смеси веществ. Выделение и очистка органических соединений связаны со сложностью органических реакций, часто протекающих с образованием смеси соедине-
свойств органических соединений.
ний. Трудности при выделении индивидуального вещества из смесейÏолесÃÓи их очистка связаны с разнообразием проявляемых
Методы выделения и очистки многообразны и зависят от физических и химических свойств веществ, подвергаемых разделению. Обычными методами очистки можно достичь
содержание основного продукта 9,9…99,95 %.
В лаборатории органиче кой химии чаще всего прихо-
дится сталкиваться жидкими и тв рдыми веществами.
1. Кристаллизация
Кристаллизаци й называ тся м тод разделения и очистки твердых веществ, основанный на процессе образования и роста кристал ов из пересыщенных растворов соответствующих веществ.
Этапы криста изации:
- выб р раств рителя для проведения кристаллизации; - п лучение нагретого пересыщенного раствора вещества
в подходящем растворителе; - фильтрование горячего раствора от взвешенных нерас-
творимых частиц; - медленное охлаждение раствора до комнатной темпера-
туры и ниже (снег, лед, охлаждающие смеси); - отделение кристаллов от маточного раствора и их про-
мывание; - сушка кристаллов.
Выбор растворителя для кристаллизации
39
При выборе растворителя необходимо учитывать следующие требования:
-химическая инертность по отношению к очищаемому веществу;
-вещество должно хорошо растворяться при нагревании
иплохо при охлаждении;
-температура кипения раствора должна быть не менее чем на 30°С ниже температуры плавления кристаллизующегося вещества;
-растворимость основного вещества должна резко отличатьсяÏолесÃÓот растворимости загрязняющих примесей;
-растворитель должен легко удаляться поверхности кристаллов.
При выборе растворителя часто руководствуются правилом «подобное растворяется в подобном». Однако это правило приемлемо только для веще тв про того строения, для сложных соединений оно не в егда облюдает я.
Для хорошо изуч нных в щ тв ра творитель можно подбирать по данным растворимо ти, которые находятся в справочниках.
Окончательный выбор растворит ля для неизвестного вещества можно установить ишь опытным путем в пробирках с малыми к ичествами вещества, подвергаемого очистке. Для эт го берут неб ьшие (≈ 0,1 г) равные количества вещества в тдельные пр бирки и приливают к ним равные объемы исследуемых растворителей (≈ 0,5-1 мл).
Если вещество растворяется уже при комнатной температуре, то данный растворитель не пригоден для кристаллизации. Растворитель, в котором вещество не растворяется даже при кипении, также не пригоден для кристаллизации.
Если после охлаждения из раствора выпадут кристаллы, то растворитель пригоден для проведения кристаллизации.
Признаком пригодности растворителя для кристаллизации вещества, температура плавления которого неизвестна, является постоянство его температуры плавления при повторных кристаллизациях.
40
