
u_coll_pav
.pdfКолоїдна хімія |
1 |
|
КОЛОЇДНІ ПОВЕРХНЕВО-АКТИВНІ РЕЧОВИНИ
Класифікуючи дисперсні системи, ми розподіляли їх на дві групи — ліофільні і ліофобні (оборотні і необоротні). Після вивчення ліофобних дисперсних систем ми знаємо, що вони є термодинамічне нестійкими системами. Ліофільні системи тер-модинамічно стійкі, а це означає, що вони рівноважні (стан відповідає мінімуму енергії Гіббса), оборотні і утворюються самодовільно як із макрофаз, так і з істинного розчину. Типовими представниками ліофільних дисперсних систем є розчини колоїдних поверхнево-активних речовин.
Колоїдними поверхнево-активними речовинами називають ПАР, здатні утворювати міцелярні системи. Властивості ПАР, як зазначалося вище, зумовлені дифільністю їх молекул. У довголанцюгових ПАР з числом атомів вуглецю n = 10 — 20, для яких характерний оптимальний баланс гідрофільності і гідрофобності, спостерігаються особливі властивості. При малих концентраціях вони утворюють істинні розчини, із збільшенням концентрації відбувається процес асоціації і утворюються міцели. Цей процес самодовільний, і в системі можливі рівноважні переходи між молекулярним розчином, міцелярною системою, гелем (структурованою міцелярною системою) та твердим тілом.
Міцелярний розчин ПАР — це система термодинамічне стійка, рівноважна і оборотна. Міцели ПАР, на відміну від міцел ліофобних золів, термодинамічне стабільні і не змінюються, доки під дією зовнішніх факторів не зсунеться рівновага в системі.
Класифікація колоїдних ПАР
За властивістю дисоціювати ПАР розділяють на іоногенні (аніоноактивні, катіоноактивні, амфотерні) і неіоногенні.
У аніоноактивних ПАР поверхнево-активні іони заряджені негативно. До них належать лужні солі жирних кислот (мила) — RСООМе, алкілсульфати — сульфоефіри вищих спиртів та їх солі типу R-O-SO3-Ме; алкіл- і арілсульфонати RSO3Ме — лужні солі високомолекулярних сульфокислот, де R означає насичений вуглеводневий радикал числом атомів вуглецю 10-20, а Ме - іони Nа+, К, NH4.
Катіоноактивні ПАР — це солі амінів [RN+H3]Cl, четвертинних амонійних основ [R(CH3)3N+]Cl, алкілпіридинових сполук. [C5H5N+R]Cl
Поверхнево-активні іони таких речовин заряджені позитивно. Амфотерні ПАР — це алкіламінокислоти RNH2COOH, сульфобетаіни та ін. В залежності від рН вони виявляють аніоно-або катіоноактивні властивості.
Неіоногенні ПАР не дисоціюють на іони. Їх одержують взаємодією оксиду етилену із спиртами, фенолами, жирними кислотами та іншими сполуками з полярними групами. Загальна формула неіоногенних ПАР — R(ОСH2СH2)mОН. Гідрофільність їх визначається довжиною оксиетиленового ланцюга. У виробництві фармацевтичних препаратів широко застосовуються оксиетильовані похідні ефірів жирних кислот і сорбітану.
Важливою характеристикою колоїдного ПАР є співвідношення гідрофільних і гідрофобних властивостей, яке визначається числом ГЛБ. В залежності від числа ГЛБ колоїдні ПАР застосовуються як гідрофобні емульгатори (3—6), змочувачі (7—9), миючі засоби (13—15), гідрофільні емульгатори (8-18).
Причини міцелоутворения
Термодинамічною рушійною силою міцелоутворення є гідрофобні взаємодії: вуглеводнева частина дифільної молекули виштовхується із водного середовища, щоб уникнути контакту ланцюга з водою. В результаті утворюються міцели, внутрішня частина яких складається із рідкого вуглеводню (з'єднаних, щільно упакованих вуглеводневих ланцюгів), а зовнішня, звернена до води, — із полярних груп. Видалення з води вуглеводневих ланцюгів розпорядковує структуру води, внаслідок цього ентропія системи збільшується ( S > 0), а енергія Гіббса відповідно зменшується ( G= H -T S < 0). Отже, міцелоутворення — самодовільний процес.
Механізм міцелоутворення можна пояснити таким чином. При збільшенні концентрації зростає хімічний потенціал µПАР тобто збільшується енергія системи, при малих концентраціях молекули ПАР виходять у поверхневий шар, зменшуючи тим самим енергію. Коли поверхневий шар стає насиченим, система виводить гідрофобні ланцюги з води у нову фазу — міцелу, відділяючи її від води гідрофільною оболонкою з полярних груп. Таким чином, у розчині колоїдного ПАР існує термодинамічна рівновага між молекулами або іонами ПАР і міцелами, до деякої міри аналогічна утворенню нової конденсованої фази. Числа агрегації міцел (число молекул у міцелі) не такі великі (50—100 для більшості міцел), щоб розглядати їх як фази, але

Колоїдна хімія |
2 |
|
достатні для того, щоб вважати сукупність міцел «псевдофазою». Тому для термодинамічної інтерпретації властивостей цих систем з успіхом використовують гомогенне трактування (рівновага молекули асоціат, яка визначається законом діяння мас) і гетерогенне, основане на фазовій рівновазі, яка визначається рівністю хімічних потенціалів у двох співіснуючих фазах.
Критична концентрація міцелоутворення
Утворення міцел відбувається при певній концентрації — так званій критичній концентрації міцелоутворення (ККМ). За визначенням ІЮПАК, ККМ — це концентрація ПАР, при якій в його розчині виникає велике число міцел, що перебувають в термодинамічній рівновазі з молекулами (іонами), і різко змінюється ряд властивостей розчинів.
Саме на цій різкій зміні фізико-хімічних властивостей розчинів ПАР основані методи визначення ККМ. Наприклад, крива залежності молярної електричної провідності А від концентрації (рис. 1) має злам, який відповідає різкому зменшенню λ в області ККМ. На кривій залежності поверхневого натягу від концентрації в цій області спостерігається вихід на горизонтальну ділянку (2). Так само різко змінюються і інші властивості, зокрема, миюча здатність (3), осмотичний тиск (4), світлорозсіяння, показник заломлення
та ін.
На величину ККМ впливають різні фактори. У гомологічних рядах з підвищенням молекулярної маси ПАР величина ККМ зменшується, бо здатність до асоціації зростає із збільшенням довжини вуглеводневого ланцюга. Електроліти значно знижують ККМ іоногенних ПАР. Головну роль при цьому відіграють іони, заряджені протилежно іону ПАР. Вони знижують заряд міцели, при цьому зменшується електростатичне відштовхування і полегшується приєднання нових молекул до міцели. Підвищення температури підсилює тепловий рух частинок, що перешкоджає їх агрегації. Але у випадку іоногенних ПАР одночасно зменшується гідратація і це сприяє міцелоутворенню. Критична
концентрація міцелоутворення ПАР переважно лежить в межах від 0,0005 (стеарат калію) до 0,014 (додециламонію хлорид) моль/л
Будова міцел
При концентраціях, відповідних ККМ, у розчинах ПАР утворюються сферичні міцели, або міцели Гартлі. У водних розчинах сферична міцела — це компактне утворення, яке складається із рідкого вуглеводневого ядра, покритого шаром полярних груп. У неводних розчинах виникають зворотні міцели, ядро яких утворюють полярні групи, а вуглеводневі ланцюги звернені до розчинника (рис. намалювати).
При підвищенні концентрації розчину ПАР розмір міцел збільшується, вуглеводневі ланцюги розташовуються все більш паралельно один одному, і в результаті утворюються
пластинчасті міцели (міцели пластинчасті Мак-Бона - намалювати). У водних розчинах ці міцели складаються з двох шарів молекул ПАР, звернених один до одного вуглеводневими ланцюгами, а до розчинника — полярними групами. Пластинчасті міцели розташовуються паралельно, достатньо концентровані розчини їх можуть переходити у гель, структура якого складається із стрічок і плівок. Міцели характеризуються числом агрегації (число молекул у міцелі) і міцелярною масою (сума молекулярних мас).
Методами світлорозсіяння і дифузії були визначені розміри міцел деяких колоїдних ПАР у воді. Міцелярна маса лежить у межах від 10.000 (число агрегації 56) до 200,000 (373)
Причому: 1) у межах гомологічного ряду міцелярна маса і число агрегації збільшується із зростанням вуглеводневого ланцюга; 2) при збільшенні гідрофільної частини молекули міцелярна маса і число агрегації зменшуються.
Солюбілізація
Солюбілізацією називають процес самодовільного розчинення у міцелярних системах нерозчинних у даному розчиннику сполук. Наприклад, у достатньо концентрованих водних розчинах колоїдних ПАР розчиняються органічні речовини, практично нерозчинні у воді: аліфатичні і ароматичні вуглеводні, маслорозчинні барвники і т.д. Солюбілізацію називають також
Колоїдна хімія |
3 |
|
колоїдним розчиненням. Колоїдне розчинення води у неводних розчинах колоїдних ПАР — це
зворотна солюбілізація.
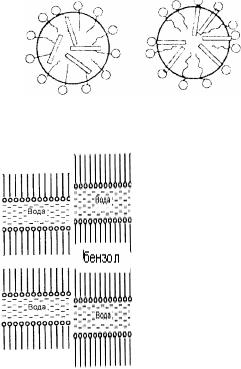
В результаті солюбілізації утворюється прозорий термодинамічно рівноважний розчин, який, однак, належить не до істинних, а до колоїдних розчинів, внаслідок того, що він має колоїдний ступінь дисперсності. Речовина, яка розчиняється у міцелярній системі, називається солюбілізатом. Солюбілізація полягає у проникненні солюбілізата у міцелу. Можливі різні механізми солюбілізації. При прямій солюбілізації неполярні вуглеводні розчиняються у ядрі міцели (рис. а). Полярні органічні речовини (спирти, аміни) розташовуються у міцелі так, щоб їх вуглеводнева частина містилася усередині міцели, а полярна група була направлена до водної фази
(рис., 6).
При солюбілізації у пластинчастих міцелах речовина входить усередину міцели, розташовується між вуглеводневими кінцями молекул ПАР і тим самим роздвигає шари молекулярних ланцюгів (рис. 28.10).
Експериментальнo встановлено, то солюбілізація вуглеводнів зменшується із зростанням довжини ланцюга, а солюбілізуюча здатність ПАР у межах одного гомологічного ряду зростає із збільшенням числа атомів вуглецю.
Неіоногенні сполуки мають меншу солюбілізуючу здатність порівняно з іоногенними. Виключно велику солюбілізуючу активність мають біологічно активні колоїдні електроліти — холат і дезоксихолат натрію, які розчиняють
жири, що надходять до організму. |
|
У фармації солюбілізацію |
застосовують для одержання |
водорозчинних препаратів із нерозчинних у воді речовин. Йодофори — це препарати йоду, розчиненого у поверхнево-активних речовинах. Введення ПАР дозволяє одержувати препарати стероїдів для парентерального і зовнішнього застосування. Вітаміни А і Е солюбілізують ефірами сахарози. У оксиетильованих ефірах сорбітану солюбілізуються барбітурати і аспірин.
Застосування колоїдних ПАР
Застосування колоїдних ПАР пов'язане з їх високою поверхневою активністю, здатністю до змочування, емульгуючою дією, солюбілізацією, здатністю до гелеутворення. В багатьох випадках ефективність їх застосування визначається кількома факторами одночасно. Наприклад, миюча дія пов'язана із здатністю колоїдних ПАР змочувати тканини, зменшувати міжфазний натяг, утворювати міцні адсорбційні шари, солюбілізувати жирові забруднення.
Широко застосовуються ПАР у фармацевтичному виробництві як стабілізатори і солюбілізатори. Лужні солі вищих карбонових кислот використовують як емульгатори, солюбілізатори, стабілізатори мазей і кремів. Катіоноактивні ПАР застосовують як бактерицидні, фунгіцидні, дезинфікуючі засоби. Твіни — це емульгатори, солюбілізатори гормонів, масел, вітамінів, антибіотиків, плюроніки — солюбілізатори вітамінів, антибіотиків, шампунів, зубних паст.
