
u_grubodisp
.pdfГРУБОДИСПЕРСНІ СИСТЕМИ
1.Системи з газовим дисперсійним середовищем (аерозолі, порошки)
2.Системи з рідким дисперсійним середовищем (суспензії, пасти, емульсії, піни)
3.Напівколоїдні поверхнево-активні речовини
1. Системи з газовим дисперсійним середовищем Аерозолі. Аерозолі це дисперсні системи з газовим дисперсійним середовищем.
За агрегатним станом розрізняють такі аерозолі: системи з рідкою дисперсною фазою - тумани; системи з твердою фазою - дими (розмір частинок 10-9 до 10-5 м) і пил (розмір частинок більше 10-5 м). Дими, які утворюються при згорянні палива і адсорбують вологу з атмосфери, є одночасно димами і туманами. Такі системи існують над великими промисловими містами і
називаються смогом. Вони є небезпечними для здоров’я.
За походженням аерозолі розділяють на диспергаційні і конденсаційні. Диспергаційні аерозолі одержують при подрібненні твердих тіл або розпилюванні рідин. Високодисперсні аерозолі можна отримувати конденсаційними методами, або в результаті хімічних реакцій.
Молекулярно-кінетичні властивості. Оскільки газове середовище має більш низьку в'язкість
то броунівський рух в аерозолях є набагато інтенсивніший ніж в золях. Кінетичні властивості аерозолів проявляються і іншими явищами. Явище термофорезу полягає в рухові частинок
аерозолю в напрямку зниження температури. Причиною цього є те, що на більш нагрітий бік
частинки молекули газу ударяють з більшою швидкістю, ніж на менш нагрітий бік, тому і частинка рухається в напрямку зниження температури. Фотофорез — це рух частинок аерозолю в напрямку світлового променю. Термопреципітація - це осадження частинок на холодних
поверхнях внаслідок термофорезу. Прикладом термопреципітації є осідання пилу на стінах поблизу радіаторів, ламп, печей та ін.
Оптичні властивості. Аерозолі відрізняються яскраво вираженою здатністю до світлорозсіяння, що пов'язано з великою різницею показників заломлення дисперсної фази і газового середовища. Тому аерозолі застосовують для створення димових завіс.
Електричні властивості. Аерозольні частинки не мають подвійних електричних шарів. Електричний заряд виникає при зіткненнях частинок між собою, або при адсорбції іонів, що утворюються при іонізації газів під дією космічних, ультрафіолетових та радіоактивних випромінювань. Отже, заряд частинок аерозолю випадковий. При осіданні заряджених частинок аерозолю виникає потенціал седиментації. Швидкість седиментації підсилюється конвекцією, в цих умовах досягається велика напруженість поля, яка відповідає блискавці.
Стійкість аерозолів. Аерозолі агрегативно дуже нестійкі, внаслідок відсутності електростатичного та адсорбційно-сольватного бар'єрів. Швидкість коагуляції зростає з підвищенням концентрації аерозолю, механічного перемішування, ультразвукових коливань. На стійкість туманів особливо впливає температура.
Руйнування аерозолів. Оскільки аерозолі забруднюють атмосферу, то виникає необхідність в їх руйнуванні. Для руйнування аерозолів використовують циклони, електрофільтри, паперові, азбестові, пористі керамічні фільтри і т.д. У циклонах частинки аерозолів осаджуються під дією відцентрової сили. У електрофільтрах частинки заряджаються і осідають на одному з електродів. Аерозолі руйнують також введенням речовин, що можуть бути центрами кристалізації, чи конденсації. Так, при розпиленні твердого СО2 або АgI відбуваєтеся конденсація пари води, яка випадає у вигляді дощу.
Застосування аерозолів. Аерозолі застосовують для фарбування поверхні, розпилення палива перед горінням, розпилення добрив та отрутохімікатів. У фармації широко використовують аерозольну лікарську форму, яка дозволяє об’єднувати кілька лікарських речовин та є простою в застосуванні. Обов'язковим компонентом аерозольних сумішей є пропеленти (фреони, зокрема
фторхлорвуглеводні) чи такі гази, як пропан, бутан.
Порошки. Порошки - це системи з газоподібним середовищем і твердою фазою, яка складається з частинок розміром від 10-8 до 10-4 м. Порошки одержують подрібненням твердих тіл за допомогою млинів: жорнових, кульових, вібраційних, молоткових та ін. В аптеках для цього
2
користуються ступкою з товкачиком. Кожний порошок неоднорідний за розмірами частинок. Для визначення розміру частинок порошків використовують спеціальні сита.
Насипною щільністю називають масу одиниці об'єму порошку. Для її визначення в циліндр маленькими порціями, легенько постукуючи, насипають порошок та зважують. У грубих порошків насипна щільність майже не залежить від розміру частинок, але зі збільшенням дисперсності порошку починають діяти міжмолекулярні сили, які збільшують тертя між частинками і сприяють утворенню більш пухкої структури, тому насипна маса зменшується.
Розпилення порошків (переведення у стан, подібний рідкому). Якщо крізь шар порошку продувати знизу газ, то порошок почне розширюватися і нагадує киплячу рідину, тому і називається «киплячим шаром». В такому стані порошок має велику текучість і нагадує рідину.
Гранулювання порошків - це процес переведення порошків у гранули - агрегати сферичної або циліндричної форми. Гранули більш стійкі при зберіганні, їх зручніше дозувати. Механізм гранулювання полягає в тому, що частинки порошку з’єднуються між собою, утворюючи агрегати. Гранули є однією з лікарських форм, з них способом пресування готують таблетки. Порошки, гранули, таблетки складають до 80% сучасних лікарських форм.
2. Системи з рідким дисперсійним середовищем Суспензії. Суспензії - це гетерогенні системи з рідким дисперсійним середовищем і твердою
дисперсною фазою. Від колоїдів вони відрізняються більшим розміром частинок (10-6-10-4 м). Найчастіше суспензії одержують диспергуванням твердих речовин у рідкому середовищі.
За молекулярно-кінетичними і оптичними властивостями суспензії дуже відрізняються від колоїдних систем. Через великий розмір частинок броунівський рух у них виявляється дуже слабо, а явища дифузії і осмосу їм не властиві. Світло, проходячи крізь суспензії, не розсіюється, а відбивається, тому вони каламутні, ефект Тіндаля їм не притаманний.
Седиментаційна стійкість суспензій дуже мала внаслідок великого розміру частинок і тверда фаза цілком випадає в осад за короткий час. Стабілізують суспензії за допомогою високомолекулярних речовин. Захисний шар цих речовин забезпечує гідратацію частинок, крім того, довгі ланцюги макромолекул охоплюють частинки, утворюючи структурні решітки.
Пасти. При підвищенні концентрації дисперсної фази утворюються висококонцентровані суспензії - пасти. Майже все дисперсійне середовище у пастах зв'язане у сольватних плівках, які розділяють частинки. В зв'язку з відсутністю вільної рідини пасти мають велику в'язкість, в них можуть утворюватися просторові структури, здатні до синерезису і тиксотропії.
Суспензії та пасти мають велике значення в природі і техніці. До них належать вологий ґрунт, будівельні розчини, масляні фарби та лаки. Суспензії використовують як каталізатори в промисловості. В суспензії лікарська речовина має більш високу ступінь дисперсності, ніж у порошку і тому швидше і повніше виявляє свою лікарську дію. Для стабілізації лікарських суспензій до них додають желатозу, камеді, метилцелюлозу та інші речовини. Пасти та суспензії
найбільш широко використовуються в дерматології, стоматології, косметології.
Емульсії. Емульсіями є системи, в яких дисперсійне середовище і дисперсна фаза рідкі. Умовою утворення емульсії є взаємна нерозчинність рідин. Найбільше значення мають емульсії, в яких одна з фаз - вода. Другу фазу утворює неполярна рідина, яку, незалежно від природи, називають маслом. Дисперсність емульсій змінюється у великих межах — від краплин розміром 10-7 м до таких, які можна побачити неозброєним оком. Емульсії одержують шляхом механічного диспергування (струшуванням, перемішуванням, дією ультразвуку), видавлюванням рідини через тонкі отвори під великим тиском, методом заміни розчинника.
За полярністю фаз розрізняють прямі емульсії (першого роду), які складаються з полярного дисперсійного середовища (вода) і неполярної дисперсної фази (масло); їх позначають м/в.; та зворотні емульсії (другого роду), у яких дисперсійне середовище є неполярним (масло), а дисперсна фаза є полярною (вода), їх позначають - в/м. Емульсії поділяють на розбавлені — з часткою дисперсної фази не більше 0,1%; концентровані — з часткою більше 0,1%.

3
Емульсії - агрегативно нестійкі, що проявляється у самовільному злипанні крапель - коалесценції, яка веде до розшарування емульсії. Для емульсій характерне також явище седиментації - спливання або осідання краплин дисперсної фази.
Для отримання емульсій потрібно застосовувати емульгатори - речовини, які знижують поверхневий натяг рідин. Існує оптимальне співвідношення між гідрофільними і ліпофільними властивостями молекул ПАР. Нагадаємо, що гідрофільні властивості визначаються полярною частиною молекули ПАР, а ліпофільні – довжиною гідрофобного хвоста. Якщо у емульгатора переважають гідрофільні властивості, то тоді молекули ПАР втягуються у воду, а якщо переважають ліпофільні властивості - то молекули ПАР втягуються у масло. Співвідношення гідрофільних і ліпофільних властивостей молекул ПАР називають гідрофільно-ліпофільним
балансом. Розташування молекул емульгатора в системі масло/вода в залежності від його гідрофільних чи гідрофобних властивостей подано на рис. 1.
Стабілізуюча дія емульгатора полягає не тільки в зниженні поверхневого натягу, скільки в утворенні структурномеханічного бар'єру. Ефективними емульгаторами є високомолекулярні ПАР (желатин, сапоніни, полівінілові спирти і т. д.). Ці речовини утворюють на межі поділу фаз тривимірні сітки.
Для одержання лікарських емульсій застосовуються неіоногенні ПАР - твіни і плюроніки. Речовини типу
плюронік використовуються для одержання дисперсій лікарських препаратів, які можна вводити в
систему кровообігу. Такими є емульсії перфторвуглеводнів, що переносять кисень в «штучній крові». Твіни використовують частіше в емульсіях для зовнішнього застосування. Для вживання через рот краще користуватись прямими емульсіями, а при введенні через шкіру - емульсії зворотного типу, тому що шкіра малопроникна для води і розчинених в ній речовин. Процес емульгації під впливом жовчних кислот харчових жирів (молоко, яєчний жовток, сметана, олія і т.д) є необхідної стадією їх перетравлення в кишечнику.
Піни - це гетерогенні системи, у яких дисперсна фаза складається із бульбашок газу, а дисперсійне середовище (рідке чи тверде) утворює тонкі плівки між бульбашками, розмір яких 10- 3-10-2 м. Для одержання пін застосовують інтенсивне перемішування та інші методи. Для утворення стійкої піни потрібно додавати стабілізатори - піноутворювачі. Суть процесу піноутворення полягає в тому, що бульбашки газу оточуються
адсорбційним шаром піноутворювача, спливають до поверхні (рис. 2).
Стійкість пін. Стійкість піни можна охарактеризувати за часом життя окремої газової бульбашки. Піна може існувати кілька секунд і кілька годин. Низькомолекулярні ПАР -спирти і жирні кислоти утворюють малостійкі піни, мила дають більш стійкі піни, але найбільш стійкі піни дають глюкозиди (сапоніни), таніди,
барвники і високомолекулярні сполуки (білки).
Руйнування пін. У ряді випадків піноутворення може бути небажаним. Покриваючи поверхню води, піна перешкоджає надходженню кисню у воду, що згубно діє на фауну і флору. Піни руйнують механічною дією, або додаванням ПАР, які мають високу поверхневу активність, але самі не утворюють стійкої піни. Такі речовини витискують піноутворювач із адсорбційного шару і руйнують плівку. У виробництві антибіотиків, вітамінів, дріжджів, цукру для гасіння пін використовують олії, тваринні жири.
Значення пін і піноутворення. Піноутворення використовується у виробництві будівельних і теплоізоляційних матеріалів (пінобетон, піноскло), пластичних мас (пінопласти), при збагаченні корисних копалин (пінна флотація). Виключне значення мають піни у протипожежній справі.
4
Екстракорпоральне насичення крові киснем здійснюється у пінних апаратах («штучні легені»). Пінні аерозолі використовують для зупинки кровотеч.
3. Колоїдні поверхнево-активні речовини
Раніше ми наголошували на тому, що ліофобні дисперсні системи (колоїдні розчини) є термодинамічне нестійкими. Однак розчини колоїдних поверхнево-активних речовин виявляють значну стійкість. Розчини ПАР краще називати напівколоїдними, оскільки частинки що в них знаходяться, існують як в формі молекул та іонів, так і колоїдних частинок (міцел).
Колоїдними поверхнево-активними речовинами називають ПАР, які здатні утворювати міцелярні системи. Властивості ПАР зумовлені дифільністю їх молекул. У довголанцюгових ПАР з числом атомів вуглецю n = 10-20, для яких характерний оптимальний баланс гідрофільності і гідрофобності, спостерігаються особливі властивості. При малих концентраціях вони утворюють істинні розчини, але при збільшенні концентрації відбувається процес асоціації молекул і утворення міцел. Залежно від концентрації ПАР в такій системі можливі переходи між молекулярним розчином, міцелярною системою, гелем (структурованою міцелярною системою) та твердим тілом.
Міцелярний розчин ПАР — це система термодинамічно стійка, рівноважна і оборотна. Міцели ПАР, на відміну від міцел ліофобних золів, термодинамічне стабільні і не змінюються,
доки під дією зовнішніх факторів не зсунеться рівновага в системі.
Класифікація колоїдних ПАР. За властивістю дисоціювати ПАР розділяють на іоногенні (аніоноактивні, катіоноактивні, амфотерні) і неіоногенні.
У аніоноактивних ПАР поверхнево-активні іони заряджені негативно. До них належать солі жирних кислот (мила) - RСООМе, алкілсульфати - ROSO3Ме; алкілсульфонати RSO3Ме, де R - це вуглеводневий радикал з числом атомів вуглецю 10-20, а Ме - іони Nа+, К+, NH4+.
Катіоноактивні ПАР - це солі амінів RNH2.НCl, четвертинних амонійних основ [R(CH3)3N+]Cl, алкілпіридинових сполук [C5H5N+R]Cl. Поверхнево-активні іони таких речовин заряджені позитивно.
Амфотерні ПАР - це алкіламінокислоти RNH2COOH, сульфобетаіни та ін. В залежності від рН вони виявляють аніоноабо катіоноактивні властивості.
Неіоногенні ПАР не дисоціюють на іони. Загальна формула неіоногенних ПАР — R(ОСH2СH2)mОН. Гідрофільність їх визначається довжиною оксиетиленового ланцюга. У виробництві фармацевтичних препаратів широко застосовуються оксиетильовані похідні ефірів жирних кислот і сорбітану.
Важливою характеристикою колоїдного ПАР є співвідношення гідрофільних і гідрофобних властивостей. В залежності від числа ГЛБ колоїдні ПАР застосовуються як гідрофобні
емульгатори (3-6), змочувачі (7-9), миючі засоби (13-15), гідрофільні емульгатори (8-18). Причини міцелоутворення. Рушійною силою міцелоутворення є гідрофобні взаємодії:
вуглеводнева частина дифільної молекули витісняється з водного середовища, щоб уникнути контакту ланцюга з водою. Фактично утворення міцел є не взаємодія вуглеводневих ланцюгів, а намагання молекул води утворити водневі зв’язки між собою В результаті утворюються міцели, внутрішня частина яких складається з щільно упакованих вуглеводневих ланцюгів), а зовнішня
частина, яка обернена до води, складається з полярних груп.
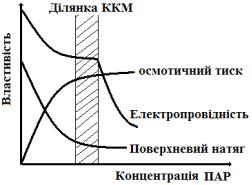
Критична концентрація міцелоутворення (ККМ) - це концентрація ПАР, при якій в його розчині виникає велике число міцел і це супроводжується різкими змінами властивостей розчинів. Саме по різкій зміні фізико-хімічних властивостей розчинів ПАР визначається ККМ (рис. 3). Наприклад, крива залежності електричної провідності від концентрації ПАР має злам, який відповідає її різкому зменшенню в області ККМ. На кривих залежності поверхневого натягу, чи осмотичного тиску від концентрації ПАР в області ККМ спостерігається вихід цих кривих на горизон-
5
горизонтальну ділянку.
На величину ККМ впливають різні фактори. Зокрема іони, заряджені протилежно іону ПАР, знижують заряд міцели, при цьому зменшується електростатичне відштовхування і полегшується приєднання нових молекул до міцели. Підвищення температури підсилює тепловий рух частинок, що перешкоджає утворенню міцел.
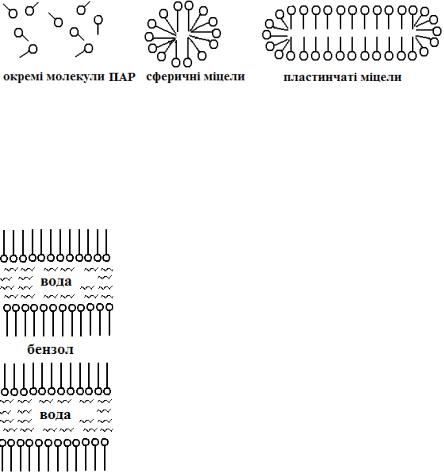
Будова міцел. При концентраціях, що відповідають ККМ, в розчинах ПАР утворюються сферичні міцели, або міцели Гартлі. У водних розчинах сферична міцела - це компактне утворення, яке складається із рідкого вуглеводневого ядра, покритого шаром полярних груп (рис. 4). При підвищенні концентрації ПАР розмір міцел збільшується, вуглеводневі ланцюги розташовуються все більш паралельно один одному і в результаті утворюються пластинчасті
міцели (міцели Мак-Бона). У водних розчинах ці міцели складаються з двох шарів молекул ПАР, обернених один до одного вуглеводневими
ланцюгами, а до розчинника вони обернені полярними групами. При зростанні концентрації ПАР міцелярні розчини можуть переходити у гель, структура якого складається із стрічок і плівок. Число молекул в сферичній міцелі може сягати від 20 до 100, а в пластинчатих міцелах сотні
молекул.
Солюбілізація. Солюбілізацією називають процес самовільного розчинення у міцелярних системах нерозчинних у даному розчиннику сполук. Наприклад, в концентрованих водних розчинах колоїдних ПАР розчиняються органічні речовини, які є практично нерозчинними у воді:
аліфатичні і ароматичні вуглеводні, маслорозчинні барвники і т.д. Солюбілізацію називають також колоїдним розчиненням. В результаті солюбілізації утворюється прозорий стійкий розчин, який належить не до істинних, а до колоїдних розчинів, тому, що він має колоїдний ступінь дисперсності. Солюбілізація полягає у проникненні солюбілізата у міцелу. При солюбілізації у пластинчастих міцелах речовина входить усередину міцели, розташовується між вуглеводневими кінцями молекул ПАР і тим самим розсовує шари молекулярних ланцюгів. На рисунку 5 показано, як нерозчинна речовина бензол, може бути солюбілізована у воді за допомогою ПАР. Зокрема, крапля бензолу оточується гідрофобними хвостами ПАР, а полярні частини ПАР контактують з водою.
Виключно велику солюбілізуючу |
активність мають солі жовчних кислот - |
холат і дезоксихолат натрію, які |
солюбілізують та емульгують жири в |
кишечнику. У фармації солюбілізацію застосовують для одержання водорозчинних препаратів із нерозчинних у воді речовин. Йодофори - це препарати йоду, розчиненого у поверхнево-активних речовинах. За допомогою ПАР отримують водорозчинні препарати стероїдних гормонів, жиророзчинних вітамінів і т.д. Такі ПАР, як твіни та плюроніки використовують в якості стабілізаторів мазей і кремів. Катіоноактивні ПАР застосовують як бактерицидні, фунгіцидні засоби.
Зі здатністю до солюбілізації нерозчинних у воді речовин, пов’язана миюча дія мила, інших косметичних та промислових детергентів. Вона базується на здатністю колоїдних ПАР змочувати тканини, зменшувати міжфазний натяг, утворювати міцні адсорбційні шари, солюбілізувати жирові забруднення.
