
u_zadachi_2
.pdf
Вінницький національний медичний університет ім. М.І. Пирогова
Кафедра біологічної та загальної хімії
СМІРНОВА О.В.
ЗБІРНИК ЗАДАЧ ТА ВПРАВ З МЕДИЧНОЇ ХІМІЇ
Частина 2
Модуль № 2 « Рівноваги в біологічних системах на межі розділу фаз»
Для студентів медичного, стоматологічного факультетів та факультету медичній психології ВНМУ ім. М.І.Пирогова
Вінниця 2010
1
Збірник затверджено на Центральному методкомі ВНМУ ім. М.І. Пирогова
(протокол № |
від |
2010г.) |
Рецензенти:
Ющенко Т.І. – к.х.н., зав. кафедрою фармацевтичної хімії ВНМУ ім. М.І. Пирогова
Рибак п.Г. – к.б.н. доцент, завідувач кафедрою природничихх наук ВНМУ ім. М.І.Пирогова
2
|
Зміст: |
|
1. |
Теплові ефекти хімічних реакцій. |
|
|
Спрямованість процесів..................................................... |
4 |
2. |
Кінетика біохімічних процесів ........................................... |
7 |
3. |
Хімічна рівновага ................................................................ |
11 |
4. |
Метод потенціометричного аналізу .................................. |
16 |
5.Окиснювально – відновні або редокс – системи………….22
6.Будова колоїдної частинки (міцели)……………………… 25
3
ТЕПЛОВІ ЕФЕКТИ ХІМІЧНИХ РЕАКЦІЙ. СПРЯМОВАНІСТЬ ПРОЦЕСІВ
Тепловий ефект хімічної реакції – це кількість теплоти, яка виділяється або поглинається в процесі реакції.
Закон Гесса: тепловий ефект хімічної реакції не залежить від шляху її проходження, а залежить від її початкового та кінцевого стану.
Теплота утворення (перший наслідок закону Гесса) – це тепловий ефект утворення 1моль речовини із простих речовин за 250С(298 К), 101,3 кПа і дорівнює різниці між сумою теплот утворення продуктів реакції та сумою теплот утворення вихідних речовин, узятих з урахуванням стехіометричних коефіцієнтів рівняння реакції:
∆НУТВ.. = ∑ .∆НПРОД. – ∑ .∆НВИХ.
Теплота згоряння (другий наслідок закону Гесса) – це тепловий ефект згоряння 1моль речовини до СО2 Г та Н2О Р і дорівнює різниці між сумою теплот згоряння вихідних речовин та сумою теплот згоряння продуктів реакції, узятих з урахуванням стехіометричних коефіцієнтів рівняння реакції:
∆НСГОР. = ∑ .∆НВИХ. – ∑ .∆НПРОД.
Спрямованість процесу або можливість хімічної реакції визначається енергією Гіббса.
Енергія Гіббса або ізобарно – ізотермічний потенціал – це сумарний ефект прояву энтальпійного Н та энтропійного S чинників.
∆G = ∑ .∆ GПРОД. – ∑ .∆ GВИХ.
Якщо ∆G < |
0, то реакція можлива. |
||
Якщо |
∆G |
> |
0, то реакція неможлива (іде зворотня реакція). |
Якщо |
∆G |
= |
0, то система в рівновазі. |
Приклади розв`язання задач
1. Розрахувати тепловий ефект реакції окиснення глюкози, якщо ∆НУТВ.. глюкози -1272,45 кДж/моль, вуглекислого газу -393,6 кДж/моль, води -285,9 кДж/моль.
∆НУТВ..(С6 Н12О6)=-1272,4кДж/моль; |
1) Окиснення глюкози іде за |
|
∆НУТВ. (СО2) = -393,6 кДж/моль |
рівнянням: |
|
∆НУТВ. (Н2О)= -285,9 кДж/моль; |
|
С6 Н12О6 + 6 О2 → 6СО2 + 6Н2О; |
∆НРЕАКЦІЇ = ? |
|
|
|
|
|
2) Використовуємо рівняння першого наслідку закону Гесса:
∆НУТВ.. = ∑ .∆НПРОД. – ∑ .∆НВИХ.;
3)Підставляємо дані ∆НУТВ. продуктів реакції та вихідних речовини із урахуванням стехіометричних коефіцієнтів:
4

∆НРЕАКЦІЇ = [ 6· (–393,6) + 6 · (–285,9) ] – (–1272) = = – 2804,55 кДж/моль.
.
Відповідь: ∆НРЕАКЦІЇ = - 2804,55 кДж/моль,
реакція екзергонічна.
1.Чи можлива реакція Hg2Cl2 → HgCl2 + Hg, якщо енергія Гіббса
Hg2Cl2 - 210,66 кДж/моль, а HgCl2 -185,77 кДж/моль?
∆G (Hg2Cl2) = -210,66 кДж/моль; 1) Напишемо рівняння енергії
∆G (HgCl2) = -185,77 кДж/моль; |
|
Гіббса для даної реакції |
|
|
|
|
|
|
∆ GРЕАКЦІЇ = ? |
|
∆G = ∑ .∆ GПРОД. - ∑ .∆ GВИХ.; |
2) Підставляємо дані з умови задачі: |
|||
|
∆G = -185,77 – (-210,66) = 24,89кДж/моль. |
||
|
|
Відповідь ∆G = 24,89кДж/моль. |
|
|
|
|
Реакція неможлива. |
3) Обчислити тепловий ефект реакції утворення ацетилену із бензолу, якщо відомі значення теплот згоряння:
бензолу – 2364,5 кДж/моль, ацетилену – 1299,6кДж/моль.
∆НСГОР.(С6Н6)= – 3264,5 кДж/моль; |
|
1) На основі другого наслідку із |
||
∆НСГОР.(С2Н2) = – 1299,6 кДж/моль; |
|
закону Гесса: |
||
|
|
|
∆НР-ЦІЇ =∆НЗГОР.(С6Н6)- 3∆НЗГОР.(С2Н2); |
|
|
|
|||
∆НР-ЦІЇ = ? |
|
2)Подставляємо дані із умови |
||
|
|
|
задачі: |
|
|
|
|
|
|
∆НР-ЦІЇ = – 3264,5 |
– 3(– 1299,6) = |
634,3кДж/моль. |
||
|
|
|
Відповідь: |
∆НР-ЦІЇ = 634,3кДж/моль. |
4) На випаровування 1моль води необхідно 40,7 кДж. Скільки теплоти витрачається за день в результаті виділення через шкіру 800,0г води?
ν(Н2О) = 1моль; |
|
1) Знаходимо кількість речовини у 800,0г води: |
|||||
∆НВИПАР. = 40,7кДж/моль; |
|
ν= |
800 |
= 44,44 моль; |
|||
|
|||||||
|
|
18 |
|
|
|
|
|
m(Н2О)= 800,0г; |
|
2) Для знаходження теплоти використовуємо |
|||||
|
|
пропорцію: |
|
|
|||
|
|
|
|
||||
∆Н = ? |
|
1моль(Н2О) |
– |
40,7 кДж |
|||
|
|||||||
|
|
44,44 моль(Н2О) |
– |
Х |
|||
|
|
|
Х = |
44,44 40,7 |
= 1808,9кДж. |
||
|
|
|
|
||||
|
|
|
|
|
|
1 |
|
Відповідь: 1808,9кДж.
5)Обчислити зміну енергії Гіббса в процесі засвоєння в організмі людини сахарози, який зводиться до її окиснення, якщо
∆GУТВ.(СО2) = -394,4 кДж/моль, ∆GУТВ.(Н2О) = -237 кДж/моль,
5

∆GУТВ(С12Н22О11) = -1545 кДж/моль.
∆GУТВ.(С12Н22О11) = -1545 кДж/моль; 1) Напишемо рівняння окиснення ∆GУТВ.(СО2) = -394,4 кДж/моль; сахарози:
∆GУТВ.(Н2О) = -237 кДж/моль; С12Н22О11(к +11О2(г)→12СО2(г)+11Н2О(р); 2) Напишемо рівняння енергії
∆GРЕАКЦІЇ = ? Гіббса для реакції:
∆G = ∑ .∆ GПРОД. - ∑ .∆ GВИХ.;
3) Підставляємо дані з умови задачі з урахуванням стехіометричних коефіцієнтів:
∆GР-ЦІЇ= [ 12· (-394,4) + 11 · (-237) ] - (-1545) = - 5794 кДж/моль. Ответ: ∆GР-ЦІЇ = - 5794 кДж/моль.
6)Теплота утворення вуглеводів в організмі людини складає 4,1ккал/г. Добова потреба у вуглеводах для студентів
|
|
жінок 383г. Обчислити добову потребу студентів в |
||||||||
|
|
енергії по |
вуглеводах. |
|
|
|
|
|
||
|
∆ НУТВ..(ВУГЛ) = 4,1ккал/г |
|
; 1) Для вирішення задачі використовуємо |
|||||||
|
|
|||||||||
|
|
m(ВУГЛ)= 383г; |
|
пряму пропорцію: |
|
|||||
|
|
|
4,1ккал |
- |
на |
1г вуглеводів |
||||
|
|
|
|
|
||||||
|
|
|
|
|
||||||
|
|
Н = ? |
|
|
Х |
- |
на |
383г вуглеводів |
||
|
|
|
|
|||||||
|
|
|
|
|
Х = |
4,1 383 |
|
= 1570,3ккал. |
||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
Відповідь: 1570,3ккал. |
||||
|
|
|
Задачі для самостійного розв`язання |
|||||||
1. |
Чи можлива реакція: Al2O3 + SO3 = Al2(SO4)3, якщо енергія Гіббса |
|||||||||
|
|
Al2O3(к)= 1576,4 кДж/моль, SO3 |
= 370,37 кДж/моль, |
|||||||
|
|
Al2(SO4)3 |
= 3091,9кДж/моль? |
|
|
(відповідь: 404,39кДж/моль; |
||||
|
|
|
|
|
|
|
|
|
|
реакція неможлива) |
2. |
Обчислити енергію Гіббса для реакції гліколізу: |
|||||||||
|
|
С6Н12О6 → 2С3Н6О3 |
|
|
|
|
|
|||
|
|
|
МОЛОЧНА КИСЛОТА |
|
|
|
|
|
||
|
|
якщо ΔG0 молочної кислоти = - 539кДж/моль, |
|
|||||||
|
|
а ΔG0 глюкози= - 917кДж/моль. |
|
|
(відповідь: -161кДж/моль) |
|||||
3.Теплота утворення білків в організмі людини складає 4,1ккал/г. Середньо добова потреба в білках для студентів жінок складає 96г. Обчислити добову потребу студентів в енергії по білках.
(відповідь: 393,6 ккал)
4.Перевірте, чи немає загрози, що нитроген(I) оксид, вживаний в медицині як наркотичний засіб, окиснюватиметься киснем повітря до токсичного нитроген(II) оксиду, якщо
GУТВ..(N2О) = 104кДж/моль, а GУТВ.(NО) = 87кДж/моль.
6
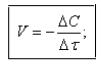
(відповідь: G = 140кДж/моль, значить реакція окиснення неможлива)
5. У циклі Кребса ізоцитрат перетворюється на α-кетоглутарат: ізоцитрат + 1/2О2(г)+ Н+ → α-кетоглутарат +Н2О(р) +СО2(г).
Розрахуйте G цієї реакції, якщо GУТВ.(ізоцитрату)= –1166,6кДж/моль, GУТВ. (α-кетоглутарату) = – 796,8кДж/моль,
ΔGУТВ.(СО2) = –394,4 кДж/моль; ΔGУТВ.(Н2О) = –237 кДж/моль. (відповідь: – 267,2кДж/моль)
6.Визначити тепловий ефект реакції синтезу діетилового етеру, вживаного в медицині для наркозу, за 2980К:
2С2Н5ОН(р) → С2Н5ОС2Н5 (р) + Н2О(р), якщо відомі стандартні теплоти згоряння речовин, що беруть участь в реакції: НСГОР.(С2Н5ОС2Н5 ) = – 2727кДж/моль; НСГОР.(С2Н5ОН)(р) = – 1371кДж/моль.
(відповідь: – 15кДж/моль)
7.Одним із шляхів метаболізму глюкози є процес:
С6 Н12 О6 (Р-Н) → С3 Н7 СООН(р) + СО2(Г) + Н2(Г). Розрахувати ∆G
реакции, если ∆G (С6 Н12 О6 (Р-Н)) = – 917,0кДж/моль,
∆G(С3 Н7 СООН(р)) = – 376кДж/моль, ∆G(СО2(Г) ) = – 394,4кДж/моль.
(відповідь: – 247,8 кДж/моль)
КІНЕТИКА БІОХІМІЧНИХ ПРОЦЕСІВ
Хімічна кінетика – це вчення про швидкість та механізм хімічних реакцій.
Швидкість хімічної реакції – це зміна концентрації однієї із
реагуючих речовин за одиницю часу і в одиниці об'єму (для гомогенних реакцій) або на одиниці поверхні (для гетерогенних реакцій).
для гомогенних реакцій: |
V |
|
|
; |
|
|
|
||||
|
|
||||
для гетерогенних реакцій: |
V |
|
. |
||
|
|||||
|
|
|
S |
||
Швидкість хімічної реакції залежить від природи реагуючих речовин, концентрації, температури.
Закон діючих мас – швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин, зведених в ступені, рівних стехіометричним коефіцієнтам.
Наприклад, для реакції аА + bВ → сС
7

V=k [A]a • [B]b
де k – константа швидкості хімічної реакції; вона дорівнює швидкості хімічної реакції за концентрації речовин 1моль/л і залежить від природи речовин та температури.
Правило Вант – Гоффа – під час збільшення температури на 100 швидкість хімічної реакції збільшується в 2 – 4 рази.
Vt2 |
|
t(2) t(1) |
або |
k2 |
|
t(2) t(1) |
|
|
10 |
|
10 |
||||
|
|||||||
Vt1 |
k1 |
||||||
|
|
|
|
|
де γ– температурний коефіцієнт. який показує в скільки разів змінюється швидкість хімічної реакції під час підвищення температури на 100С. Енергія активації – Еа – це найменша надмірна енергія активної молекули, завдяки якій можлива хімічна реакція.
Рівняння Ареніуса:
або
Приклади розв`зання задач
1. В скільки разів зміниться швидкість хімічної реакції
NO(Г)+ Cl2(Г) → NOCl(Г), якщо концентрацію NO збільшити в 2рази?
[NO]2 = 2 [NO]1; |
1) Запишемо рівняння реакції: |
|||||||||||||
|
|
|
|
|
|
|
|
|
2 NO(Г)+ Cl2(Г) → 2 NOCl(Г) ; |
|||||
|
V2 |
|
|
|
|
|
|
|
||||||
|
? |
|
|
|
2) Залежність швидкості реакції від концентрації |
|||||||||
|
|
|
|
|||||||||||
|
V1 |
|
|
|
|
|
показує закон діючих мас: |
|||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
V1 = k [NO]2 • [Cl2]; |
|||||
3) Після збільшення концентрації NO рівняння має вигляд: |
||||||||||||||
|
|
|
|
|
|
|
V2 = k [2 NO]2 • [Cl2]; |
|||||||
4) Знаходимо зміну швидкості: |
|
|
||||||||||||
|
|
V |
2 |
|
|
k 2NO 2 Cl |
2 |
|
22 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
4. |
||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
V1 |
k NO 2 Cl2 |
1 |
|
||||||||
Відповідь: швидкість збільшиться в 4рази.
2. Як зміниться швидкість реакції А + В2 → АВ, яка протікає в закритій посудині, якщо тиск в системі збільшити в 5 разів?
Р2 = 5 Р1; 1) Запишемо рівняння реакції: 2 А + В2 → 2 АВ; 2) У закритій посудині тиск може збільшитися в
V2 ? результаті збільшення концентрації. Якщо тиск
V1
збільшується в 5разів, то концентрація збільшиться в 5разів.
3)Залежність швидкості реакції від концентрації показує закон діючих мас до підвищення тиску: V1 = k[А]2 • [В];
4)Після збільшення тиску і, відповідно, збільшення концентрації
рівняння має вигляд: |
V2 = k [5 А]2 • [5В]; |
8
5) Знаходимо зміну швидкості:
|
V2 |
|
k 5A 2 5B |
|
|
52 |
5 |
125. |
|
V1 |
k A 2 B |
|
1 |
||||
|
|
|
|
|
||||
Відповідь: швидкість збільшиться в 125разів.
3. В скільки разів зміниться швидкість реакції NO(Г)+ Cl2(Г) → NOCl(Г),
якщо тиск |
в системі зменшити в 4раза? |
||
Р1 = 4Р2; |
1) Запишемо рівняння реакції: 2NO(Г)+ Cl2(Г) → 2NOCl(Г), |
||
|
V2 |
? |
2) Якщо тиск зменшується в 4рази, то концентрація |
|
|||
|
V1 |
теж зменшиться в 4рази. |
|
|
|
|
|
3)Залежність швидкості реакції від концентрації показує закон діючих мас. до збільшення тиску: V1 = k [А]2 • [В];
4)Після зменшення тиску і, відповідно, зменшення концентрації
рівняння має вигляд: |
V2 = k [1/4 А]2 • [1/4 В]; |
|||||||
5) Знаходимо зміну швидкості: |
|
|
|
|||||
|
V2 |
|
k 1/4 A 2 1/4 B |
|
|
0,253 |
0,0156.. |
|
|
|
1 |
||||||
|
V1 |
k A 2 B |
|
|
||||
(відповідь: швидкість зменшиться в 1 / 0,0156 разів, тобто в 64 рази)
4.Константа швидкості реакції С + 2D → K складає 0,4 л2/моль• сек. Концентрація речовини С = 3моль/л, а речовини D = 4моль/л.
Обчислити швидкість прямої реакції.
[С] = 3моль/л; |
1) Запишемо рівняння реакції: С + 2D → K; |
[D] = 4моль/л; |
2) Залежність швидкості реакції від концентрації |
k = 0,4 л2/моль• сек; |
показує закон діючих мас: |
|
V = k [C] • [D]2; |
|
|
V = ? |
3) Підставляємо дані із задачі, та обчислюємо |
|
швидкість: |
|
|
|
V = 0,4• 3 • 4 = 4,8 моль/ л • сек. |
|
Відповідь: швидкість реакції 4,8моль/ л•сек. |
5. Константа швидкості розпаду пеніциліну за 360С становить 6· 10¯6 сек¯1 , а за 410С – 1,2· 10¯5 сек¯1. Обчислити температурний коефіцієнт реакції.
k (360С) = 6· 10¯6 сек¯1 ; |
|
|
1) Використовуємо правило Вант – Гоффа: |
|||||||||
|
||||||||||||
|
|
|
|
k2 |
|
t(2) t(1) |
|
41 36 |
5 |
|
||
k(410С) = 1,2· 10¯5 сек¯1 ; |
|
|
|
|
|
; звідси |
|
|
1,2 10 |
|
2; |
|
|
|
|
10 |
10 |
|
|||||||
|
|
|
k1 |
0,6 10 5 |
||||||||
|
|
|
|
γ 0,5=2; |
γ = 4. |
|
|
|
||||
V = ? |
|
|
|
|
|
|
|
γ = 4. |
||||
|
|
|
|
|
9 |
Відповідь: |
||||||
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||
6.В скільки разів збільшиться швидкість реакції, якщо температуру підвищити на 300 (γ = 3)?
t = 300; 1) Залежність швидкості реакції від температури
γ =3; |
|
показує правило Вант-Гоффа: |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
t(2) t(1) |
|
|
|
V2 |
|
? |
|
|
V(t2) |
|
; |
|||||
|
|
|
|
10 |
|
||||||||
|
V1 |
|
|
|
|
V(t1) |
|||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
2) Підставляємо дані із умови задачі: |
|||||||||
|
|
|
|
|
V(t2) |
|
30 |
|
33 81. |
Відповідь: 81раз |
|||
|
|
|
|
|
10 |
||||||||
|
|
|
|
|
|
||||||||
V(t1)
7.В результаті збільшення температури на 200 швидкість реакції
збільшилася в 16 разів. Обчислити температурний коефіцієнт реакції. Δt = 200; 1) Залежність швидкості реакції від температури
V2 = 16V1; показує правило Вант-гоффа:
γ = ? |
V(t2) |
|
t(2) t(1) |
||
|
10 |
; |
|||
|
|||||
V(t1)
2)Підставляємо дані із умови задачі:
V(t2) |
20 |
16 = γ2, |
γ = 4. |
10 ; |
V(t1)
Відповідь: γ= 4
8.У скільки разів зміншиться швидкість реакції, якщо температура в ході реакції змінилася з 180С до 380С, а температурний коефіцієнт
становить 3?
t1 = 180С; 1) Залежність швидкості реакції від температури
t2 = 380С; показує правило Вант-Гоффа:
γ = 3; |
|
V(t2) |
|
|
t(2) t(1) |
|
||||||
|
|
10 |
|
; |
||||||||
|
|
|||||||||||
|
|
|
|
V(t1) |
|
|
|
|
|
|||
|
|
|
2) Підставляємо дані із умови задачі: |
|||||||||
|
V2 |
|
|
V(t2) |
|
|
38 18 |
32 9. |
||||
|
? |
|
3 |
10 |
|
|||||||
|
V1 |
|
|
V(t1) |
||||||||
|
|
|
|
|
|
|
|
|
||||
Відповідь: 9разів.
Задачі для самостійного розв`язання
1) У скільки разів зміниться швидкість хімічної реакції
N2(Г)+ Н2(Г) → NН3(Г), якщо концентрацію Н2 збільшити в 2 рази? (відповідь: 8разів)
2)Як зміниться швидкість реакції С2 +D → CD, яка протікає в закритій посудині, якщо тиск в системі збільшити в 4 рази?
(відповідь: збільшиться в 64рази)
3)Як зміниться швидкість хімічної реакції SO2 + O2 → SO3, якщо концентрацію кисню зменшити в 2 рази?
(відповідь: зменшиться в 2 рази)
10
