
u_poverh_javl
.pdf
Поверхневі явища |
1 |
ПОВЕРХНЕВІ ЯВИЩА
До поверхневих належить ряд явищ, зв'язаних з особливими властивостями поверхневого шару — перехідної області між двома стичними фазами.
Міжфазні поверхні існують тільки в гетерогенних системах, де є рідка або тверда фаза. До таких систем, зокрема, належать рослинний і тваринний світ, ґрунт тощо. Усі об'єкти колоїдної хімії, які будуть детально розглянуті далі, також є гетерогенними системами з великими міжфазними поверхнями. М. П. Пєсков писав, що з фактором існування у колоїдних системах поверхні поділу зв'язані усі найістотніші та найхарактерніші властивості колоїдів.
ПОВЕРХНЕВА ЕНЕРГІЯ. ПОВЕРХНЕВИЙ НАТЯГ. КОГЕЗІЯ ТА АДГЕЗІЯ. ЗМОЧУВАННЯ ПОВЕРХНЕВА ЕНЕРГІЯ. ПОВЕРХНЕВИЙ НАТЯГ
Виникнення поверхневих явищ зумовлено силами міжмолекулярної взаємодії, котрі особливо яскраво виявляються на міжфазних межах поділу. На рис. 19.1. схематично зображена геометрична поверхня поділу рідина—газ (лінія АВ). Покажемо, що енергетичний стан молекул, розташованих біля геометричної межі поділу і в об'ємі фаз, відрізняється.
Довільно обрана молекула а в об'ємі рідини або іншої фази притягується усіма оточуючими молекулами, розміщеними на відстані порядку радіусу сфери дії молекулярних сил
δ ~ 10-9 м. Внаслідок симетричного розташування частинок сили притяжіння між ними взаємно урівноважуються і їх рівнодіюча дорівнює нулю. Для молекул в, с, d поблизу поверхні частина сфери дії міжмолекулярних сил міститься в іншій фазі (наприклад, у газі). (рис) Інтенсивність міжмолекулярної взаємодії у газі менша, ніж у рідині, бо концентрація молекул у газоподібній фазі незрівнянно менша, ніж у рідкій. Рівнодіюча міжмолекулярних сил у цьому випадку не рівна нулю і направлена перпендикулярно до поверхні поділу фаз. Ця сила, віднесена до одиниці площі поверхні поділу, називається внутрішнім тиском
Отже, молекули, розташовані поблизу геометричної
поверхні поділу на відстані, меншій δ, завжди перебувають під дією сили, яка намагається втягнути їх усередину фази. Цим пояснюється прагнення рідини зменшити поверхню до мінімальної. З курсу математики відомо, що поверхня кулі буде найменшою при даному об'ємі, і тому крапля рідини має сферичну форму при відсутності гравітаційного поля.
Збільшення площі поверхні поділу фаз зв'язане з переходом молекул із глибини фази на поверхню, для чого необхідно виконати роботу проти сил внутрішнього тиску. Ця робота dW в оборотних ізотермічних умовах пропорційна площі поверхні dS, яка утворюється:
dW = σdS |
(19.1) |
де σ — коефіцієнт пропорційності, який називається поверхневим натягом. Фізичний зміст σ полягає в тому, що він чисельно дорівнює роботі утворення одиниці поверхні. Робота, витрачена на збільшення площі поверхні, перетворюється у потенційну енергію молекул поверхневого шару. Звідси випливає, що молекули поверхневого шару набувають надлишкового запасу енергії порівняно з молекулами усередині фази, який називається поверхневою енергією. В залежності від умов (р = соnst або V = соnst) збільшується енергія Гіббса GS або енергія Гельмгольца FS. Тоді фізичний зміст поверхневого натягу може бути розшифрований як питома надлишкова поверхнева енергія, або це сила, яка намагається скоротити вільну поверхню тіла до найменших можливих меж. Розмірність поверхневого натягу [σ] = Дж/м2 = Н/м. Величина σ є важливою молекулярною константою (при Т = соnst). Разом з такими параметрами, як дипольний момент μ, поляризовність α та діелектрична проникність є, вона характеризує інтенсивність поля молекулярних сил, яка позначається загальним терміном полярність рідини.
Поверхневий натяг залежить від температури, природы фаз, які контактують, концентрації розчинених речовин.
1.Підвищення температури веде до зниження поверхневого натягу на межі рідина-газ.
2.Поверхневий натяг в значній мірі визначається природою рідини, особливо її полярністю. Саме полярність визначаєсилу взаимодії між молекулами рідини. Чим більш полярна рідина, тим вище її поверхневий натяг.

|
Поверхневі явища |
2 |
Типові значення (та розмірність!!!): Ртуть - 47,2 10-2 Н/м, вода 7,3 10-2 Н/м, сироватка |
||
крові людини - 4,6 10-2 Н/м, гексан - 1,8 10-2 Н/м. (Дж/м2) |
|
|
Поверхневий натяг на межі поділу рідини і газу, |
або двох рідин, що не змішуються, |
|
визначають експериментальне різними методами, які |
детально описані у спеціалізованій |
|
літературі. практичних посібниках. Пряме визначення σ твердих тіл неможливе, тому його оцінюють опосереднено. Міжфазний натяг на межі двох незмішуваних рідин можна розрахувати за правилом Антонова
σр-р = σ1р-г - σ2р-г |
(19.3) |
де σр-р — міжфазний натяг на межі поділу між насиченими розчинами першої рідини у другій та другої у першій;
σ1р-г — поверхневий натяг на межі з газом (повітрям) насиченого розчину рідини 2 у рідині
1;
σ2р-г — поверхневий натяг на межі з газом (повітрям) насиченого розчину рідини 1 у рідині
2.
З термодинаміки випливає, що будь-яка гетерогенна система прагне зменшити до
мінімуму поверхневу енергію GS =σ S (при р і Т = соnst). Це виражається або в самодовільному зменшенні міжфазної поверхні (при перекристалізації із насичених розчинів дрібні кристали самодовільно зростають; у дисперсних системах відбуваються процеси коагуляції, тобто змінюються форма та кривизна поверхні), або у зменшенні поверхневого натягу (процеси адсорбції тощо).
Поверхневий натяг розчинів відрізняється від поверхневого натягу чистого розчинника. Вещества, которые уменьшают поверхностное натяжение жидкостей называются поверхностно-активными, вещества, которые не изменяют или даже увеличивают поверхностное натяжение жидкостей называются поверхностно-инактивными.
Отже, наявність у міжфазних шарів надлишкової вільної енергії приводить до різноманітних поверхневих явищ. Їх можна умовно розділити на дві групи. До першої групи відносять явища, зв'язані із зміною форми поверхні поділу (змочування, адгезія тощо). До другої групи відносять, наприклад, адсорбцію, пов'язану із зміною складу поверхневого шару.
КОГЕЗІЯ ТА АДГЕЗІЯ
Взаємодія молекул, атомів, іонів всередині однієї фази (гомогенної частини системи) називається когезією (зчепленням).
Для рідин та багатьох твердих тіл когезійні сили є нічим іншим, як силами міжмолекулярної (ван-дер-ваальсової) взаємодії. Вона відрізняється від хімічної взаємодії відсутністю специфічності та насиченості, невеликими енергіями, виявленням на значно більших відстанях. Розрив міжмолекулярних зв'язків приводить до формування поверхні, здатної утворювати ван-дер-ваальсові та водневі зв'язки з молекулами, які потрапляють на цю поверхню.
Когезія відображує міжмолекулярну взаємодію всередині фази, тому її можуть характеризувати такі параметри, як енергія кристалічної решітки, внутрішній тиск, температура кипіння та ін. Але найбільш застосовною кількісною характеристикою стала так звана робота когезії, яка визначається витратою енергії на оборотний ізотермічний розрив тіла по перерізу, рівному одиниці площі. Через те, що при розриві утворюються дві нові поверхні, площа яких складає дві одиниці, робота когезії дорівнює подвоєному значенню поверхневого натягу на межі з газом:
|
Wc = 2 σ |
(19.4) |
Величину Wc називають ще когезійною міцністю, або міцністю на розрив (оборотний). |
||
Наприклад, для води при 298 К |
Wc = 2 σ = 2 7,2 10-2 = 14,4 10-2 Дж/м2 |
|
Ця робота витрачається на подолання сил зчеплення між однорідними молекулами води або іншої речовини.
Розглянемо інший випадок: на стовп води нашарований стовп бензолу. Якщо розділити його по поверхні поділу вода—бензол, утворюються дві нові поверхні: вода — повітря та бензол—повітря. Витрачена на це енергія дорівнює сумі поверхневих натягів на відповідних межах поділу. Одночасно зникне поверхня поділу вода — бензол, тобто звільниться енергія, рівна поверхневому натягу на межі вода — бензол. Робота, витрачена на подолання сил
Поверхневі явища |
3 |
зчеплення між молекулами двох взаємно нерозчинних рідин на одиниці площі, називається
роботою адгезії.
Wa = σ1,2 + σ3,2 - σ1,3 |
(19.5) |
де σ1,2 — поверхневий натяг на межі вода—повітря (7,2 10-2) - поверхневий натяг на межі бензол—повітря (2,8 10-2)
σ1,3 - поверхневий натяг на межі вода—бензол (3,5 10-2). Цей вираз називається рівнянням Дюпре.
Адгезія може також спостерігатися між рідиною та твердим тілом або між двома твердими тілами.
Було запропоновано використовувати роботу когезії та роботу адгезії як критерії явища розтікання. Припустимо, що на деяку поверхню (на рідку, або на тверду – назовемо її підкладкою – рус - подложка) нанесено краплю рідини. Якщо сили притягання між молекулами рідини більші, ніж сили притягання між молекулами рідини і молекулами підкладки, то рідина збереже форму краплі і розтікання не буде. Навпаки, якщо когезія рідини буде менша адгезії по відношенню до підкладки, відбудеться її розтікання по поверхні. Звідси випливає, що критерієм розтікання може служити різниця
f = Wa – Wc
якa носить назву коефіцієнта розтікання.
Якщо f > 0, то рідина буде розтікатися по поверхні. Так, робота когезії Wc для бензолу складає 5.6 10-2 Дж/м2, а робота адгезії для системи вода—бензол — 6.5 10-2 Дж/м2, отже f = 0.9 10-2 > 0, тобто крапля бензолу, нанесена на водну поверхню, буде розтікатися.
А для сірковуглецю маємо Wa = 5,6 10-2 Дж/м2 Wc= 6,3 10-2 Дж/м2 Тобто f = - 0.7 10-2 Дж/м2 < 0 – cірковуглець по воді розтікатися не буде.
ЗМОЧУВАННЯ
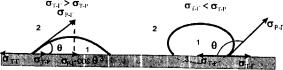
При нанесенні краплини рідини на поверхню твердого тіла можна спостерігати два крайніх випадки: краплина приймає форму, близьку до сферичної (краплина води на поверхні парафіну), або вона розтікається по поверхні твердого тіла (краплина води на поверхні хімічно чистого скла) (рис.). Можливі також перехідні випадки в залежності від співвідношення інтенсивності міжмолекулярної взаємодії, з одного боку, між молекулами рідини, і з другого — між молекулами рідини та твердого тіла.
Сукупність явищ, які відбуваються на межі трьох фаз, називають змочуванням. Мірою змочування є
рівноважний кут, який нанесена краплина утворює з твердою поверхнею. Його визначають як кут між
поверхнею твердого тіла і дотичною в точці
дотику трьох фаз (рис.) і називають крайовим кутом або кутом змочування (θ ).
Крайовий кут завжди вимірюють з боку рідини, він може змінюватися в межах від 0 до 180°. Розглянемо випадок неповного змочування (рис. – ліва краплина). Змочування рідиною
твердого тіла можна представити як результат дії сил поверхневого натягу. Лінія, по якій поверхня поділу рідина (1) — газ (2) стикається з поверхнею твердого тіла (3), називається периметром змочування. Він є межею взаємодії даних трьох фаз. Таким чином, на одиниці
довжини периметру змочування діють три сили σр.г (в воздух), σт.г (←), σт.р (→). При утворенні
крайового кута θ всі три сили повинні урівноважувати одна одну. Умову рівноваги можна записати як
σт.р + σр.г cos θ = σт.г
звідки cos θ =......
де σт.р .... — поверхневі натяги відповідно на межах рідина—газ, тверде тіло—газ, тверде тіло—рідина.
Це — рівняння Юнга. Величину cosθ, яка характеризує здатність рідини змочувати поверхню, називають змочуванням і позначають В. Таким чином, повне незмочування
відповідає умові: θ = 180°, В = соsθ = —1; повне змочування: θ = 0°, В = соsθ =1. Наприклад, вода на поверхні різних твердих тіл в атмосфері повітря утворює такі крайові кути: в = 0° (кварц), 9 = 69° (тальк), в= 106° (парафін), в= 108° (фторопласт).
Поверхневі явища |
4 |
Тверда поверхня тим краще змочується рідиною, чим менші сили зчеплення між утворюючими її молекулами (когезія) і чим більші сили прилипання між молекулами рідини і твердого тіла (адгезія). Тому критерій змочування можна виразити через роботу адгезії Wа і
роботу когезії Wc . Для системи тверде тіло—рідина можна записати Wа = σр-г + σт-г - σт-р . Приймаючи до уваги вираз для cos θ, маємо
Wа = σр-г (1+ cos θ ) |
(19.7) |
Одержане співвідношення називають рівнянням |
Дюпре—Юнга. Воно дозволяє |
розрахувати роботу адгезії за експериментальне виміряними значеннями σр-г і θ. Звідси видно, що чим більша адгезія, тим більший соsθ, тобто змочування.
Wc = σр-г отже, рівняння (19.7) можна записати у вигляді:
соs θ = |
2 W a−W c |
|
W c |
||
|
Таким чином, чим більша різниця між роботами адгезії та когезії (тобто коефіцієнт розтікання f) тим краще рідина змочує поверхню.
Великий практичний інтерес має випадок змочування на межі зіткнення твердої фази з двома незмішуваними рідинами, які відрізняються за молекулярною природою (полярною, наприклад, водою, і неполярною, наприклад, вуглеводнем).
Запропоновано для таких випадків ввести поняття вибіркового змочування. Про рідину, яка краще змочує тверду поверхню, говорять, що вона виявляє вибіркове змочування. Якщо
вода вибірково змочує тверду поверхню (θ<90°, В>0), то останню називають гідрофільною (олеофобною). Речовини з гідрофільними поверхнями: кварц, целюлоза, силікат, гіпс, скло та ін.
Якщо ж тверде тіло краще змочується неполярним вуглеводнем, а для води θ>90° В<0, то його поверхня називається гідрофобною (олеофільною). Речовини з гідрофобними поверхнями: графіт, вугілля, тальк, сірка, парафін, сульфіди важких металів та ін.
Згідно із другим законом термодинаміки, змочування є самодовільним процесом, оскільки воно супроводжується зменшенням поверхневої енергіії, отже при змочуванні повинно виділятися тепло. Теплота змочування може бути критерієм змочування в тих випадках, коли
неможливо експериментальне визначити θ, наприклад, при змочуванні рідиною порошків.
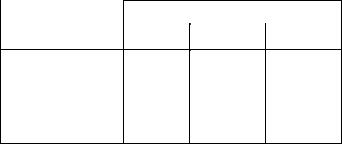
Речовина |
Теплота змочування, Дж/г |
|||
|
|
|
||
водою |
гексаном |
бензолом |
||
|
||||
|
|
|
|
|
Вугілля активне |
31,8 |
93,2 |
|
|
Графіт |
6,3 |
6,7 |
|
|
Сілікагель |
38,1 |
18,4 |
|
|
Крохмаль |
96,1 |
|
5,4 |
|
Агар -агар |
145,9 |
|
4,2 |
|
|
|
|
|
|
Це має велике значення для медицини, технології ліків та інших галузей науки та виробництва. Знаходячи теплоти змочування поверхні полярним та неполярним розчинниками, можна оцінити її гідрофільність. Для визначення гідрофільності поверхонь порошкоподібних тіл запропоновано використовувати відношення теплоти змочування її водою Q1 до теплоти змочування бензолом (або гексаном) Q2:
β = Q1/ Q2
Для гідрофільної поверхні маємо β > 1, для гідрофобної — β < 1.
АДСОРБЦІЯ
КОРОТКИЙ ОГЛЯД СОРБЦІЙНИХ ПРОЦЕСІВ ТА ЇХ КЛАСИФІКАЦІЯ
Якщо внести у водний розчин оцтової або іншої карбонової кислоти тверду речовину, наприклад, порошок активного вугілля, то на поверхні поділу фаз, що утворилася, відбудеться накопичення молекул розчиненої речовини. Причому далі поверхневого шару це переміщення молекул не відбувається. Аналогічне явище буде спостерігатися при контакті вугілля з повітрям, в якому є фосген, хлор, або інші гази у стані, далекому від насичення.

Поверхневі явища |
5 |
Розглянемо інший приклад. Якщо порошок оксиду кальцію привести у контакт із диоксидом вуглецю, диспергованим у повітрі, то збільшення концентрації газу у поверхневому шарі буде супроводжуватися хімічною реакцією з утворенням нової твердої фази — карбонату кальцію. Крім цього, диоксид вуглецю буде проходити із поверхневого шару усередину зерен порошку, утворюючи і там карбонат кальцію. Отже, процес відбувається не тільки на поверхні, але й у об'ємі системи.
Наведені приклади не вичерпують всіх явищ, які мають місце у гетерогенних системах і зв'язані із зміною концентрації компонентів. Усі подібні процеси мають назву сорбційних. Отже, сорбцією називають зміну концентрації одного або декількох компонентів у гетерогенній системі. Сорбентами називаються поглинаючі речовини, незалежно від їх агрегатного стану і ступеню дисперсності (наприклад, тверді сорбенти — активне вугілля, силікагель; рідкий сорбент — краплі емульсії; газоподібний сорбент — бульбашки піни).
Розглянемо в першу чергу тверді сорбенти. Процеси, які завершуються в поверхневому шарі, можна розділити на адсорбцію та поверхневі хімічні реакції. Приклади адсорбції хлору із повітря та з розчину на вугіллі були наведені вище. Поверхнева хімічна реакція відбувається, наприклад, між вугіллям та киснем повітря, внаслідок чого утворюються оксиди різного складу із кислотними та основними властивостями, але в системі не
утворюється нова фаза - або (-с=о)-O- (-с=о) - або ≡C-O-C≡ Процеси, які проходять не тільки на поверхні, але й у об'ємі твердого сорбенту,
поділяють на абсорбцію, хемосорбцію і капілярну конденсацію. Прикладом абсорбції може служити поглинання водню платиною або нікелем. Хемосорбція спостерігається при поглинанні диоксиду вуглецю оксидом кальцію, вона супроводжується збільшенням кількості фаз у системі, на відміну від поверхневих хімічних реакцій. Капілярна конденсація відбувається при контакті пористих сорбентів із парою, яка легко конденсується: води, спирту, бензолу та інших рідин.
На поверхні рідин або газів різного ступеню дисперсності сорбційним процесом буде адсорбція, наприклад, на межі поділу повітря—рідина, або рідина—рідина, як це має місце у пінах або емульсіях.
Абсорбція спостерігається при поглинанні інертного газу усім об'ємом рідкої фази, а хемосорбція — при хімічній взаємодії, наприклад, при поглинанні аміаку краплями води або розчином хлороводневої кислоти. На відміну від хемосорбції на твердих сорбентах, у такому випадку звичайно відсутні умови створення нової фази.
З усіх наведених явищ адсорбція найбільш поширена у природі, вона відіграє важливу роль у процесах життєдіяльності рослинних та тваринних організмів і людини. Велике значення адсорбція має для колоїдної хімії, гетерогенного каталізу, у фармації. Тому зупинимось більш докладно на описанні явища адсорбції.
АДСОРБЦІЯ. ОСНОВНІ ПОНЯТТЯ ТА ВИЗНАЧЕННЯ. ФУНДАМЕНТАЛЬНЕ РІВНЯННЯ АДСОРБЦІЇ ГІББСА
Адсорбцією називається процес самодовільної зміни концентрації компонента у поверхневому шарі, порівняно із об'ємом фази.
Зміні концентрації речовини у поверхневому шарі, яка проходить в результаті дії міжмолекулярних сил, буде перешкоджу-вати тепловий рух молекул, що намагається вирівняти концентрацію компонента в усіх частинах системи. Внаслідок дії цих протилежних факторів у системі через деякий час встановлюється адсорбційна рівновага, при якій концентрація речовини у поверхневому шарі буде більшою (позитивна адсорбція) або меншою (негативна адсорбція), порівняно з її концентрацією у об'ємі фази.
Речовину, на поверхні якої проходить адсорбція, називають адсорбентом. Речовину, концентрація якої змінюється у поверхневому шарі, називають адсорбтивом (іноді
адсорбатом).
Кількість адсорбованої речовини визначають експериментальне, знаходячи тиск або концентрацію адсорбтиву до і після адсорбції. Часто кількість речовини, яка адсорбована твердим тілом, визначають ваговим методом за зміною маси адсорбенту.
Адсорбцію прийнято виражати кількома способами:
1. Запропонованою Пббсом величиною Г, яка дорівнює різниці між фактичною кількістю адсорбтиву в об'ємі поверхневого шару площею 1 м2 та кількістю його у такому ж об'ємі фази, при умові, що біля міжфазної межі концентрація адсорбтиву не змінюється.

Поверхневі явища |
6 |
2. Величиною А (або а), яка представляє собою кількість адсорбтиву, що міститься в об'ємі адсорбційного шару і припадає на одиницю поверхні адсорбенту (абсолютна адсорбція). Для пористих твердих адсорбентів точно визначити площу поверхні важко і в таких випадках адсорбцію відносять до одиниці маси адсорбенту (моль/кг).
Значення А не збігається із гіббсовською величиною адсорбції Г, тому що воно дорівнює загальній кількості адсорбтиву в поверхневому шарі, а Г — надлишок адсорбтиву в цьому шарі порівняно з об'ємом фази. Однак якщо взяти до уваги, що при адсорбції газів та пари, а також речовин із розведених розчинів кількість адсорбтиву в об'ємі набагато менша, ніж у поверхневому шарі, то і А мало відрізняється від істинної адсорбції Г, тобто можна .вважати А ≈ Г.
Внаслідок адсорбції відбувається насичення частини незбалансованих сил взаємного притягання молекул, яке приводить, при р = const, до зменшення енергії Гіббса ( G < 0), а при V=const— енергії Гельмгольца ( F < 0). Тобто адсорбція є само-довільним процесом і G має від'ємне значення G = H — T S < 0. Якщо взяти до уваги, що до адсорбції молекули адсорбтиву можуть рухатися у трьох напрямках, а, будучи адсорбованими, вони або міцно утримуються поверхнею, або рухаються по ній у двох напрямках, то процес адсорбції буде супроводжуватися зниженням ентропії ( S < 0). Звідси випливає, що H < 0, тобто адсорбція є екзотермічним процесом.
Теплота адсорбції H є важливою термодинамічною характеристикою адсорбційного процесу. Вона може бути мірою інтенсивності сил взаємодії молекул адсорбтива з поверхнею адсорбенту.
Гіббс застосував закони термодинаміки до поверхневих явищ і не ураховуючи природи сил, які приводять до адсорбції речовин на межі поділу фаз, та механізму явища, вивів рівняння
зв'язку між адсорбцією Г та зміною поверхневого натягу σ з концентрацією розчину. Так, для розрахунку адсорбції в реальному розчині придатне рівняння Гіббса у такій формі:
Γ =− RTa dσda
де а — рівноважна активність речовини у об'ємі розчину.
У розведених розчинах можна вважати а ≈ с, де с — рівноважна концентрація речовини, тоді рівняння застосовують у менш строгому запису
Γ =− |
c |
dσ |
(20.2) |
|
RT |
||||
|
dc |
|
Для ідеальних газів
Γ =− RTp dσdp
Отримане Гіббсом рівняння ізотерми адсорбції є найважливішим термодинамічним рівнянням, справедливим для будь-яких складів та різних меж поділу фаз: рідина—газ, газ— тверде тіло, рідина—рідина. Експериментальна перевірка рівняння Гіббса дала задовільний збіг дослідних та обчислених величин Г.
Для теоретичного розрахунку адсорбції необхідно знати похідну |
dσ |
(або |
dσ |
) |
яку |
dc |
da |
знаходять із експериментально отриманої залежності σ=f(с). Але на сьогодні не існує надійних прямих методів вимірювання σ на межі твердих тіл з газом або розчином, тому рівняння Гіббса практично застосовується для розрахунку адсорбції тільки на рідких поверхнях.
З рівняння Гіббса випливає, що при - |
dσ |
> 0 Г > 0, при - |
dσ |
<0 |
Г< 0, а при - |
dσ |
=0 Г= 0. Було |
dc |
dc |
dc |
dσ
запропоновано величину - dc прийняти за міру здатності речовини знижувати вільну поверхневу
dσ
енергію на даній межі поділу, позначивши її g та назвавши поверхневою активністю: g = - dc .
Величина похідної залежить від концентрації, тому, щоб виключити її вплив, беруть граничне значення g при а —> 0 (с -> 0). Тому не так давно, а саме у 1987 було дано
dσ |
a 0 |
визначення поверхневої активності у вигляді g= − da |
Поверхневі явища |
7 |
Поверхнева активність є важливою адсорбційною характеристикою речовини, яка визначає її властивість та області застосування.
Якщо із збільшенням концентрації речовини поверхневий натяг на межі поділу фаз знижується, то така речовина називається поверхнево-активною. Речовини, які збільшують поверхневий натяг на межі поділу фаз із збільшенням концентрації, називаються поверхневоінактивними.
Далі основні закономірності адсорбційних явищ викладені окремо для різних меж поділу фаз. Таке розділення в деякій мірі умовне і дається для зручності, тому що більшість положень виявляються загальними для будь-якої міжфазної межі.
АДСОРБЦІЯ НА МЕЖІ ТВЕРДЕ ТІЛО—ГАЗ Загальні положення
Адсорбція на поверхні твердих тіл має велике практичне значення. Майже всі адсорбенти і каталізатори, які використовують в хімічній та фармацевтичній промисловостях, а також для хімічної оборони, є твердими тілами. Внаслідок цього процеси адсорбції на твердих тілах були предметом численних досліджень.
Досліди щодо поглинання газів вугіллям проводилися ще у 1773 році. Але істинним поштовхом на цьому шляху стали війскові потреби, а саме необхідність розробки надійних протигазів.
Отже, у випадку твердих адсорбентів краще розглядати не надлишок Г, а всю кількість адсорбтива на поверхні А. Але, як зазначалось вище, різницею між А і Г в більшості випадків можна знехтувати і всі рівняння адсорбції, до яких входить величина А, будуть вірними, якщо замінити А на Г.
Складність структури поверхні твердих тіл, неоднорідність їх геометричної будови, наявність домішок та ін. приводить до енергетичної неоднорідності поверхні.
Поверхневі молекули, атоми чи іони кристалічної решітки твердого тіла, подібно поверхневим молекулам рідини, мають неврівноважену частину силового поля, причому результуюча сила направлена всередину твердого тіла. Внаслідок цього тверді тіла, так само як і рідини, мають певний запас вільної поверхневої енергії і намагаються зменшити її величину до мінімуму. Вільна енергія поверхні твердого тіла може бути знижена в результаті адсорбції речовин, частинки яких мають силове поле меншої інтенсивності, ніж у частинок твердого тіла.
Таким чином, на поверхні твердого тіла можуть адсорбуватись речовини, які знижують його поверхневий натяг. При адсорбції газу на поверхні процес може проходити двояко: або взаємодія між поверхнею твердого тіла і газом виражена слабо і носить характер, подібний конденсації газу, або взаємодія виражена сильно і стає подібною хімічній реакції. В першому випадку процес відбувається внаслідок дії міжмолекулярних сил (орієнтаційний, індукційний та дисперсійний ефекти) і називається фізичною (або ван-дер-ваальсовою) адсорбцією. Повну потенціальну енергію двох взаємодіючих атомів (молекул) задовільно описує рівняння Леннарда—Джонса: U(r) = b/r12 – c/r6
(20.4)
де b і с — константи.
У другому випадку має місце хімічна адсорбція (хемосорбція).
Фізична адсорбція відбувається спонтанно і оборотне. Адсорбтив намагається зайняти всю поверхню адсорбенту, але цьому заважає процес, зворотний адсорбції, — десорбція, викликана прагненням до рівномірного розподілу молекул речовини в результаті теплового руху. Для кожної концентрації адсорбтиву встановлюється динамічна адсорбційна рівновага, причому достатньо швидко. Теплота фізичної адсорбції має порядок величини теплоти конценсації газів (~ 10-20 кДж/моль). Із зростанням температури фізична адсорбція зменшується.
Хімічна адсорбція вибіркова і більш чутлива до хімічної природи адсорбенту і адсорбтиву, ніж фізична адсорбція. Між адсорбентом і адсорбтивом виникає хімічний зв'язок, і вони втрачають індивідуальність. Теплоти хемосорбції в більшості випадків високі (~ 100-200 кДж/моль). Швидкість хімічної адсорбції невелика, особливо при низьких температурах. З підвищенням температури її швидкість збільшується. Хемосорбція в більшості випадків необоротна.
Слід зауважити, що на практиці є велика кількість різних форм адсорбції, перехідних між описаними вище граничними випадками. Наприклад, виникнення водневого зв'язку при
Поверхневі явища |
8 |
адсорбції таких речовин, як вода, спирти, аміни, аміак, на адсорбентах, що мають на поверхні гідроксильні групи (силікагель, алюмогель та ін.), було доведено численними дослідами, зокрема, за допомогою інфрачервоної спектроскопії. Так, при адсорбції води на гідроксильованій поверхні силікагелю утворюється водневий зв'язок (навести можливі схеми)
Теплота адсорбції за рахунок водневого зв'язку складає 20—40 кДж/моль, тобто вона близька до фізичної адсорбції.
Теорії адсорбції
Основним завданням теорії адсорбції є моделювання і математичний опис процесу адсорбції, а саме, знаходження функціональної залежності між величиною адсорбції (А чи Г) і двома основними термодинамічними параметрами стану: температурою Т і тиском р (або концентрацією с). Такі рівняння називаються рівняннями оборотної сорбції.
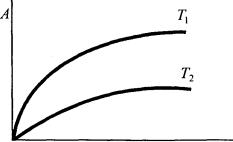
Найчастіше вивчають адсорбційну рівновагу при умові сталості одного з параметрів. Наприклад, рівняння вигляду А = f/(р) або Г = ϕ(с), що встановлює зв'язок величини адсорбції з тиском або концентрацією при Т = const, називають ізотермою адсорбції. На рис. схематично зображені характерні ізотерми адсорбції при утворенні мономолекулярного шару адсорбтиву.
Рівняння Фрейндліха. Перше ніж розглядати теорії, які встановлюють основні закономірності і дозволяють розрахувати величину адсорбції при даних значеннях р і Г, зупинимося на емпіричному рівнянні
Фрейндліха:
A=x/m=kp1/n |
(20.6) |
де х — кількість адсорбованої речовини; т — маса адсорбенту; р — рівноважний тиск
газу в системі; k і 1/n — константи. |
|
Для адсорбції із розчину на твердому адсорбенті рівняння Фрейндліха має вигляд: |
|
A=x/m=kc1/n |
(20.7) |
де с — рівноважна концентрація розчину.
Фізичний зміст константи k стає ясним, якщо прийняти р = 1 (або с = 1). k дорівнює величині адсорбції при рівноважній концентрації (або тиску), рівній 1. Показник 1/n є правильним дробом (лежить в межах 0,2-1 для адсорбції із газового середовища і 0,1-0,5 для адсорбції із розчину) і характеризує ступінь наближення ізотерми до прямої.
Константи k і 1/n визначають шляхом підстановки ряду експериментальних значень адсорбції А при різних рівноважних концентраціях с у лінійну форму рівняння Фрейндліха
lg A = lg k + 1/n lg c |
(20.8) |
Два наведених рівняння є рівняннями параболи і не можуть правильно описати ізотерму адсорбції в широкому інтервалі концентрацій (або тисків). Прямолінійну частину ізотерми (область низьких концентрацій або тисків) можна охарактеризувати за допомогою рівняння Фрейндліха, якщо 1/n буде дорівнювати 1, а горизонтальна лінійна ділянка при великих концентраціях (тисках) може бути одержана тільки при 1/n = 0. Таким чином, для повного описання ізотерми адсорбції показник ступеня 1/n повинен бути функцією р або с.
В зв'язку з тим, що 1/n приймається сталим, рівняння Фрейндліха придатне для середніх концентрацій (тисків). Але незважаючи на це, емпіричне рівняння Фрейндліха широко використовується на практиці, зокрема в фармації, для орієнтовних розрахунків адсорбції на твердих адсорбентах.
Для аналітичного описання багатьох адсорбційних ізотерм найбільш вдалим є рівняння Ленгмюра, виведення якого ми і розглянемо далі.
Теорія Ленгмюра. І. Ленгмюр на початку XX століття запропонував теорію адсорбції газів на твердих тілах, використовуючи молекулярно-кінетичні уявлення.
При розробці теорії Ленгмюр спирався на експериментальні дані, що свідчили про адсорбційну неоднорідність поверхні твердого тіла. Наприклад, було встановлено, що отруєння каталізатора відбувається при адсорбції такої кількості «ядів», які можуть вкрити лише долі проценту поверхні твердого тіла. Аналізуючи ці результати, Тейлор прийшов до висновку, що, адсорбція проходить не на всій поверхні, а лише на особливих активних точках (кутах, ребрах кристалів, мікровиступах поверхні, там, де містяться атоми, що мають ненасичені вільні валентності.

Поверхневі явища |
9 |
Так, на поверхні вугілля містяться атоми вуглецю з вільними валентностями С= |
, які |
можуть приєднувати до себе, наприклад, атоми кисню: С=О Ленгмюр узагальнив накопичені експериментальні факти і сформулював основні
положення своєї теорії:
1.Адсорбція є локалізованою на адсорбційних центрах, кожен з яких взаємодіє тільки з однією молекулою адсорбтиву, в результаті чого утворюється мономолекулярний шар.
2.Адсорбційні центри є енергетичне еквівалентними.
3.Адсорбовані молекули не взаємодіють одна з одною.
4.Адсорбція є оборотним процесом.
Крім того, Ленгмюр вважав, що адсорбція відбувається за рахунок адсорбційних сил, які носять характер ван-дер-ваальсових сил.
Виходячи з наведених вище положень, Ленгмюр вивів загальне рівняння ізотерми локалізованої адсорбції, яке можна використовувати для описання не тільки адсорбції газів, але й розчинених речовин на різних межах поділу.
Розглянемо виведення рівняння ізотерми адсорбції для газів.
Припустимо, що поверхня твердого адсорбенту, яка має деяке число правильно розташованих в ній активних центрів, перебуває в контакті з газом. Відомо, що молекули в газовій фазі перебувають у тепловому русі. Вони можуть зіткатися з твердою поверхнею і затримуватися на активних центрах, тобто адсорбуватися на них. Адсорбовані молекули залишаються деякий час зв'язаними на активних центрах (цей час називають тривалістю життя в адсорбованому стані). Внаслідок флуктуації енергії деякі адсорбовані молекули відриваються від центрів і повертаються в газову фазу, тобто відбувається десорбція.
За Ленгмюром локалізовану адсорбцію можна представити квазіхімічним рівнянням, аналогічним рівнянню хімічної реакції:
Ă + В ĂВ, де Ă — адсорбційний центр; В — молекула речовини; ĂВ — адсорбційний комплекс, що
виникає на поверхні адсорбенту.
Припустимо, що на поверхні в 1 м2 частина θ зайнята адсорбованими молекулами, а частина 1—θ залишається вільною. Величина θ дорівнює відношенню адсорбованої кількості речовини А до максимальної її кількості А∞ при повному заповненні поверхні: θ= А/А∞ і є ступенем заповнення поверхні. Молекули адсорбуються, утворюючи мономолекулярний шар, тому на вже зайнятій частині поверхні вони не можуть адсорбуватись. Швидкість адсорбції vадс пропорційна тиску газу р (або об'ємній концентрації с газу чи розчину) і долі вільної поверхні 1
—θ. vадс = k1 c (1-θ). Швидкість десорбції vдeс пропорційна θ, оскільки цей процес відбувається лише на зайнятій поверхні: vдeс = k2θ. Адсорбційна рівновага встановлюється, коли швидкість адсорбції стає рівною швидкості десорбції. Тоді маємо: k1 c (1-θ) = k2θ.
Звідси: |
θ= А/А∞ = (k1 c )/ (k1 c+ k2) |
|
або |
А = (А∞ K c)/(1+Kc) |
(20.9) |
де К =k1/k2 є константою рівноваги адсорбції.
Вираз (20.9) називають рівнянням ізотерми мономолекулярної адсорбції Ленгмюра. Концентрації газів і пари пропорціональні парціальним тискам, тому для них ізотерма
адсорбції набуває вигляду: |
|
А = (А∞ K p)/(1+Kp) |
(20,10) |
Константи рівняння Ленгмюра мають певний фізичний зміст. А∞ (граничне значення адсорбції) є кількістю адсорбтиву, адсорбованого одиницею маси (або одиницею площі) адсорбенту, що відповідає повному заповненню всіх активних центрів. Величину А∞ ще називають
ємністю адсорбційного моношару, тому що вона дорівнює числу адсорбційних центрів, що припадає на одиницю площі поверхні або на одиницю маси адсорбенту (згідно з моделлю адсорбції за Ленгмюром). Фізичний зміст константи К стає зрозумілим, коли розв'язати рівняння (20.9) відносно К:
K=(1/c) (A/( А∞ - A))
Звідки К=1/с якщо друга скобка дорівнює одиниці. Отже, К – це величина, обернена до такої концентрації, при якої адсорбція
дорівнює половині граничного значення А = А∞ /2.
Поверхневі явища |
10 |
Рівняння Ленгмюра добре описує ізотерму адсорбції, даючи при малих і великих значеннях р (або с) приблизно лінійні ділянки на графіку (намалювати), чого не дає рівняння Фрейндліха. Дійсно, при дуже малих тисках можна знехтувати членом Кр в знаменнику рівняння (20.10), припускаючи Кр<<1, тоді одержимо: А = А∞. Кр = К'р (або А = К'с), тобто кількість адсорбованої речовини прямо пропорціональна рівноважному тиску, що і спостерігається на практиці. При великих значеннях р (с) в знаменнику рівняння Ленгмюра можна знехтувати одиницею порівняно з Кр (Кр»ї) і тоді маємо: А = А∞, тобто адсорбована кількість речовини не залежить від рівноважного тиску. Це відповідає прямолінійній ділянці ізотерми, яка йде паралельно осі тиску, що також узгоджується з експериментом. В області середніх тисків застосовують рівняння (20.10).
Для знаходження констант А∞ і К використовують лінійну форму рівняння Ленгмюра:
1 |
= |
1 |
|
|
1 |
|
1 |
||
A |
A |
A |
∞ |
K |
c |
||||
|
|
|
|||||||
|
|
∞ |
|
|
|
|
|
||
Зображуючи експериментальні дані графічно у вигляді залежності 1/A=f(1/c), легко знайти значення К і А∞ (рис). Із одержаних констант вперше були визначені реальні розміри органічної молекули колоїдно-хімічним методом, що стало значним досягненням теорії Ленгмюра.
Розраховані за формулою Ленгмюра величини адсорбції не завжди збігаються із значеннями, одержаними дослідним шляхом, що не дозволяє застосовувати рівняння (20.9) до всіх випадків адсорбції. Як вище було зазначено, теорія Ленгмюра вірна при умові утворення мономолекулярного шару. Ця вимога виконується досить строго для оборотної хемосорбції, фізичної адсорбції газів при невеликих тисках і температурах вище критичної (при відсутності конденсації на поверхні адсорбенту), а також при адсорбції із розчинів.
Але треба підкреслити, що теорія Ленгмюра не втратила свого практичного значення і в наш час. Вона застосовується для інженерних розрахунків в складних технологічних процесах, де адсорбція супроводжується конвекцією, дифузією та іншими явищами. Так, визначивші за даними експерименту граничну адсорбцію А∞ і знаючи площу S поперечного перерізу адсорбованої молекули, можна оцінити питому поверхню адсорбенту, каталізатора тощо:
Sпит = А∞ NA S |
(20.12) |
Теорія полімолекулярної адсорбції БЕТ. Багато експериментальних фактів свідчать про те, що утворення мономолекулярного шару не компенсує повністю надлишкову поверхневу енергію. Зв'язування адсорбтиву адсорбентом може продовжуватись і далі, що приводить до появи другого, третього і наступних адсорбційних шарів. Зокрема, таке явище спостерігається, коли гази і пара адсорбуються при температурах, нижчих за критичну. Для подібних випадків експериментальна ізотерма адсорбції має вигляд,
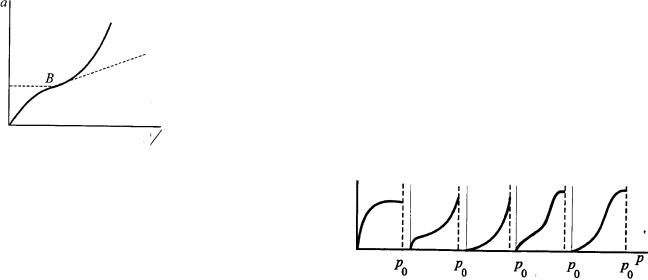
зображений на рис.
На відміну від ізотерми Ленгмюра, ця крива починаючи від точки В (точки перегину S-ізотерми) круто підіймається вгору. Такий вигляд ізотерми свідчить про те, що після утворення мономолекулярного адсорбційного шару адсорбція продовжується.
Було зроблено припущення, що другий адсорбційний шар починає заповнюватись саме від точки В. А коли було проаналізовано релальні ізотерми адсорбції на 30 різних адсорбентах, то вдалося поділити їх на п'ять основних типів. Ізотерма типу І характерна для випадку мономолекулярної адсорбції.
Ізотерми типу II - V звичайно зв'язують з
утворенням декількох адсорбційних шарів. Відміна між ізотермами II, III і IV, V полягає у тому, що в перших випадках (II, III) адсорбція збільшується нескінченно при наближенні до тиску насиченої пари ро (характерно для непористих адсорбентів), а в інших випадках (IV, V) спостерігається границя адсорбції при досягненні тиску насиченої пари ро (для пористих твердих тіл).
Ці ізотерми описуються теорією полімолекулярної адсорбції БЕТ, названої за початковими літерами її авторів (Брунауер, Еммет, Теллер). Вона є спробою дати уніфіковану теорію фізичної адсорбції. Авторами була збережена модель Ленгмюра, згідно з якою на поверхні
