
u_zadachi_2
.pdf4) |
В скільки разів зміниться швидкість реакції СО(Г)+ О2(Г) → СО2(Г), якщо |
|
тиск в системі зменшити в 3рази? |
|
(відповідь: швидкість зменшиться в 27раз) |
5) |
Константа швидкості реакції ацилування толуолсульфогидразиду |
етиловим естером щавлевої кислоти за 300С становить 2,34 л · мольˉ 1 · мін ˉ1. Обчислити початкову швидкість цієї реакції, якщо початкові концентрації реагентів однакові і складають по 0,05моль/л.
(відповідь: 0,00585моль/лˉ1· мін ˉ1)
6)В скільки разів збільшиться швидкість реакції, якщо температуру підвищити на 400 (γ= 3)?
(відповідь: у 265разів) 7) В результаті збільшення температури на 300 швидкість реакції збільшилася у 27 разів. Обчислити температурний коефіцієнт реакції.
(відповідь: γ = 3)
8)В скільки разів зміниться швидкість реакції, якщо температура в ході реакції змінилася із 250С до 550С, а температурний коефіцієнт
становить 2? |
(відповідь: 8разів) |
ХІМІЧНА РІВНОВАГА
Необоротними називають реакції, в яких початкові речовини повністю перетворюються на продукти реакції, тобто реакція іде до кінця.
Ознаки необоротності:
а) випадіння осаду: Na2SO4 + BaCl2 → 2NaCl + BaSO4 ↓;
б) виділення газу: Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑;
в) утворення слабкого електроліту: 2NaOH + H2SO4 → Na2SO4 + 2H2O . Оборотними називають реакції, в яких кінцеві продукти взаємодіють між собою із утворенням початкових речовин. Такі реакції ідуть не до кінця, а до
стану рівноваги:  .
.
Хімічна рівновага – це стан системи, під час якого швидкості прямої та зворотньої реакцій однакові.
Рівноважними називають концентрації, які встановлюються на стан рівноваги (для початкових речовин рівноважна концентрація це кількість речовини, яка залишилася на момент рівноваги; для продуктів реакції – це кількість речовини, яка утворилася на момент рівноваги).
Хімічна рівновага характеризується константою рівноваги КР, яка дорівнює відношенню добутку концентрацій продуктів реакції до добутку концентрацій вихідних речовин в ступенях рівним стехіометричним коефіцієнтам.
Відповідно до закону діючих мас для оборотної реакції: аА + bВ → сС +dD вираз КР можна записати таким чином:
11
|
C c D d |
|||
|
Kp |
A a |
|
B b |
|
|
|
|
|
Термодинамічні умови рівноваги: |
|
|
||
ΔG = 0, |
ΔF = 0. |
|
|
|
КР показує, в скільки разів швидкість прямої реакції більше швидкості зворотньої реакції.
Якщо КР > 1, то швидше іде пряма реакція; ΔG < 0. Якщо КР < 1, то швидше іде зворотна реакція; ΔG > 0. Якщо КР = 1, то ΔG = 0 (стан рівноваги).
КР залежить від природи реагуючих речовин та температури і не залежить від концентрації та каталізатора.
Зсув хімічної рівноваги – це перехід системи з одного рівноважного стану в інший.
Принцип Ле-Шательє: якщо на систему, що знаходиться в рівновазі, подіяти певним чинником (змінити концентрацію, тиск, температуру), то рівновага зрушується у напрямку тієї реакції, яка послаблює цю дію. Хімічна рівновага встановлюється в насиченому розчині солі між твердою фазою та іонами, що перейшли в розчин. Наприклад, в насиченому розчині
купрум сульфіду встановлюється рівновага: CuS ↔ Cu2+ + S2ˉ.
Константа рівноваги цього процесу записується рівнянням:
KP |
|
Cu2 S2 |
|
CuS |
|||
|
|
Концентрація CuS як малорозчинної речовини стала, тому
|
КР· [CuS] = ДР, |
де ДР – це добуток розчинності. |
|
Отже: |
ДР = [Cu2+] · [S2 ˉ]. |
Таким чином, в насиченому розчині електроліту добуток концентрацій його іонів є величина стала і називається добутком розчинності ДР. Ця величина кількісно характеризує здатність електроліту розчинятися.
Чисельне значення ДР можна знайти, знаючи його розчинність.Наприклад, розчинність CаSO4 за 200С дорівнює 1,5· 10ˉ 2 . Це означає, що в насиченому розчині концентрація кожного із іонів Са2+ та SO42 ˉ становить по
1,5· 10ˉ 2 . Отже, добуток розчинності цієї солі:
ДР = [Cа2+] · [SО42 ˉ] = 1,5· 10ˉ 2 · 1,5· 10ˉ 2 = 2,25 · 10ˉ2 ..
Якщо електроліт містить два або декілька однакових іонів, то концентрації цих іонів для обчислення ДР повинні бути зведені у відповідні ступені. Наприклад, розчинність Са3(РО4)2 становить 7,14· 10ˉ7 .
Кальцій фосфат диссоціює за рівнянням:
Са3(РО4)2 ↔ 3Са+2 +2РО43ˉ .
Тоді: [Cа2+] = 3 · 7,14· 10ˉ7 = 21,42 · 10ˉ7; [РО43 ˉ] = 2 · 7,14· 10ˉ7 = 14,28 · 10ˉ7; ДР = (21,42 · 10ˉ7)3 · (14,28 · 10ˉ7)2 = 2,0· 10ˉ29.
12

Якщо добуток концентрацій іонів менший за ДР, то осад не випадає. Якщо добуток концентрацій іонів більший за ДР, то осад випадає. Якщо добуток концентрацій іонів дорівнює ДР, то встановлюється рівновага між насиченим розчином та осадом.
Умова розчинення осаду: додають сильний електроліт, який не має загальних іонів із осадом ( а із одним із іонів осаду дає розчинну сполуку). Наприклад, для розчинення осадуMg(ОН)2 необхідно добавити електроліт
NH4Cl:
Mg(ОН)2 ↓ + NH4Cl → MgCl2 + NH4OH.
розчин
Приклади розв`язання задач
1. В системі NO + O2 ↔ NO 2 рівноважні концентрації речовин: [NO] = 0,2моль/л, [O2] = 0,3моль/л, [NO2] = 0,4моль/л. Обчислити константу рівноваги.
[NO] = 0,2моль/л; |
|
1) Напишемо рівняння реакції: |
|||||
|
|||||||
[O2] = 0,3моль/л ; |
|
2NO + O2 ↔ 2NO 2 ; |
|
||||
[NO2] = 0,4моль/л; |
|
2) Вираз КР для даної реакції можна |
|||||
|
|
записати таким чином: |
|
||||
КР = ? |
|
|
|||||
|
|
KP |
NO2 2 |
0,42 |
|
|
|
|
|
|
|
|
|
13,3 |
|
|
NO 2 O2 |
0,22 0,3 |
|||||
|
|
|
|
|
|||
Відповідь: КР = 13,3.
2.Константа рівноваги реакції N2O4 ↔ NO2 дорівнює 0,26. Рівноважна концентрция NO2 становить 0,28моль/л. Обчислити рівноважну та
початкову концентрацію N2O. |
|
|
|
|||||
КР = 0,26; |
1). Напишемо рівняння реакції: |
|||||||
[NO2]РІВН. = 0,28моль/л; |
|
N2O4 ↔ 2 NO2 ; |
|
|||||
|
2) |
Напишемо рівняння КР для даної реакції: |
||||||
|
||||||||
[N2O4]РІВН. = ? |
|
КР = |
NO2 2 |
|
|
|
||
|
|
|
; |
|
|
|
||
|
N2O4 |
|
|
|
||||
[N2O4]ВИХ. = ? |
звідси : |
|
|
|
||||
|
[N2O4]РІВН = |
NO2 2 |
|
0,282 |
0,3моль/ л; |
|||
|
||||||||
|
|
|
||||||
|
|
|
|
|
КР |
0,26 |
|
|
тобто 0,3моль N2O4 залишилося на момент рівноваги від початкової |
||||||||
кількості; |
|
|
|
|
|
|
|
|
3) Із рівняння реакції виходить, що для отримання |
|
|||||||
2моль NO2 потрібно |
1моль N2O4 |
|
|
Х = 0,14моль/л. |
||||
а для 0,28моль NO2 |
– |
Хмоль N2O4 |
|
|
|
|||
тобто 0,14 моль N2O4 вступає в реакцію;
4) Всього N2O4, тобто його початкова концентрація становить: [N2O4]ВИХ. = 0,14 + 0,3 = 0,44моль/л.
Відповідь: [N2O4]ВИХ. = 0,44моль/л.
13

3.В яку сторону зміщується хімічна рівновага реакції
N2 + Н2 ↔ NН3, якщо тиск в системі збільшити в 3 рази?
Р2 = 3Р1; 1) Напишемо рівняння реакції:
|
|
|
|
N2 + 3Н2 ↔ 2NН3: |
||
|
КР1 |
|
|
|||
|
? |
2) Рівняння КР для даної реакції до підвищення |
||||
|
КР2 |
|||||
|
|
|
|
NH3 2 |
||
|
|
|
тиску: |
КР1 |
||
|
|
|
|
; |
||
|
|
|
N2 H2 3 |
|||
3) Після підвищення тиску в 3 рази концентрація збільшується теж в 3 рази. Рівняння КР для даної реакції після підвищення тиску:
KP2 |
3NH3 2 |
1 |
|
|
|
|
|
3N2 3H2 3 |
9 |
||
4) Знайдемо відношення констант рівноваги:
КР1 1 9 9.
КР2 1
Кр1 збільшується в 9разів. Це означає, що рівновага зміщується у бік прямої реакції. Відповідь: у бік прямої реакції.
4. В якому напрямку зміститься рівновага реакції СО + Н2 ↔ СН4 + СО2 , якщо концентрації всіх речовин зменшити у 2рази?
С1 = 2С2; |
1) Напишемо рівняння реакції: |
|
|||||
|
|
|
2СО +2 Н2 ↔ СН4 + СО2; |
|
|||
|
КР1 |
|
|
||||
|
? |
2) Рівняння КР для даної реакції до зменшення |
|||||
|
КР2 |
||||||
|
|
|
|
СН4 СО2 |
|
||
|
|
|
концентрації: |
КР1 |
; |
||
|
|
|
|||||
|
|
|
СО 2 Н2 2 |
|
|||
3) Рівняння КР для даної реакції після зменшення концентрації:
|
|
|
|
|
КР2 |
0,5СН4 0,5СО2 |
1 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
4; |
|
|
|
|
|
|
0,5СО 2 |
0,5Н2 2 |
0,25 |
|||||||
4) Знайдемо відношення констант рівноваги: |
|
|||||||||||||
|
КР1 |
|
1 |
|
0,25, |
або |
|
КР2 |
4. |
Тобто рівновага зміститься у бік |
||||
|
КР2 |
|
|
|||||||||||
|
4 |
|
|
|
|
КР1 |
|
|
|
|
||||
зворотної реакції. |
|
|
|
|
Відповідь: |
у бік зворотної реакції. |
||||||||
|
|
|
|
|
|
|
|
|
||||||
5.Обчислити добуток розчинності ДР плюмбум фосфату Pb3(PO4)2 , якщо розчинність цієї солі 1,5· 10ˉ9 моль/л.
[Pb3(PO4)2] = 1,5· 10ˉ9 моль/л; 1) Напишемо рівняння дисоціації солі
ДР =? |
Pb3(PO4)2↔ 3 Pb+2 + 2 PO4ˉ2; |
14
2) ДР обчислюється за формулою:
ПР = [Pb+2]3 • [PO4-3]2;
3) Знаходимо концентрацію кожного іона в розчині: [Pb+2] = 3· 1,5· 10ˉ9 = 4,5· 10ˉ9;
[PO4ˉ3] = 2 · 1,5· 10ˉ9 = 3· 10ˉ9;
4) Обчислюємо ДР: ДР = (4,5· 10ˉ9)3 · (3· 10ˉ9)2 = 8,2·10ˉ43.
Відповідь: ДР = 8,2·10ˉ43.
Приклади розв`язання задач
1.Метиловий естер метоксіоцтової кислоти ( проміжний продукт синтезу вітаміну В6) отримують за реакцією:
СН3ОСН2СООН + СН3ОН ↔ СН3ОСН2СООСН3 + Н2О. Обчислити константу рівноваги КР реакції, якщо на момент рівноваги із 1моль кислоти та 1моль спирту утворилося 0,562моль естеру.
|
|
(відповідь: 1,646) |
2. |
В печінці протікає ферментативний оборотний процес: |
|
|
глюкоз–1–фосфат ↔ глюкозо– 6–фосфат. За 370С концентрація |
|
|
глюкозо–1–фосфат становить 0,001моль/л, |
|
|
а глюкозо–6–фосфату - 0,019моль/л. Обчислити КР. |
(відповідь: 19) |
3. |
Розрахуйте константу рівноваги для оборотної реакції NO + O↔NO 2 |
|
|
якщо в стані рівноваги [NO] = 0,056моль/л, [O2] = 0,02моль/л, |
|
|
[NO2] = 0,044моль/л. |
(відповідь: 30,87) |
4.Рівновага в системі 2А + В ↔ 3С + D встановилася за таких рівноважних концентраціях А, В, С та D відповідно: 2,5; 1,0; 1,7;
|
0,8моль/л. Розрахувати константу рівноваги. |
(відповідь: 1,59) |
5. |
Обчислити добуток розчинності ДР барій гідроксиду Ва(OН)2 |
|
|
якщо розчинність цієї сполуки 9,6· 10ˉ2 моль/л. |
(відповідь: 3,5•10-3) |
6. |
Обчислити добуток розчинності аргентум арсенату Ag3AsO4,, якщо |
|
|
розчинність цієї солі 1,4 · 10 ˉ6 моль/л. |
(відповідь: 10,3•10-23) |
7.В якому напрямку зміститься рівновага реакції NО + O2 ↔ NО2, якщо концентрації всіх речовин зменшити в 4 рази.
(відповідь: у бік зворотної реакції)
8. Для реакції:
L-глутамінова кислота + піруват ↔ α–кетоглутарова кислота + L-аланін константа рівноваги за 300С становить 1,11. В якому напрямку йтиме реакція за таких концентраціях: L-глутаміновая кислота та піруват по 0,00003моль/л, α – кетоглутарова кислота та L-аланин по 0,005моль/л? (відповідь: у зворотному напрямку)
9.У водному розчині метиламін є основою:
СН3NH2 + H2O ↔ СН3NH3+ + OH ˉ. Обчислити константу рівноваги, якщо вихідна концентрація метиламіну 0,1моль/л, а концентрація
гідроксид-іону після встановлення рівноваги 6,6• 10—3моль/л. (відповідь: 4,7 • 10 - 4 )
15

ПОТЕНЦІОМЕТРИЧНИЙ МЕТОД АНАЛІЗУ
Гальванічний елемент – це система, в якій хімічна енергія окисновідновної реакції перетворюється на електричну.
Електродним називається потенціал, що виникає на металевому електроді, зануреному в розчин солі цього металу. Така система
називається напівелементом, схема якого записується таким чином: Ме │ Меn+.
Величину електродного потенціалу можна розрахувати за рівнянням
Нернста:
 ,
,
де e0 – нормальний електродний потенціал,
що виникає на електроді, зануреному в розчин солі цього
|
|
металу із концентрацією 1моль/л; |
R |
– універсальна газова стала = 8,313 Дж/к• моль; |
|
Т – |
температура за Кельвіном; |
|
n |
– |
заряд іона; |
F – |
число Фарадея 96500 Кл/моль; |
|
α |
– |
активність іонів металу (або концентрація). |
За 180С рівняння має вигляд:
За 250С рівняння має вигляд:
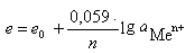 .
.
Наприклад, схема та рівняння для напівелементу із срібним електродом за 180С:
Ag │ AgNO3; |
е = е0Ag+ |
+ |
0,058 |
lg СAg . |
|
||||
|
|
|
n |
|
Для визначення концентрації Н+ використовують водневий електрод, схема якого має вигляд: Рt (Н2 ) | Н+ (потенціал нормального водневого електроду прийнятий за 0) та скляний електрод: скло | Н+.
Для внутрішньошлункової рН-метрії використовують стибієвий (сурм'яний)
електрод:
Sb | Sb2O3, Н+.
Потенціали цих електродів залежать від концентрації Н+.
Електроди порівняння:
хлосрібний Ag | AgCl, KCl, потенціал якого +0,238В та каломельний Hg | Hg2Cl2, КСl, потенціал якого + 0,25В.
16

Гальванічні елементи
Схема гальванічного єлементу Якобі:
(-)Zn │ ZnSO4 ║ CuSO4 │Cu(+).
Рівняння ЕРС гальванічного елементу Якобі:
ЕРС = е°Cu |
– е°Zn + |
RT Cu2 |
|
|
ln Zn2 . |
||
nF |
|||
Рівняння ЕРС гальванічного елементу загального типу (електроди із різних металів, занурених в розчини своїх солей):
|
ЕРС = е°1 – е°2 |
+ |
RT |
|
ln |
C1 |
; |
|||||||||
|
nF |
C2 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
за 180С: |
ЕРС = е°1 |
– е°2 |
+ |
0,058 |
lg |
C1 |
|
; |
||||||||
|
|
C2 |
||||||||||||||
|
|
|
|
|
|
n |
|
|
|
|
||||||
за 250С: |
ЕРС = е°1 |
– е°2 |
+ |
0,059 |
lg |
C1 |
. |
|||||||||
|
|
|||||||||||||||
|
|
|
|
|
|
|
n |
|
|
|
|
C2 |
|
|
||
Концентраційним називається гальванічний елемент, що складається із однометалевих електродів, занурених в розчини їх солей різної концентрації. Схема концентраційного елементу:
(-)Ag AgNO3 AgNO3 Ag(+)
С2 < С1 Рівняння ЕРС концентраційного елементу:
ЕРС RT ln C1 ;
|
|
|
|
|
|
|
nF C2 |
||
за 180С: |
ЕРС = |
0,058 |
lg |
С1 |
; |
||||
|
n |
|
|
||||||
|
|
|
|
|
С2 |
||||
за 250С: |
ЕРС = |
|
0,059 |
lg |
C1 |
. |
|||
|
|
|
|||||||
|
|
|
n |
|
|
|
C2 |
||
Практично ЕРС гальванічного елементу визначають компенсаційним методом.
Знаходять ціну поділки реохорду:
|
ЦП |
ЕВЕСТОНА |
; |
|
|
||
|
|
АС |
|
де |
ЕВЕСТОНА = 1,018 В; |
||
|
АС – відрізок, на якому компенсується елемент Вестону. |
||
Знаходять ЕРС гальванічного елементу |
|||
|
ЕРС = Ц.П АС1 |
||
де |
АС1 – відрізок, на якому компенсується гальванічний елемент. |
||
17
Для визначення рН розчинів складають такі гальванічні елементи або
ланцюги: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а) воднево – водневий елемент: |
|
|
|
|
|
|
|
|
|
|
|
|
||
*) |
(-) Pt(Н2) | H+ H+ | Pt(Н2) (+); |
|||||||||||||
|
СХ < ССТАНД |
|
|
|
|
|
|
|
||||||
|
рНХ = рН СТАНД.. + |
|
ЕРС |
, |
за 180С; |
|||||||||
|
0,058 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
*) |
(-) Pt(Н2) | H+ |
H+| |
Pt(Н2) (+); |
|||||||||||
|
ССТАНД< СХ |
|
|
|
|
|
|
|
|
|
|
|
||
|
рН Х = рН станд. – |
|
ЕРС |
. |
|
|
|
|
|
|
|
|||
|
0,058 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||
б) каломельно-водневий елемент: |
|
|
|
|
|
|
|
|
ЕРС 0,25 |
|
|
|||
(-) Pt(Н2) | H+ Hg2Cl2, KCl |
| Hg (+); |
рН |
; |
|||||||||||
|
|
|||||||||||||
в) каломельно-скляний елемент: |
|
|
|
|
|
0,058 |
|
|
|
|||||
|
|
|
|
|
|
|
ЕРС 0,25 |
|
|
|
||||
(-) скло | Н+ Hg2Cl2,KCl | Hg (+); |
рН |
; |
||||||||||||
|
||||||||||||||
г) воднево - хлорсрібний елемент: |
|
|
|
|
|
0,058 |
|
|
|
|||||
|
|
|
|
|
|
ЕРС 0,238 |
|
|||||||
(-) Pt(Н2) | H+ AgCl, KCl | Ag (+); |
рН |
. |
||||||||||||
|
||||||||||||||
|
|
|
|
|
|
|
0,058 |
|
|
|
||||
Приклади розв`язання задач
1) Елемент складаєься із водневого електрода, зануреного в досліджуваний розчин та нормального водневого електрода. Ціна поділки реохорда 3,4мВ/мм, а досліджуваний елемент компенсується на відрізку 40мм. Написати схему цього ланцюга, і обчислити рН досліджуваного розчину за 180С.
|
ЦП = 3,4мВ/мм; |
|
1) Це елемент концентраційний,оскільки складається |
|||||||
|
||||||||||
|
АС1 = 40мм; |
|
|
|
із однометалевих електродів: |
|
|
|||
|
t = 180С; |
|
|
|
(-) Pt(H2) │ H+ ║ H+ │Pt(H2) (+); |
|
|
|||
|
е0Н =0; |
|
|
|
|
ССТАНД. СХ |
|
|
||
|
|
|
|
2) За 180С |
|
|
||||
|
рН - ? |
|
|
|
|
|||||
|
|
|
|
|
ЕРС |
|
ЕРС |
|||
|
|
рНХ = рН СТАНД.. + |
; рНСТАНД. = 0, тоді pHx |
|||||||
|
|
|
|
|||||||
|
|
0,058 |
|
0,058 |
||||||
3) Знаходимо ЕРС: ЕРС = ЦД • АС1 = 3,4 • 40 = 136мВ = 0,136В; |
||||||||||
|
|
pH |
0,136 |
2,34. |
|
|
||||
|
|
|
|
|
||||||
4) Знаходимо рНХ: |
0,058 |
|
|
Відповідь: |
рН= 2,34. |
|||||
|
|
|
|
|
|
|
|
|||
|
|
18 |
|
|
|
|||||

2) Елемент складається із водневого електроду, зануреного в досліджуваний розчин та каломельного електроду.Элемент Вестона компенсується на відрізку реохорда АС =350мм., а досліджуваний елемент компенсується на відрізку 200мм. Написати схему цього ланцюга та обчислити рН досліджуваного розчину за 250С.
АС =350мм; |
1) Схема каломельно – водневого елементу: |
||||||||||||
АС1 =400мм; |
|
(-) Pt(H2)| H+ | Hg2Cl2,KCl | Hg (+) |
|||||||||||
|
t = 250С; |
2) Формула обчислення рН для каломельно-водневого |
|||||||||||
|
|
|
елементу: |
|
|
|
|
|
|
|
|||
|
рН = ? |
|
|
|
|
|
Е 0,25 |
|
|||||
|
|
|
|
|
|
|
|
рН |
|
||||
|
|
|
|
|
|
|
|
|
|||||
|
|
3) Знаходимо ЕРС: |
0,059 ; |
||||||||||
|
|
||||||||||||
|
|
|
|
|
|
|
|||||||
|
|
|
ЕРС |
ЕВЕСТОНА |
АС |
1,018 |
200 0,58В; |
||||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
АС |
1 |
350 |
|
|
|||
4) Знаходимо рН: |
|
|
|
|
|
|
|
||||||
|
рН |
Е 0,25 |
|
0,58 0,25 |
5,59. |
||||||||
|
|
||||||||||||
|
|
0,058 |
|
|
|
0,059 |
|
|
|
|
|
||
Відповідь: рН = 5,59.
3) Елемент складається із двох водневих електродів.
Один електрод занурений в розчин із рН 4, а другий в розчин із рН 1. Написати схему цього елементу та обчислити ЕРС за 180С.
рН1 = 4; 1) Це елемент концентраційний, оскільки складається
рН2 = 1; із однакових електродів:
t = 180С; (-)Pt (H2) │ H+ ║ H+ │ Pt (H2) (+)
С1 < С2;
ЕРС = ? 2) Якщо рН=4,то [Н+] = 10¯4. Якщо рН=1,то [Н+] = 10¯1. 3) Рівняння ЕРС концентраційного елементу за 180С:
ЕРС 0,058 lg C2 0,058 lg10 1 0,058 lg103 0,174В
C1 10 4
Відповідь: ЕРС = 0,174 В.
4) Елемент складається із водневого електроду, зануреного в
досліджуваний розчин та хлорсрібного електроду. Ціна поділки реохорду 5,6мВ/мм, а досліджуваний елемент компенсується на відрізку 60мм. Написати схему цього ланцюга, та обчислити рН досліджуваного розчину за 180С.
ЦП = 3,4мВ/мм; |
|
1) Схема воднево – хлорсрібного елементу: |
|
|
|||
АС1= 60мм; |
|
(-) Pt(H2)| H+ | AgCl,КСl | Ag(+); |
|
t = 180С; |
|
2) Рівняння обчислення рН для даного ланцюга: |
|
e(AgCl) = 0,238B; |
|
|
|
|
|
|
|
ЕРС = ? |
|
|
|
|
|
|
19 |

pH ЕРС 0,238; 0,058
3) Знаходимо ЕРС:
ЕРС = ЦП • АС1 = 5,6 • 60 = 336мВ = 0,336В; 4) Знаходимо рН:
pH |
0,336 0,238 |
1,69 |
|
|
Відповідь: рН= 1,69. |
||
0,058 |
|
||
5) Елемент складається із водневого електроду, |
зануреного в кров |
||
та каломельного електроду. ЕРС цього елементу 698мВ. Написати схему цього ланцюга та обчислити рН крові за 370С.
ЕРС = 698мВ; 1) Схема каломельного – водневого елементу:
t = 370С; |
(-) Pt(H2) │ H+ ║ Нg2Сl2,КСl │ Нg(+); |
|
2) Рівняння обчислення рН для цього ланцюга |
|
|
рН=? |
за 370С: |
pH EPС 0,25; 0,061
|
рН |
0,698 0,25 |
7,36. |
3) Знаходимо рН крові: |
|
||
0,061 |
|
||
Відповідь: рН= 7,36.
6) Обчислити ЕРС та написати схему мідно – цинкового елементу
за 250С, якщо концентрація електролітів в напівелементах: 1М CuSO4 та 0,01М ZnSO4. (е0Zn = – 0,76 В; е0Cu = + 0,34 В).
С(CuSO4)= 1моль/л; |
1) Схема мідноцинкового елементу або |
||||||
C(ZnSO4)= 0,01моль/л; |
елементу Якобі: |
||||||
е0Zn = – 0,76 В; |
(-)Zn │ ZnSO4 ║ CuSO4 │ Cu(+). |
||||||
е0Cu = + 0,34 В; |
2) Рівняння ЕРС цього елементу: |
||||||
t = 250С; |
|||||||
|
|
ЕРС = е°Cu – е°Zn + |
RT Cu2 |
||||
|
|
||||||
ЕРС = ? |
|
|
ln Zn2 . |
||||
nF |
|||||||
3) Підставляючи дані з умови задачі, знаходимо ЕРС за 250С: |
|||||||
ЕРС = 0,34 – (-0,76) + |
0,059 |
lg |
1 |
1,159.В. |
|||
|
|
||||||
|
2 |
|
0,01 |
|
|
||
Відповідь: ЕРС = 1,159В.
7) ЕРС воднево – водневого елементу за 250С становить 0,177В. Концентрація протонів в одному напівелементі 10¯4. Написати схему цього елементу та обчислити концентрацію протону в другому напівелементі, яка менша за відому.
ЕРС = 0,177В; |
1) Цей елемент концентраційний, оскільки складається |
[Н+]1 = 10¯4; |
із однакових електродів: |
t = 250С; |
(-) Pt(H2) │ H+ ║ H+ │ Pt(H2) (+); |
[Н+]2 = ? |
2) Рівняння ЕРС за 250С має вигляд: |
|
|
20
