
МОЛБИОЛ 2014-лекции / ООФ / Л06-Генетическая рекомбинация _1
.pdf
RecA-филамент E.coli
 АТР
АТР 
Комплекс RecA с триплексом ДНК |
Вид сверху на белковую |
(и белковая, и ДНК спирали |
спираль RecA: |
правозакручены) |
шесть мономеров (со связанной |
|
АТР) на виток |
41
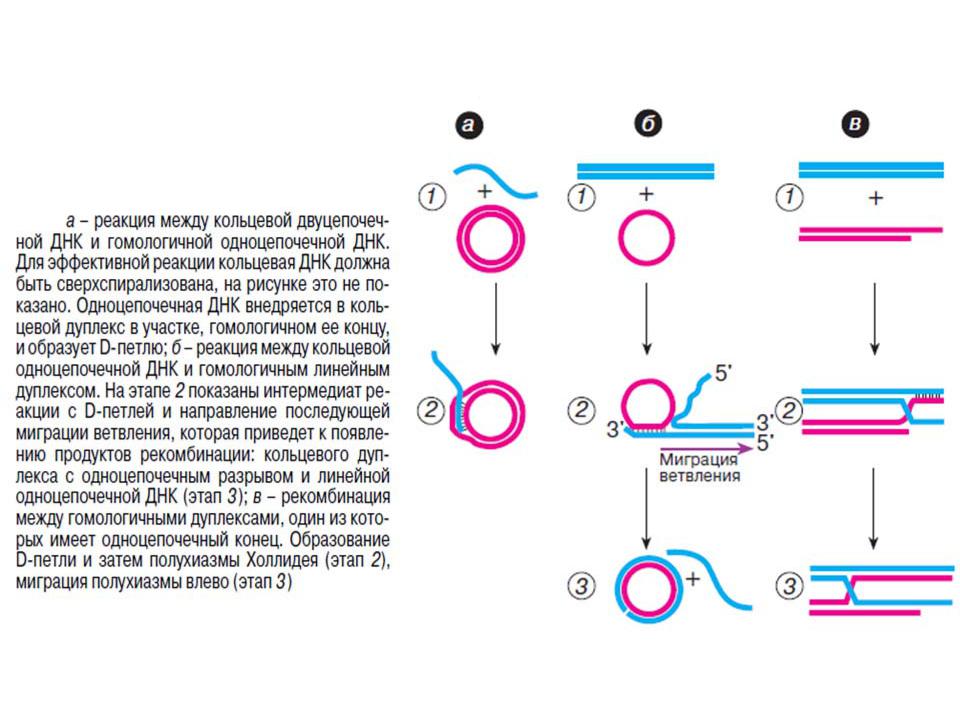
*В зависимости от структуры ДНК-субстратов белок RecA может проводить разные рекомбинационные реакции
D-петля может быть закрытой, если в дуплекс внедряется одноцепочечный хвост42(а),
или открытой, если она формируется на конце линейного дуплекса (б и в).

Синаптическая стадия кроссинговера
•Реакции происходят только внутри филаментов.
•Филаменты могут вступать в рекомбинацию только с "голой", не находящейся
вфиламенте ДНК. Поэтому два филамента не рекомбинируют друг с другом.
•Взаимодействие филамента с голой ДНК осуществляется за счет второго сайта связывания RecA.
•Связывание с ДНК во втором сайте слабое. Из-за этого между филаментом и голой ДНК возникают лишь кратковременные контакты. Они становятся прочными только после встречи гомологичных последовательностей.
•После нахождения области гомологии формируется гетеродуплекс. Начинается с образования структуры, в которой задействованы три цепи ДНК (D-петля от англ. displacement loop - петля вытеснения).
•Одноцепочечная ДНК внедряется в дуплекс и образует двойную спираль
(гетеродуплекс) с комплементарной ей цепью, одновременно вытесняя вторую цепь.
43

Формирование RecA-ДНК филамента и начало рекомбинации
44

Постсинапсис: расширение гетеродуплекса путем однонитевой миграции ветвления и обмен цепями при участии RecA-филамента
•В постсинапсисе гетеродуплекс удлиняется путем миграции ветвления, которую in vitro также может осуществлять белок RecA.
•Миграция ветвления под действием RecA-белка сопровождается гидролизом АТФ, но происходит медленно, со скоростью несколько п.н./с. Удлинение гетеродуплекса происходит в направлении 5′-> 3′ однонитевой ДНК.
•Если одноцепочечная ДНК была в составе двуцепочечной молекулы (как хвост или брешь), то формирование филамента распространяется на дуплекс, что также сопровождается гидролизом АТР.
•В этом случае удлинение гетеродуплекса происходит путем двунитевой миграции ветвления. Формируется 4-нитевая ДНК. Вращение RecA-филамента вокруг своей оси
вызывает наматывание «голого» |
45 |
|
дуплекса на филамент. |
||
|

Рекомбинация у E.coli in vivo
•Таким образом, в условиях in vitro белок RecA способен осуществлять поиск гомологии, формировать синаптическую структуру на основе гетеродуплекса и производить обмен цепями между гомологами. Эти реакции стимулируются добавлением белка SSB, который выпрямляет одноцепочечную ДНК.
•В условиях in vivo вместе с RecA задействованы другие белки. В клетке белок RecA не проводит миграцию ветвления.
•Миграцию ветвления и разрешение полухиазмы более эффективно, чем RecA, осуществляют специальные белки, из них наиболее изучены RuvА, RuvB и RuvC.
–RuvА – узнает полухиазму и «нацеливает» на нее RuvB.
–RuvB – АТР-зависимая ДНК-хеликаза, осуществляет миграцию ветвления (много эффективнее, чем RecА); «нацеливает» RuvC.
–RuvC – разрешает полухиазму (резолваза).
•Разнообразие белков, работающих вместе с RecA, отражает разнообразие путей рекомбинации. Еще в 1973 году А. Кларк описал у E. coli три разных пути гомологичной рекомбинации, но ни один из них не функционирует без RecA-белка.
46

Модель ассоциации RuvА и RuvB со структурой Холлидея (по данным электронной микроскопии)
•RuvA непосредственно узнает открытую форму структуры Холлидея и связывается с ней в виде тетрамера.
•Два гексамера RuvB узнают комплекс полухиазмы c тетрамером RuvА; ДНК протянута сквозь центральное отверстие RuvВ-гексамера;
•Кольцевые RuvB вращают внутри себя ДНК как как винт в гайке, используя энергию АТР, в противоположных направлениях (хеликазная активность). Гексамеры RuvB похожи на хеликазы.
•В результате протягивания ДНК через RuvА/ RuvB комплекс происходит удлинение гетеродуплекса (двунитевая миграция ветвления).
47

Завершение рекомбинации белком RuvC
RuvC специфически разрешает полухиазму, внося парные разрывы в нити ДНК (вероятно, связанные с RuvA и RuvB)
48
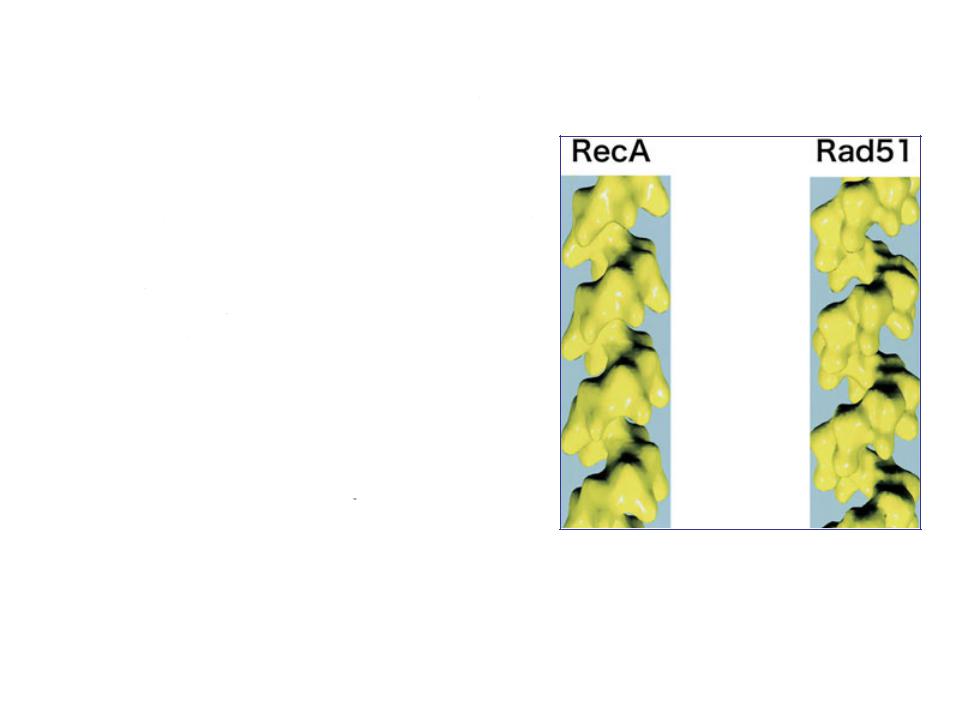
Гомологичные ферменты рекомбинации у различных организмов
•Все организмы имеют структуры Холлидея и белки, сходные по структуре и/или по функции с
RecA, Rec BCD, RuvA, RuvB и RuvC.
•RecA высоко консервативен. Его гомолог у дрожжей - белок Rad51 - формирует сходный по трехмерной структуре филамент с ДНК.
•В то же время, механизмы рекомбинации у разных организмов могут существенно отличаться в деталях (так, Rec BCD присутствует только у бактерий).
Rad51 входит в группу Rad52 у дрожжей и имеет гомолог у человека. Участвует в репарации двухцепочечных разрывов.
49

Специализированные системы гомологичной рекомбинации
•Кроме систем рекомбинации, выполняющих общие функции, существуют специализированные системы гомологичной рекомбинации, выполняющие ту или иную частную задачу.
–Механизм антигенных вариаций у паразитов
–«Кассетный» механизм смены типов спаривания у гаплоидных дрожжей
•Вечная борьба «паразитов» и «хозяев».
–Животные продуцируют в огромном ассортименте антитела, обеспечивающие им иммунитет, а патогенные микроорганизмы в ответ на это образуют на своей поверхности все новые и новые антигены, позволяющие им уходить от иммунного ответа хозяина.
Механизм антигенных вариаций у паразитов для борьбы
симмунной системой хозяина
•Наличие нескольких копий генов, кодирующих иммунологически различающиеся варианты поверхностного белка;
•Рекомбинационное переключение экспрессирующегося гена.
Паразит |
Инфекция |
Переключающийся антиген |
Гонококк |
Гонорея |
Поверхностный вариабельный |
(Neisseria gonorrhoeae) |
|
белок пилин |
|
|
|
Borellia |
Возвратный тиф |
Поверхностный вариабельный |
|
|
белок VIsE |
Tripanosoma Brucei |
Сонная болезнь |
Поверхностный вариабельный50 |
(эукариотический паразит) |
|
гликопротеин |
|
|
|
