
Химия - учебно-методическое пособие
.pdfГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
ИМЕНИ Н.И. ПИРОГОВА
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
С.А. Панов
Х И М И Я
(учебно-методическое пособие)
Москва
2013

С.А. Панов
Химия: Учебно-методическое пособие. Москва, 2013. 68 с.
Учебно-методическое пособие «Химия» содержит весь необходимый материал школьного курса химии, соответствующий государственному образовательному стандарту, утвержденному Министерством образования и науки Российской Федерации. Оно раскрывает наиболее важные понятия, необходимые для более полного овладения разделами общей, неорганической и органической химии,
изучаемых в школе. Учебно-методическое пособие «Химия» предназначено для школьников 10-11 классов образовательных учреждений, а также абитуриентов,
поступающих в высшие учебные заведения медицинского или естественнонаучного профиля, и может использоваться как в рамках самостоятельной подготовки обучающихся, так и подготовки к единому государственному экзамену.
2
СОДЕРЖАНИЕ
Введение…………………………………………………………………………………...4
ОБЩАЯ ХИМИЯ
Строение атома……………………………………………………………………………5
Периодический закон и периодическая система химических элементов Д.И. Менделеева…………………………………………………………………………10
Химическая связь………………………………………………………………………...13
Кристаллические решетки………………………………………………………………17
Валентность и степень окисления………………………………………………………19
Химические реакции и закономерности их протекания………………………………20
Растворы. Электролитическая диссоциация…………………………………………...27
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Важнейшие классы неорганических соединений……………………………………...32
Металлы…………………………………………………………………………………..35
Неметаллы………………………………………………………………………………..42
ОРГАНИЧЕСКАЯ ХИМИЯ
Основные положения теории химического строения органических веществ А.М. Бутлерова…………………………………………………………………………..47
Классификация органических соединений…………………………………………….47
Углеводороды……………………………………………………………………………53
Кислородсодержащие органические вещества Азотсодержащие органические вещества
Заключение
3
ВВЕДЕНИЕ
98 баллов – это так много, ведь за этим стоит много труда, сил и времени. 98 баллов – это так мало, ведь всего каких-то 2 балла…
(Учитель Н.В. Майсакова)
Дорогие друзья!
Данное пособие подготовлено, прежде всего, для школьников, педагогов,
репетиторов; тех, кто планирует сдавать единый государственный экзамен по химии в качестве итоговой аттестации за курс среднего (полного) общего образования,
собирается связать свою жизнь в будущем с естественными науками или медициной, а также, лиц, просто интересующихся химией.
Как правило, химия – одна из тех дисциплин, вызывающих трудности у большинства школьников. Это обусловлено тем, что данный предмет требует к себе особого, трепетного отношения: необходимо знать строение, номенклатуру,
физические и химические свойства, методы получения различных химических веществ, научиться решать задачи, уметь применять теоретические знания на практике и.т.д.
Учебно-методическое пособие, которое Вы держите в руках, направлено на преодоление любых затруднений в освоении школьного курса химии. Весь теоретический материал, представленный в данной книге, максимально систематизирован, что позволяет читателю понять смысл, а также наглядно рассмотреть сущность любых химических превращений.
Перед прочтением какого-либо раздела настоятельно рекомендуется ознакомиться с аналогичными темами в действующих учебниках, рекомендованных Министерством образования и науки Российской Федерации.
Желаю успеха в изучении самой интересной, замечательной и необыкновенной науки – химии!
С Уважением,
Сергей Алексеевич Панов.
4

ОБЩАЯ ХИМИЯ
СТРОЕНИЕ АТОМА
Химический элемент – это определенный вид атомов, характеризующийся
одинаковым положительным зарядом ядра.
Формы
существования
химических
элементов
свободные атомы |
простые вещества |
сложные вещества |
Атом – наименьшая частица химического элемента, являющаяся носителем
его свойств.
Простые вещества – это вещества, образованные атомами одного
химического элемента.
Сложные вещества – это вещества, образованные атомами разных
химических элементов.
|
|
Атом |
||||
|
|
|
|
|
||
|
|
|
|
|
||
|
|
|
|
|
||
ядро |
|
электронная оболочка |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нуклоны |
|
|
|
электрон |
||
|
|
|
||||
протон
нейтрон
5
|
Масса (m) |
Заряд (q) |
|
|
|
Протон |
1 |
+1 |
|
|
|
Нейтрон |
1 |
0 |
|
|
|
Электрон |
1/1840, или 0 |
-1 |
|
|
|
Заряд ядра |
Порядковый |
|
номер |
||
атома |
||
элемента |
||
|
Число |
Число |
протонов в |
электронов в |
ядре |
атоме |
Заряд атома нейтральный!
;
где Ar – относительная атомная масса, N – число нейтронов,
Z – порядковый номер элемента.
Изотопы – это разновидности атомов одного и того же химического элемента,
имеющие одинаковый заряд ядра, но разную атомную массу (массовое число).
18p, 18n, 18e 18p, 20n, 18e 18p, 22n, 18e
Изобары – это разновидности атомов, имеющие одинаковую атомную массу,
но разные физические и химические свойства.
6
Электронная оболочка атома – это совокупность всех электронов в данном
атоме.
Атомная орбиталь – это пространство в поле ядра атома, где нахождение электрона наиболее вероятно (90%).
Электроны, обладающие близкими значениями энергии, образуют
электронный слой или энергетический уровень.
;
где N – это максимальное число электронов на энергетическом уровне, n – это номер энергетического уровня или главное квантовое число.
n = 3
n = 2
n = 1
Энергия и прочность орбиталей возрастает.
Прочность связи электрона с ядром уменьшается.
Состояние электрона в атоме характеризуется четырьмя квантовыми числами:
1) |
Главное квантовое число n определяет энергию электрона, обозначает |
||||
|
номер энергетического |
уровня, |
принимает целочисленные |
значения: |
|
|
n = 1, 2, 3, 4… |
|
|
|
|
2) |
Побочное орбитальное |
квантовое число |
l определяет форму |
||
|
электронного облака (s, |
p, d, f), |
принимает |
целочисленные |
значения: |
l = 0, 1, 2, 3… (n-1).
3)Магнитное квантовое число ml определяет число орбиталей на подуровне, принимает при данном значении l(2l+1) значений.
4)Спиновое квантовое число s характеризует вращение электрона вокруг своей оси и принимает только два значения: +1/2 и -1/2.
7
Заполнение орбиталей
1.Принцип Паули – в атоме не может быть более двух электронов с одинаковым набором всех четырех квантовых чисел.
2.Правило Гунда – в данном подуровне электроны располагаются так,
чтобы их суммарное спиновое число было максимальным.
3.Принцип наименьшей энергии – электроны заполняют энергетические подуровни в порядке увеличения их энергии.
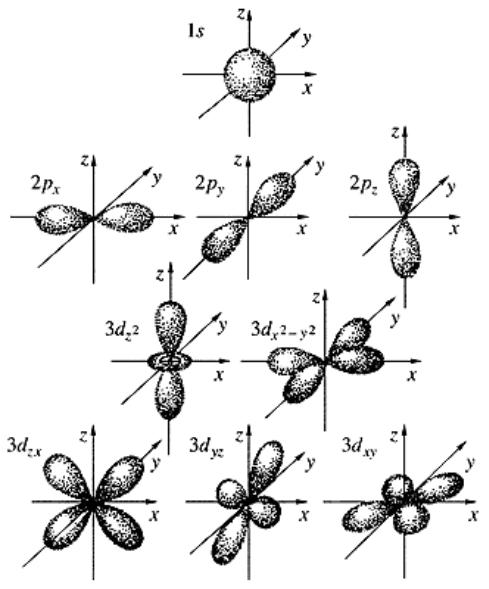
Виды атомных орбиталей
8
Главные характеристики атома
1)Радиус атома (Rат) – это расстояние от ядра до наиболее удаленного от него электрона.
Rат у металлов > Rат у ионов; Rат у неметаллов < Rат у ионов;
Rкатион < Rанион (по периоду);
R с возрастанием Z увеличивается (по группе).
2)Энергия (потенциал) ионизации (I) – это количество энергии, которое необходимо затратить для отрыва е- от атома элемента (максимальна – у
инертных газов, минимальна у щелочных металлов).
3)Энергия сродства к электрону (Еср) – это энергия, которая выделяется при присоединении е- к атому (максимальна – у галогенов, минимальна у
щелочных металлов).
4)Электроотрицательность (ЭО) – это способность атома в соединении притягивать к себе электроны.
ЭО = I + Eср
9
ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
Свойства химических элементов, а также формы и свойства их
соединений находятся в периодической зависимости от заряда ядер их атомов.
Впервые Периодический закон был сформулирован 1 марта 1869 года русским ученым Д.И. Менделеевым. Первоначально, формулировка закона выглядела несколько иначе: свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от относительной атомной массы элементов. Но, как оказалось, элементы Ar, K, Ca не подлежат данному условию (это можно проследить в периодической системе). Именно поэтому современная формулировка закона звучит иначе.
Периодическая |
система |
химических |
элементов |
Д.И. Менделеева |
||
(см. приложение) является графическим отображением Периодического закона. |
||||||
|
Главная характеристика элемента – заряд ядра атома! |
|
||||
|
|
|
Периодически |
|
Периодически |
|
Заряд ядра |
|
повторяется |
|
|||
|
|
повторяются |
||||
равномерно |
|
строение |
|
|||
|
|
свойства |
|
|||
возрастает от 1 |
|
внешнего |
|
|
||
|
элементов и их |
|||||
до 110 (и далее) |
|
энергетического |
||||
|
|
соединений |
||||
|
|
|
уровня |
|
||
|
|
|
|
|
|
|
Физический смысл Периодического закона (на примере |
) |
|||||
Порядковый номер |
|
электронная оболочка (17е-) |
|
|||
|
Ядро |
|
|
3 |
- номер периода |
|
|
+17 |
|
|
|
|
|
17р+ |
+ |
18n0 |
= атомная масса |
2 8 7 - номер группы |
||
|
|
|
10 |
|
|
|
