
Химия - учебно-методическое пособие
.pdfIX. Основные способы получения металлов
Металлургия – это наука о методах и процессах производства металлов из
руд.
1)Пирометаллургия – получение металлов из руд реакциями восстановления при высоких температурах.
ZnO + C → Zn + CO↑
Fe2O3 + 3CO → 2Fe + 3CO2↑ WO3 + 3H2 → W + 3H2O Cr2O3 + 2Al → 2Cr + Al2O3 2ZnS + 3O2 → 2ZnO + 2SO2↑
ZnO + C → Zn + CO↑
2) Гидрометаллургия – получение металлов из растворов их солей.
CuO + H2SO4 (р-р) → CuSO4 + H2O
CuSO4 + Fe → FeSO4 + Cu
3) Электрометаллургия – получение металлов, основанное на электролизе растворов и расплавов солей.
2NaCl → 2Na + Cl2↑
X.Электролиз
Электролиз – это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через раствор или расплав электролита.
Под действием постоянного электрического тока вода разлагается на кислород и водород.
2Н2О = 2Н2↑ + О2↑
Важно помнить, что на катоде происходит восстановление, а на аноде – окисление.
Процессы электролиза раствора и расплава отличаются друг от друга не только процессами на электродах, но и продуктами реакций.
41
НЕМЕТАЛЛЫ
I.Неметалл – химический элемент
а) К неметаллам относятся:
-Элементы главных подгрупп IV-VIII групп, В и Н;
-Водород и гелий (s-семейство), остальные неметаллы принадлежат к
p-семейству.
б) Особенности электронного строения атомов неметаллов:
-На внешнем энергетическом уровне число электронов от 4 до 8;
-Большая величина энергии сродства к электрону (Еср);
-Высокое значение энергии ионизации (Еион);
-Стремление к присоединению электронов с целью приобретения устойчивой электронной конфигурации.
II. Неметалл – простое вещество
-Связь в молекулах неметаллов – ковалентная неполярная;
-Простые вещества – неметаллы с атомной кристаллической решеткой (С,
Si…) – твердые кристаллические вещества с высокими tплав и tкип,
нерастворимые в воде;
- Простые вещества – неметаллы с молекулярной кристаллической решеткой (О2, H2, I2, Br2…) – летучие вещества с низкими tплав и tкип, плохо растворимые в воде.
III.Общие химические свойства неметаллов (на примере Сl2 и С)
|
+ Ме |
Cl2 |
+ Ca → CaCl2 |
НеМе |
+ НеМе < электроотриц. |
5Cl2 + 2P → 2PCl5 |
|
(окислитель) |
+ соль < активного НеМе |
Cl2 |
+ 2KI → 2KCl + I2 |
|
+оксид НеМе (восстановитель) |
Cl2 |
+ 2CO → 2COCl2 |
42
НеМе |
|
+ оксид Ме |
С + CuO → Cu + CO |
(восстановитель) + кислота (окислитель) |
C + 4HNO3 → CO2↑ + 4NO2↑ + 2H2O |
||
IV. |
Химические свойства неметаллов |
|
|
|
+ H2, hv |
→ HCl |
|
|
+ Me, to |
→ MexCly |
|
|
+P, to |
→ PCl3, PCl5 |
|
|
+NH3 |
→ N2 + HCl |
|
|
+H2O |
→ HCl + HClO |
|
Cl2 |
+ KOH |
→ KCl + KClO + H2O |
|
|
+ KOH, to |
→ KCl + KClO3 + H2O |
|
|
+ CH4, hv |
→ CH3Cl + HCl |
|
|
+ C2H4 |
→ C2H4Cl2 |
|
|
+ C2H2 |
→ C2H2Cl4 |
|
|
+ C6H6, hv |
→ C6H6Cl6 |
|
|
+ C6H6, AlCl3 |
→ C6H5Cl + HCl |
|
|
+ O2, to |
→ SO2 |
|
|
+ H2, to |
→ H2S |
|
|
+P, to |
→ P2S3 |
|
|
+F2 |
→ SF6 |
|
|
+Cl2 (изб.) |
→ SCl2 |
|
S |
+ Me, to |
→ MexSy |
|
|
+ NaOH, to |
→ Na2S + Na2SO3 + H2O |
|
|
+ Na2SO3 (р-р), to |
→ Na2S2O3 |
|
|
+ HNO3 (разб.) |
→ H2SO4 + NO↑ |
|
|
+ HNO3 (конц.) |
→ H2SO4 + NO2↑ + H2O |
|
|
+ H2SO4 (конц.) |
→ SO2 + H2O |
|
|
|
43 |
|
|
+ H2, to, kat |
→ NH3 |
N2 |
+ O2, эл. ток |
→ NO |
|
+Me, to |
→ MexNy (Li при обычной to) |
|
+Si, to |
→ Si3N4 |
|
+ O2, to |
→ P2O3, P2O5 |
|
+ Me, to |
→ MexP4 |
|
+Cl2, to |
→ PCl3, PCl5 |
P |
+S, to |
→ P2S5 |
|
+ HNO3 (разб.) |
→ H3PO4 + NO↑ |
|
+ HNO3 (конц.) |
→ H3PO4 + NO2↑ + H2O |
|
+ H2SO4 (конц.) |
→ H3PO4 + SO2↑ + H2O |
|
+ O2, to |
→ SiO2 |
|
+ F2 |
→ SiF4 |
|
+Hal2, to |
→ SiHal4 |
|
+N2, to |
→ Si3N4 |
Si |
+C, to |
→ SiC |
|
+ Me, to |
→ MexSiy |
|
+ MgO, to |
→ Mg + SiO2 |
|
+ NaOH + H2O |
→ Na2SiO3 + H2↑ |
|
+ HF, to |
→ SiF4 + H2↑ |
44
|
+H2, to, p, kat |
→ CH4 |
|
+ O2, to |
→ CO2 |
|
+ Me, to |
→ карбиды металлов |
|
+S, to |
→ CS2 |
|
+Si, to |
→ SiC |
|
+H2O, to |
→ CO↑ + H2↑ |
C |
+ Fe2O3, to |
→ Fe + CO↑ |
|
+ ZnO, to |
→ Zn + CO↑ |
|
+ CaO, to |
→ CaC2 + CO↑ |
|
+ SiO2, to |
→ Si + CO↑ |
|
+ HNO3 (конц.) |
→ CO2↑ + NO2↑ + H2O |
|
+ H2SO4 (конц.) |
→ CO2↑ + SO2↑ + H2O |
+KNO3, to → K2CO3 + CO2↑ + N2↑
V.Химические свойства некоторых соединений неметаллов
|
+O2 (изб.), to |
→ S + H2O |
|
+O2 (изб.), to |
→ SO2 + H2O |
|
+ Сl2 |
→ S + HCl |
|
+Mg |
→ MgS + H2↑ |
|
+BaO |
→ BaS + H2O |
H2S |
+NaOH (нед.) |
→ NaHS + H2O |
|
+ NaOH (изб.) |
→ Na2S + H2O |
|
+ NH3 |
→ (NH4)2S |
|
+ HNO3 (разб.) |
→ H2SO4 + NO↑ + H2O |
|
+ HNO3 (конц.) |
→ H2SO4 + NO2↑ + H2O |
|
+ H2SO4 (конц.) |
→ S↓ + SO2↑ + H2O |
45
|
+O2 +H2O, to |
→ HNO3 |
|
|
+H2O, to |
→ HNO3 + 4NO2 |
|
NO2 |
+ NaOH (на холоде) |
→ NaNO3 + NaNO2 + H2O |
|
|
+NaOH + O2 (изб.) |
→ NaNO3 |
+ H2O |
|
+NaOH, to |
→ NaNO3 |
+ NO + H2O |
|
+HI, to |
→ H2 + I2 + H2O |
|
|
|
+ Al, Cr, Fe, Au, Pt |
→ не реагирует |
|
H2SO4 |
(конц.) |
+ активные металлы |
→ MeSO4 |
+ H2S↑ + H2O |
|
|
+ тяжелые металлы |
→ MeSO4 |
+ SO2↑ + H2O |
|
|
+ Al, Cr, Fe, Au, Pt |
→ не реагирует |
|
HNO3 |
(конц.) |
+ активные металлы |
→ Mex(NO3)y + N2O↑ + H2O |
|
|
|
+ тяжелые металлы |
→ Mex(NO3)y + NO2↑ + H2O |
|
|
|
+ активные металлы |
→ Mex(NO3)y + NH4NO3↑ + H2O |
|
HNO3 (разб.) |
+ активные металлы |
→ Mex(NO3)y + NH3↑ + H2O |
||
|
|
+ тяжелые металлы |
→ Mex(NO3)y + NO↑ + H2O |
|
|
+Mg, to |
→ MgO + Si |
||
|
+F2 |
→ SiF4 |
+ O2↑ |
|
SiO2 |
+ HF |
→ SiF4 |
+ H2O |
|
|
+NaOH, to |
→ Na2SiO3 |
+ H2↑ |
|
|
+Na2CO3, to |
→ Na2SiO3 |
+ CO2↑ |
|
|
+CaO, to |
→ CaSiO3 |
|
|
46

ОРГАНИЧЕСКАЯ ХИМИЯ
ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ ХИМИЧЕСКОГО СТРОЕНИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ А.М. БУТЛЕРОВА
1)Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
2)Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
3)Строение молекул может быть установлено на основе изучения их химических свойств.
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
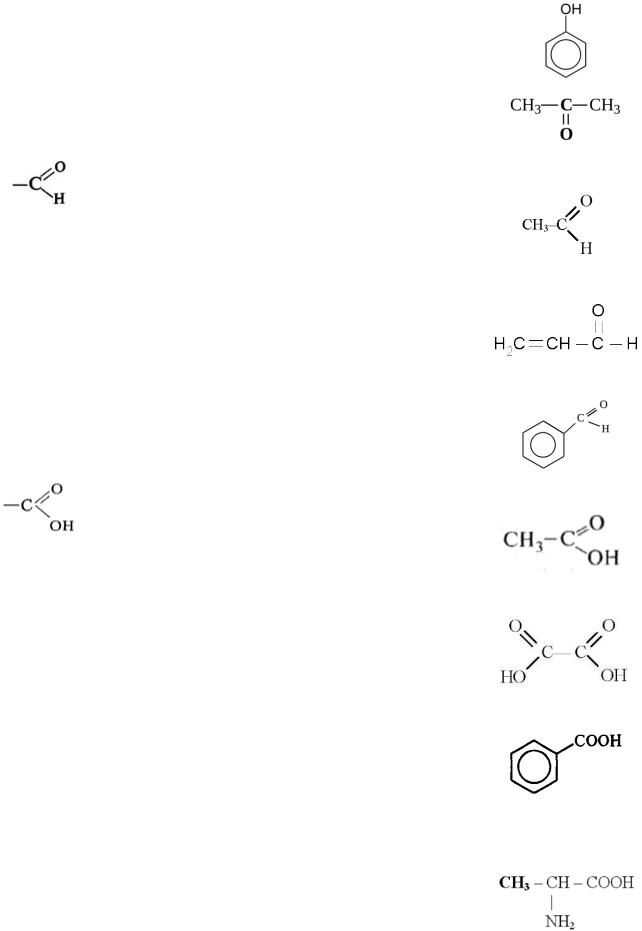
I. Классификация по наличию функциональных групп
Функциональная группа |
Название класса |
Примеры |
|
|
|
соединений |
|
Формула |
Название |
|
|
|
|
|
|
-OH |
Гидроксильная группа |
Спирты |
Предельные |
|
|
|
CH3-CH2OH |
|
|
|
Непредельные |
|
|
|
CH2=CH-CH2OH |
|
|
|
Многоатомные |
|
|
|
CH2OH-CHOH-CH2OH |
|
|
|
Ароматические |
|
|
|
|
47
|
|
Фенолы |
|
|
|
|
|
-С=ОН |
Карбонильная группа |
Кетоны |
|
|
|
|
|
|
Альдегидная группа |
Альдегиды |
Предельные |
|
|
|
Непредельные |
|
|
|
Ароматические |
|
|
|
|
|
Карбоксильная группа |
Карбоновые |
Одноосновные предельные |
|
|
кислоты |
|
|
|
|
Двухосновные предельные |
|
|
|
Ароматические |
|
|
|
|
-NO2 |
Нитрогруппа |
Нитросоединения |
CH3-NO2 |
|
|
|
|
-NH2 |
Аминогруппа |
Амины |
CH3-NH2 |
|
|
|
|
-NH2, |
Аминогруппа и |
Аминокислоты |
|
-COOH |
карбоксильная группа |
|
|
|
|
|
|
|
|
48 |
|
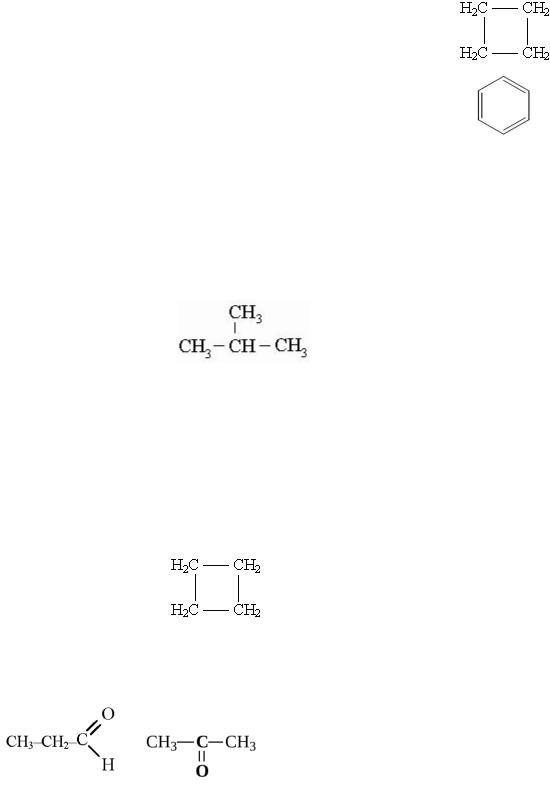
CnH2n+2 |
- |
Алканы |
CH3-CH3 |
|
|
|
|
CnH2n |
- |
Алкены |
CH2=CH2 |
|
|
|
|
CnH2n-2 |
- |
Алкины |
HC=CH |
|
|
|
|
CnH2n-2 |
- |
Алкадиены |
CH2=CH-CH=CH2 |
|
|
|
|
CnH2n |
- |
Циклоалканы |
|
|
|
|
|
CnH2n-6 |
- |
Арены |
|
|
|
(ароматические |
|
|
|
соединения) |
|
|
|
|
|
II. Типы изомерии
1) Структурная изомерия
а) Изомерия углеродной цепи
CH3-CH2-CH2-CH3 и
б) Изомерия положения кратной связи
CH2=CH-CH2-CH3 и CH3-CH=CH=CH3
в) Изомерия положения функциональной группы
CH3-CH2-CH2OH и CH3-CHOH-CH3
2) Межклассовая изомерия
а) CH2=CH-CH2-CH3 и
б) 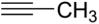 и CH2=C=CH2 (обратите внимание на формулу пропина!)
и CH2=C=CH2 (обратите внимание на формулу пропина!)
в) CH3-CH2OH и CH3-O-CH3
г) и
д) СH3-CH2-CO(OH) и CH3-CO(O-CH3)
49

3) Пространственная изомерия (цис-, транс-изомерия)
III. Типы химических реакций в органической химии
Реакции органических веществ можно формально разделить на четыре основных типа: замещения, присоединения, отщепления (элиминирования) и
перегруппировки (изомеризации).
Как правило, основное органическое соединение, участвующее в реакции,
называют субстратом, а другой компонент реакции условно рассматривают как
реагент.
1) Реакции замещения.
Реакции, в результате которых осуществляется замена одного атома или группы атомов в исходной молекуле (субстрате) на другие атомы или группы атомов, называются реакциями замещения. В реакции замещения вступают предельные и ароматические соединения, такие, как, например, алканы,
циклоалканы или арены.
СН4 + Сl2 → СН3Сl + НСl
2) Реакции присоединения.
Реакции, в результате которых две или более молекул реагирующих веществ соединяются в одну, называют реакциями присоединения. В реакции присоединения вступают ненасыщенные соединения, такие, как, например, алкены или алкины.
СН3—СН=СН2 + Н2 → СН3—СН2—СН3
50
