
Химия - учебно-методическое пособие
.pdfМетоды расстановки коэффициентов в уравнениях ОВР
Для составления уравнений окислительно-восстановительных реакций необходимо знать химические формулы исходных веществ и продуктов реакции.
Формулы продуктов устанавливаются экспериментально или на основании известных химических свойств веществ. Правильно записанная реакция является выражением закона сохранения массы веществ (Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате еѐ). Это значит, что в правой и левой частях уравнения должно быть одинаковое число атомов.
1.Метод электронного баланса
Используют его, как правило, для составления уравнений простых
окислительно-восстановительных реакций. В основе лежит положение о том, что общее число электронов, отданных восстановителем должно равняться общему числу электронов, принятых окислителем. Подсчет числа перешедших электронов лежит в основе составления уравнений окислительно-восстановительных реакций.
1) Запишем формулы исходных веществ и продуктов реакции:
FeCl3 + H2S → FeCl2 + S + HCl;
2)Определим, какое вещество является окислителем, а какое восстановителем и их степени окисления до и после реакции. Хлорид железа (III) выполняет роль окислителя, так как содержит положительно заряженный ион железа с относительно высоким зарядом, способный восстанавливаться до промежуточной степени окисления. Сероводород является
восстановителем, так как в его состав входит бескислородный анион S2-,
содержащий избыточные электроны:
Fe+3Cl3 + H2S-2 → Fe +2Cl2 + S0 + HCl
3)Составим электронные уравнения, выражающие процессы окисления и восстановления. По изменению степеней окисления определим число электронов, отдаваемых восстановителем, и число электронов,
принимаемых окислителем:
21
Fe+3 +1e= Fe+2 |
2 |
восстановление, окислитель |
S-2 – 2e = S0 |
1 |
окисление, восстановитель |
|
|
|
4)Множители электронного баланса запишем в уравнение окислительно-
восстановительной реакции как основные стехиометрические коэффициенты:
2FeCl3 + H2S → 2FeCl2 + S + HCl
5)Подберем стехиометрические коэффициенты остальных участников реакции, перейдем от схемы к уравнению реакции (ставим знак равенства вместо стрелки):
2FeCl3 + H2S = 2FeCl2 + S + 2HCl
6)Проверим правильность написания путем подсчета атомов каждого элемента в левой и правой частях уравнения реакции.
2.Метод электронно-ионного баланса (метод полуреакций)
Для подбора коэффициентов в уравнениях окислительно-восстановительных
реакций, протекающих в водном растворе при участии ионов, используют метод электронно-ионного баланса.
Метод электронно-ионного баланса складывается из следующих этапов:
1) записывают формулы реагентов данной реакции:
K2Cr2O7 + H2SO4 + H2S
2) устанавливают химическую функцию каждого из них (здесь
K2Cr2O7 − окислитель, H2S – восстановитель, H2SO4 − кислая среда).
3)записывают (на следующей строчке) формулы реагентов в ионном виде,
указывая только те ионы (для сильных электролитов), молекулы (для слабых электролитов и газов) и формульные единицы (для твердых веществ), которые примут участие в реакции в качестве окислителя
(Cr2O72− ), среды (Н+) и восстановителя (H2S):
Cr2O72− + H+ + H2S
22
4)определяют восстановленную форму окислителя и окисленную форму восстановителя, что должно быть известно в условии задачи (так, здесь дихромат-ион переходит в катионы хрома (III), а сероводород − в серу); эти данные записывают на следующих двух строчках, составляют электронно-
ионные уравнения полуреакций восстановления и окисления и подбирают дополнительные множители для уравнений полуреакций:
Cr2O72− + 14H+ + 6e− = 2Cr3+ + 7H2O |
1 |
восстановление, окислитель |
H2S − 2e− = S(т) + 2H+ |
3 |
окисление, восстановитель |
|
|
|
5)суммируя уравнения полуреакций, составляют ионное уравнение данной реакции, т.е. дополняют запись:
Cr2O72− + 8H+ + 3H2S = 2Cr3+ + 7H2O + 3S(т)
6)на основе ионного уравнения составляют молекулярное уравнение данной реакции, т.е. дополняют запись, причем формулы катионов и анионов,
отсутствующие в ионном уравнении, группируют в
формулы дополнительных продуктов (K2SO4):
K2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
7)проводят проверку подобранных коэффициентов по числу атомов элементов в левой и правой частях уравнения (обычно достаточно только проверить число атомов кислорода).
8)окисленная и восстановленная формы окислителя и восстановителя часто отличаются по содержанию кислорода (сравните Cr2O72− и Cr3+). Поэтому при составлении уравнений полуреакций методом электронно-ионного баланса в них включают пары Н+/Н2О (для кислой среды) и ОН−/Н2О (для щелочной среды).
9)Если при переходе от одной формы к другой исходная форма (обычно
− окисленная) теряет свои оксид-ионы (ниже показаны в квадратных
скобках), то последние, так как они не существуют в свободном виде,
должны быть в кислой среде соединены |
с катионами |
водорода, |
а |
в щелочной среде − с молекулами |
воды, что |
приводит |
к |
23 |
|
|
|

образованию молекул воды (в кислой среде) и гидроксид-ионов (в
щелочной среде):
кислая среда [O2−] + 2H+ = H2O
щелочная среда [O2−] + H2О = 2 ОН−
10)Недостаток кислорода в исходной форме (чаще − в восстановленной) по
сравнению с конечной формой компенсируется добавлением молекул воды (в кислой среде) или гидроксид-ионов (в щелочной среде):
кислая среда H2O = [O2−] + 2H+
щелочная среда 2 ОН−= [O2−] + H2О
Часто слабокислотную и слабощелочную среду условно называют нейтральной, при этом в уравнения полуреакций слева вводят только молекулы воды. В этом случае при составлении уравнения приходится после подбора дополнительных множителей записывать дополнительное уравнение, отражающее образование воды из ионов Н+ и ОН−.
Для кислой среды: |
избыток nО + 2nH+ → nH2O |
|
недостаток nО + nH2O → 2nH+ |
|
|
Для щелочной среды: |
избыток nО + nH2O → 2nОH- |
|
недостаток nО + 2nОH- → nH2O |
|
|
Для нейтральной среды: |
избыток nО + nH2O → 2nОH- |
|
недостаток nО + nH2O → 2nH+ |
|
|
Скорость химической реакции
Для гомогенных реакций:
Для гетерогенных реакций:
где - изменение количества вещества одного из исходных веществ или одного из продуктов реакции; – интервал времени (t2-t1); V – объем газа или раствора; = с1 – с2 – изменение концентрации вещества; S – площадь поверхности соприкосновения веществ.
24

Факторы, влияющие на скорость химической реакции:
1)Природа реагирующих веществ
2)Концентрация веществ
3)Температура
4)Присутствие катализатора или ингибитора
5)Давление
6)Площадь соприкосновения
Зависимость скорости реакции от концентрации реагирующих веществ устанавливает закон действующих масс: скорость химической реакции прямо
пропорциональна произведению концентрации реагирующих веществ в
степенях, равных коэффициентам перед формулами веществ в уравнении
реакции.
mA + nB = pC + qD – общий вид реакции
– кинетическое уравнение реакции где - скорость химической реакции; сА – молярная концентрация вещества «А»;
сВ – молярная концентрация вещества «В»; m и n – коэффициенты в уравнении реакции.
Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на каждые 10оС скорость
большинства химических реакций увеличивается в 2-4 раза.
– математическое выражение правила
где - скорость химической реакции при t1; - скорость химической реакции при t2; - температурный коэффициент, который показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10оС.
Катализаторы – это вещества, ускоряющие химическую реакцию, но сами в ней не расходующиеся.
Ингибиторы – это вещества, замедляющие химическую реакцию, но сами в ней не расходующиеся. Обратное действие катализаторов.
25

Обратимые химические реакции. Химическое равновесие
Реакции, которые одновременно протекают в прямом и обратном направлениях, называют обратимыми.
Состояние химического обратимого процесса, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
Смещение химического равновесия осуществляется по принципу Ле-Шателье:
если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменить концентрацию, температуру, давление), то равновесие смещается в сторону той реакции, которая ослабляет это воздействие.
Пример: 2SO2 + O2 2SO3 + Q
|
2V |
1V |
2V |
|
|
|
|
|
|
Увеличение концентрации исходных веществ |
|
Равновесие смещается в |
||
|
|
|
сторону образования |
|
Уменьшение концентрации продуктов реакции |
|
|||
|
|
|
|
продукта реакции SO3 |
Уменьшение температуры смеси |
|
|
|
|
|
|
|
|
|
Увеличение давления |
|
|
|
|
|
|
|
||
|
|
|||
Равновесие смещается в сторону |
Увеличение концентрации продуктов реакции |
|||
образования исходных веществ |
|
|||
Уменьшение концентрации исходных веществ |
||||
SO2 и O2 |
|
|||
Увеличение температуры смеси |
||||
|
|
|||
|
Уменьшение давления |
|||
|
|
|
|
|
Катализаторы и ингибиторы не оказывают влияния на смещение химического
равновесия.
26
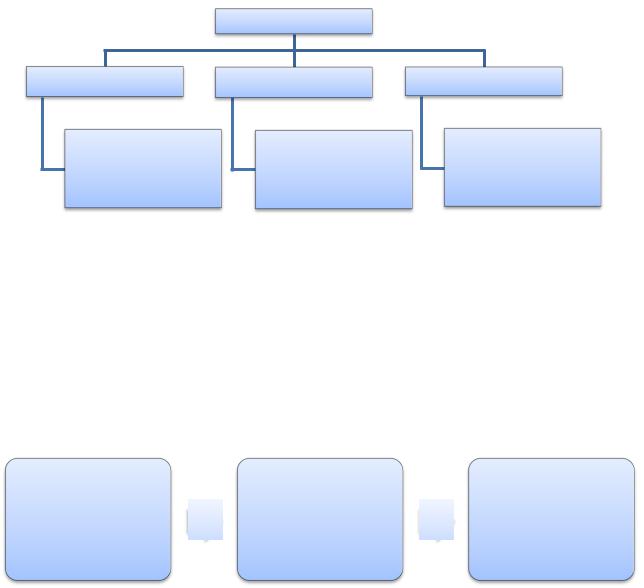
РАСТВОРЫ. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Растворы – это однородные (гомогенные) системы, состоящие из двух или более компонентов и продуктов их взаимодействия.
Пример: раствор H2SO4 состоит из:
1)растворителя – H2O
2)растворенного вещества – H2SO4
3)гидратированных ионов, находящихся в растворе
Растворы
Жидкие |
Газообразные |
Твердые |
Раствор NaCl в
воде, раствор Смеси газов Сплавы металлов сахара в воде и др.
Как правило, смеси твердых веществ являются гетерогенными системами.
Растворимость – это свойство вещества растворяться в воде или в другом
растворителе.
Коэффициент растворимости показывает максимальную массу вещества,
которую можно растворить в 100 г растворителя при данной температуре.
Количество |
Количество |
Количество |
растворенного |
растворенного |
растворенного |
вещества в |
вещества в |
вещества в |
ненасыщенном |
насыщенном |
перенасыщенном |
растворе |
растворе |
растворе |
27
Способы выражения состава раствора
1) Массовая доля растворенного вещества в растворе (w):
|
|
|
|
|
|
где |
– масса растворенного вещества; |
– масса раствора; |
|
– общий |
|
|
|||||
объем раствора;  – плотность раствора.
– плотность раствора.
2) Молярная концентрация раствора:
где с – молярная концентрация; n – количество растворенного вещества; V – объем
раствора.
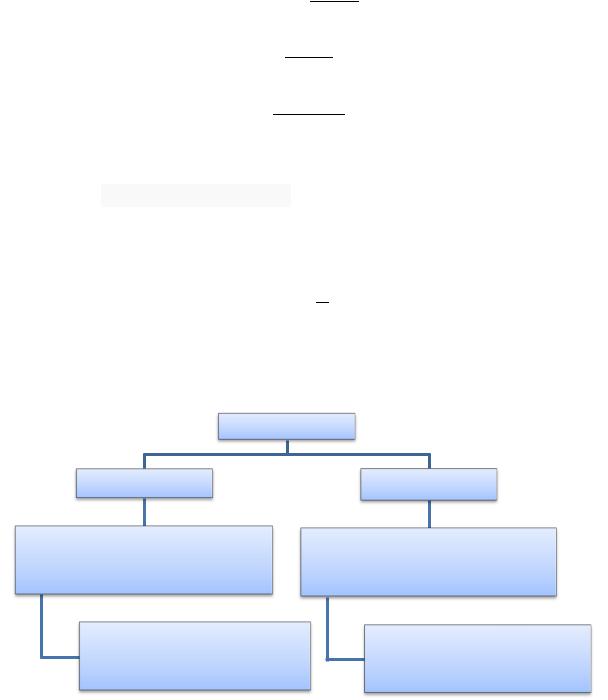
Вещества
Электролиты |
Неэлектролиты |
Вещества, растворы и расплавы которых проводят электрической ток
Вещества с ионной и ковалентной полярной связью
Вещества, растворы и расплавы которых не проводят электрический ток
Вещества с неполярными и малополярными ковалентными связями
28
Теория электролитической диссоциации (1887 г., Сванте Аррениус)
Электролиты при растворении в воде распадаются (диссоциируют) на «+» и «-» ионы – процесс электролитической диссоциации.
Под действием электрического тока ионы приобретают направленное движение: катионы движутся к катоду, анионы к аноду.
Степень диссоциации ( ) зависит от природы электролита и растворителя,
температуры, концентрации раствора.
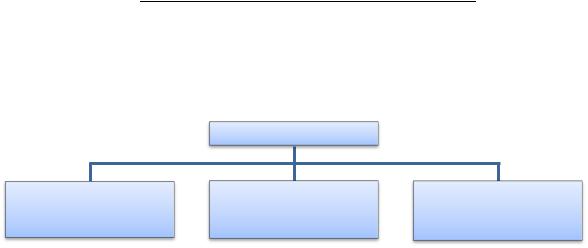
Электролиты
Сильные |
Средние |
Слабые |
(α > 30%) |
(3% < α < 30%) |
(α < 3%) |
Реакции ионного обмена
Все реакции в водных растворах электролитов являются реакциями между
ионами – ионными реакциями, уравнение этой реакции – ионными уравнениями.
Условия протекания реакций ионного обмена до конца:
1)Образование осадка
2)Образования газа
3)Образование малодиссоциирующего вещества
Алгоритм составления ионных уравнений:
1)Написать уравнение реакции в молекулярной форме.
2)Определить причину, за счет которой реакция обмена идет до конца и отметить это в уравнении реакции соответствующим образом (↑ или ↓).
3)Запишите ионы диссоциирующих веществ, указав их число и заряды.
29
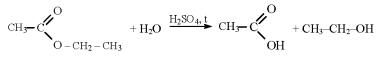
4)Отметьте одинаковые ионы (они не принимают участие в реакции) в левой и правой частях уравнения реакции.
5)Запишите строкой ниже оставшиеся ионы и вещества (сокращенное ионное уравнение).
6)Сформулируйте вывод на основе сокращенного ионного уравнения.
Пример: FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl Fe3+ + 3Cl- + 3Na+ +3OH- → Fe(OH)3↓ + 3Na+ + 3Cl-
Fe3+ + 3OH- → Fe(OH)3↓
Вывод: реакция ионного обмена идет до конца, так как образуется осадок.
Гидролиз
Гидролиз – это реакция обменного (гидролитического) разложения веществ водой.
Гидролизу подвергаются многие вещества:
1)Карбиды: CaC2 + 2H2O = Ca(OH)2 + C2H2↑
2)Нитриды: Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3↑
3)Фосфиды: Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3↑
4)Галогениды: SiCl4 + 3H2O = H2SiO3↓ + 4HCl↑
5)Углеводы: C12H22O11 + H2O = C6H12O6 + C6H12O6
6)Сложные эфиры, в т.ч. жиры:
и др.
Гидролиз соли – это процесс обменного взаимодействия ионов соли с
молекулами воды.
Факторы, влияющие на степень гидролиза солей: химическая природа соли, температура, концентрация ионов Н+ и ОН- в растворе.
30
