
shpory_k_ekzu_po_BKh1
.pdf
Ферменты, как и все катализаторы, сниж э активации |
субстратов по одному из возможных путей его превращения. Разли- |
катализируемой ими реакции и направляют медленно |
чают специфичность: |
текущую реакцию по иному пути, характер-ся более |
-Абсолютную (Фермент имеет активный центр, кот комплементарен |
низкой энергией переходного состояния. Ферменты |
только 1субстрату. Аргиназа, катализ-щая расщепление аргинина на |
обладают уникальным св-м - субстратной специфич- |
орнитин и мочевину, аспартаза, катализирующая реакцию), |
ностью. благодаря кот только один или несколько |
-групповую (относительную)- (Фермент способен катализировать |
субстратов связ-ся в активном (преимущественно |
однотипные реакции с небольшим кол-вом структурно схожих суб- |
гидрофобном) центре фермента. При фермент- |
стратов. |
субстратном взаимодействии происходит: |
-Стереоспецифичность (Фермент способен катализировать превра- |
1) сближение и необходимая ориентация субстратов |
щения только одного из двух стереоизомеров.), |
или реагирующих групп одного субстрата |
-Двойственную(Фермент взаимодействует с резко различающимися |
2) удаление гидратной обол субстрата(в итоге внут- |
по структуре субстратами). |
ри активного центра создаются совсем др усл, чем в |
Зависимость ск ферментативной реакции от величины рН обуслов- |
р-ре); |
лена влиянием рН р-ра на ионизацию функциональных гр в активном |
3) ослабляется разрываемая связь между атомами |
центре фермента, поверхностных группировок фермента и функцио- |
субстрата. |
нальных гр субстрата. |
32) Изоферменты - ферменты, катализирующие |
Отклонение рН от оптимального значения приводит к изменению |
одну и ту же реакцию и облад одинаковой субстрат- |
конформации фермента и его активного центра, а также субстрата, в |
ной специфичностью, но различающ каталитич ак- |
итоге наруш-ся взаимодействие субстрата и кофермента с активным |
тивностью, усл активации, видом связи апофермента |
центром фермента. При значительном отклонении от оптимального |
с коферментом, физико-химическими свойствами |
значения рН ферментативная активность утрачивается из-за денату- |
(мол массой, изоэлектрической точкой, электрофоре- |
рации фермента. |
тической подвижностью. Существование изофермен- |
35) Завис-ть ск ферментативной реакции от концентр фермента и |
тов чаще всего имеет генетич природу - они кодиру- |
субстрата. |
ются разными генами (как у а-амилазы), или сост из |
При увелич концентр фермента (если конц субстрата значит превыш |
разных наборов субъединиц (например у лактатде- |
концентр фермента и не изменяется) ск реакции увелич линейно. За- |
гидрогеназы). |
висимость между ск реакции и конц фермента прямо пропорц |
33) Классификация и номенклатура ферментов: |
V=k([S]). |
ОКСИДОРЕДУКТАЗЫ - сложные белки, В качестве |
При пост концентр фермента ск реакции по мере увеличения конц |
акцептора электронов используются коферменты |
субстрата увелич-ся гиперболически. Зависимость V=k(l/[S]), дости- |
НАД+, НАДФ+, ФАД, ФМН, гем, дигидробиоптерин, |
гая предельной макс ск (кривая Михаэлиса). |
ионы металлов. |
Константа Михаэлиса (Кm) численно равна той концентрации суб- |
ТРАНСФЕРАЗЫ - как сложные, так и простые бел- |
страта, при кот ск реакции составл половину макс. Величина Кm - ха- |
ки, ГИДРОЛАЗЫ - большинство ферментов - про- |
рак-ка каталитич активности фермента,чем она меньше, тем выше |
стые белки, лишь немногие содержат ион металла. |
активность ферм. |
Подразделяются на подклассы в зависимости от рас- |
Уравнение Михаэлиса-Ментен: |
щепляемой связи. |
V= Vmax [S]/ Km+[S] |
, ЛИАЗЫ -как простые, так и сложные белки; кофер- |
При низк концентрации субстрата [S] ск ферментат реакции V опред- |
ментами могут быть пи-ридоксальфосфат, ТДФ, . |
ся частотой столкновений мол субстрата S и фермента Е. Уравнение |
ИЗОМЕРАЗЫ - большая их часть является простыми |
Михаэлиса-Ментен: |
белками, но есть и сложные , ЛИГ АЗЫ |
V= Vmax [S]/ Km+[S] |
(СИНТЕТАЗЫ).- большинство этих ферментов про- |
При низк концентрации субстрата [S] скорость ферментативной реак- |
стые белки но некот (образующие С—С связи) со- |
ции V определяется частотой столкновений мол субстрата S и фер- |
держат биотин. Подклассы зависят от природы обра- |
мента Е. При повыш [S] кол-во фермент-субстратных комплексов [ES] |
зующейся связи). |
возрастает и увелич и ск реакции. |
34) Специфичность действия ферментов. Для фер- |
|
ментов характерна высокая специфичность по отнош |
|
к катализируемой реакции (реакционная или ка- |
|
талитическая специфичность) и соответствующим |
|
субстратам (субстратная спе цифичность). Реакцион- |
|
ная специфичность заключается в том, что фермент |
|
|
|
При полн насыщении субстратом мол фермента увеличение конц субстрата [S] уже не вызыв увелич ск реакции. Графич такая кинетич зависимость описывается гиперболической кривой. Кинетич зависимость такого вида назт кинетикой Михаэлиса-Ментен, а все подчиняющиеся этой модели ферменты - ферментами Михаэлиса-Ментен. Кажд фермент характ-ся макс ск Vmax и константой Михаэлиса Кm. Это главные количеств хар-ки фермента. Для практич определения этих кинетич параметров всегда использ координаты Лайнуивера-Бэрка. Главн причина этого сост в том,что в прямых координатах никогда невозможно точно определить Vmax и Кm.
36)Ингибиторами ферментов, снижающ их каталитич активность, явл ионы или небольш мол, составл часть ферментативной регуляторной сист, а также фармакологич препараты.
1. Необратимое ингибирование - стойкое ингибирование фермента, возник в рез ковалентного связывания мол ингибитора с акт центром фермента либо с особым центром, кот изменяет конформацию фермента. Сопровожд разруш или модификацией 1или неск функц гр фермента. Преодолеть последствия ингибирования такого типа организм может, только синтезировав нов мол фермента. Пример
необратимого ингибирования - действие ионов тяж металлов (Hg 2+), мышьяка (As 3+). Неспецифич необратимое ингибир-ие - действие алкилирующих агентов, необратимо реагир с активными - SH - гр остатков цистеина б, в т ч и ферментов.
2. Обратимое ингибирование. Большинство ингибиторов образуют нековалентные связи с ферментом, и при определ усл диссоциируют с восстановлением его активности.
Сущ 2 вида обратим ингибирования: конкурентное мигрирование и неконкурентное (или бесконкурентное). Конкурент ингиб-ие - проц торможения ферментативной активности, вызванный присутств ингибитора, структурно схожего с субстратом. Бесконкурентное ингиб-ие отлич от конкурентного тем, что оно не м б ослаблено или устранено увеличением конц субстрата.
37)Энзимодиагностика:
- определ активности ферментов в биологич жидкостях (плазме кр, моче, секретах пищеварит тракта) для постановки диагноза. Для диагн-ки в клинике исследуют ферменты второй группы. В N их активность в плазме незначит, но увелич при поврежд тк - источника ферментов, или при избыточной клеточной пролиферации (в период акт роста костей, особенно у детей и подростков, и при онкопролиферативных проц).

катализирует определенный тип каталитических превращений одного или нескольких
38) Кофакторы ферментов: ионы металлов и коферменты. Активность ряда фермен-
тов (прост б) в N завис только от их структуры, тогда как для др, названных холоферментами (сложн б), требуются кофакторы – ве-ва небелк природы, в роли кот м б сложн органич соедин-я (коферменты) и ионы металлов.
Кофактор м образовывать с апоферментом прочн ковалентные связи. В этом случае кофермент наз простетической гр фермента. Примерами могут служить ФАД, ФМН, биотин. Коферментные формы вит В6 включ в реакции, катализируемые почти всеми кл ферментов. Наиб значительная гр пиридоксалевых ферментов – аминотрансферазы.
PP - предшественник коферментов - никотинамидадениндинуклеотида (НАД+) и никоти- намидадениндинуклеотид-фосфата (НАДФ ), вход в сост дегидрогеназ и редуктаз. НАД+ и НАДФ+ приобр коферментные фу-ии после присоедин к никотинамиду радикала, включ остаток рибозы, пирофосфат и нуклеотид - аденин. Вит РР такими фу-ми не обладает.
B2 Кофермент ФМН и ФАД
1.ФМН и ФАД - коферменты оксидаз,перенос элек-
троны с окисляемого субстрата на О2. Это ферменты распада аминок-т (оксидазы D- и L-аминокислот), нуклеотидов (ксантиноксидаза),биогенных аминов (моно- и диа-минооксидазы).
2.ФАД - кофермент пируват- и альфакетоглутаратдегидрогеназных комплексов.
39) Витамины: Большинство вит вход в сост коферментов,и поэтому они необход организму. Вит А служит кофактором б неферментной природы — родопсина, или зрительного пурпура; этот б сетчатки глаза участвует в восприятии света. Вит D (точнее, его производное — кальцитриол) регулирует обмен Ca; по механизму действия он сходен с гормонами — регуляторами обмена и фу-ий организма. Вит Е (токоферол) выполн роль антиоксиданта. Вит делят на 2 гр: жирорастворимые — витамины A, D, Е, К и водорастворимые - все остальные. Водораств вит вкл аскорбиновую к-ту (вит С)и витамины гр В. Гиповитаминозы- сост, при кот снижена концентр вит в тк организма, При леч аб-ми, СА и др лекарствами, угнетающими кишечную флору, м возникать гиповитаминоз Гипервитаминозы - Избыточное потребл вит приво-
дит к нар обмена и фу-й организма, кот связаны со специфич ролью вит в обмене ве-в, носят характер неспецифич отравления. Гипервит-ы возник редко, т к сущ мех-мы устранения избытка вит из тк, и лишь
40)Вит - низкомолекулярные органич соединения различной хим природы, необход в незначит кол-вах для N обмена ве-в и жизнедеятельности живых организмов. Многие вит — предшественники коферментов, в составе кот участвуют в различных ферментативных реакциях.
+ см предыдущий вопрос
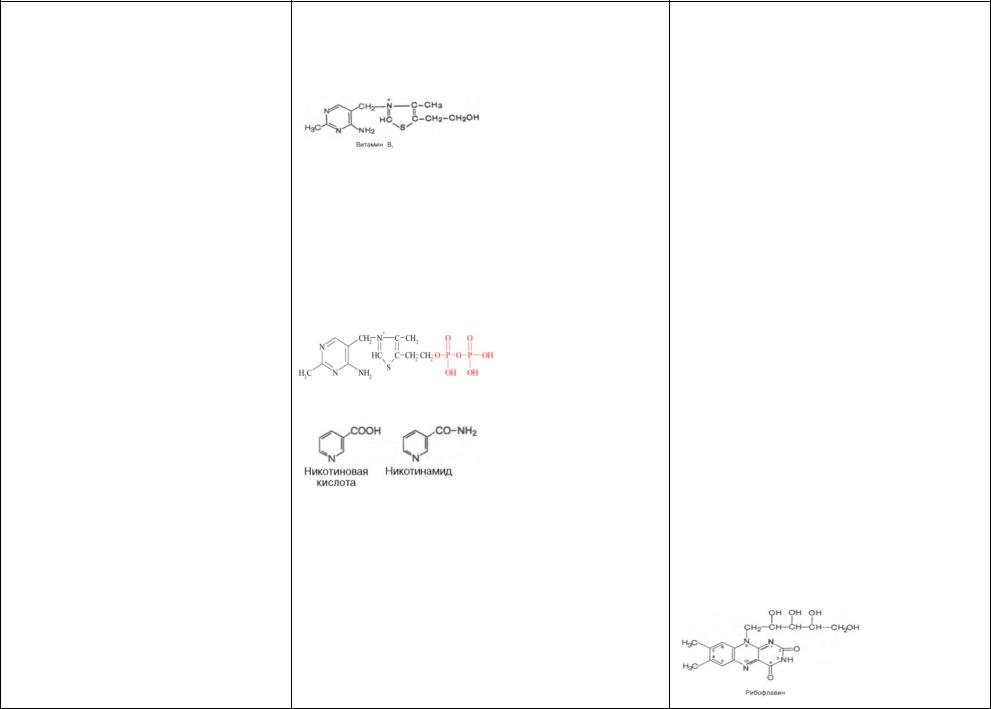
41)Витамин В1 (тиамин)
- хорошо раствор воде. Его водные р-ры в кислой среде выдерживают нагрев до выс t без сниж биологич активности. В нейтр и щелочн среде вит B1, быстро разруш при нагревании. (частичное или полное разруш B1 при кулинарной обработке пищи).Вит B1 легко всасывается в ки-ке, но не накапл-ся в тк и не облад токсич св-ми. Избыток выводится с мочой.
Тиамин помогает организму эффективно использовать сахара и крахмал. При отсутствии или недостаточности развив тяж забол – бери-бери распростр в ряде стран Азии и Индокитая,где основнпродуктом пит явл рис.
42)Тиаминпирофосфат - это активн форма тиамина(или тиаминди- фосфат)-образ-ся при участии специфич АТФ-зависимого фермента тиаминпирофосфокиназы(содерж в печени и тк мозга)
43)Витамин РР(Никотиновая к-та) -соединение пиридинового ряда, содерж карбоксильную гр (никотинамид отлич наличием амидной гр).
РР малорастворим в воде (примерно 1%), но хор растворим в водных р-рах щелочей. Вит кристаллизуется в виде белых игл. Наиб характерными признаками авитаминоза РР, т.е. пеллагры явл поражения кожи (дерматиты), пищеварит тракта (диарея) и нар нервн деятельности (деменция). Биологическая роль-РР вход в состав НАД или НАДФ, явл коферментами многих обратимо действ в окислвосстановит. реакциях дегидрогеназ. 44)НАДФ и НАД: Никотина-
мидадениндинуклеотидфосфат (НАДФ)- участв в реакциях окисл — восстановл. Структура НАДФ служит акцептором водорода при окисл углеводов; в восстановленной форме явл донором водорода при биосинтезе жирных к-т. В хлоропластах растит кл НАДФ восстанавл-ся при световых реакциях фотосинтеза.
НАД (никотинамидадениндинуклеотид)- кофермент, при-
сутств во всех живых кл; входит в состав ферментов гр дегидрогеназ, катализирующих окисл-восстановительные
реакции. 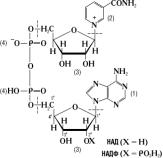
Во многих окисл-восстанов реакциях НАД или НАДФ присоедин протон и 2 электрона, переносимые от окисляемого субстрата к окисленному коферменту; в обратной реакции водород переносится от восстановл кофермента к субстрату. При этом водород отщепл-ся и присоед-ся к атому углерода амида никотиновой кислоты в 4-м положе-
нии: 
45) Витамин В2 (рибофлавин)- В основе лежит гетеро-
циклич соединение изоаллоксазин (сочет бензольного, пиразинового и пиримидинового колец), к кот в полож 9 присоединен пятиатомный спирт риби-тол. Рибофлавин хор раствор в воде, устойчив в кислых р-рах,но легко раз- руш-ся в нейтр и щелочных р-рах. Он весьма чувствителен к видимому и УФ-излучению и сравнит легко подвергается обратимому восстан-ию, присоединяя водород по месту двойных связей и превращаясь в бесцветную лейкоформу.
Это свойство рибофлавина легко окисляться и восстанавливаться лежит в основе его биологического действия в клеточном метаболизме. Клинич проявл недостаточности рибофлавина на эксперимент животных.Помимо остановки роста, выпадения волос(алопеция), характерных воспалит проц слизистой оболочки языка (глоссит), губ, особенно у углов рта, эпителия кожи.
Биологич роль-
потребл больших кол-в вит м б опасным. Более ток- |
|
Рибофлавин входит в состав флавиновых коферментов, в |
сичны жирораствор вит, особенно А и D. |
|
частности ФМН и ФАД , являющ в свою очередь просте- |
|
|
тическими гр ферментов ряда других сложн б – флавопро- |
|
|
теинов. |
|
|
|
46) Во флавиновых коферментах (ФАД-
флавинмононуклеотид или ФМНфлавинаденинуклеотид), активной частью мол кот явл изоаллоксазиновое кольцо, в результате восстановления чаще всего наблюд присоедин 2 протонов и 2 электронов одновременно:
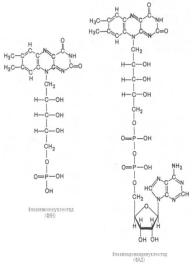 Восстановл формы этих кофакторов способны транспортировать водород и электроны к дых цепи митох или иных энерго-сопрягающих мембран.
Восстановл формы этих кофакторов способны транспортировать водород и электроны к дых цепи митох или иных энерго-сопрягающих мембран.
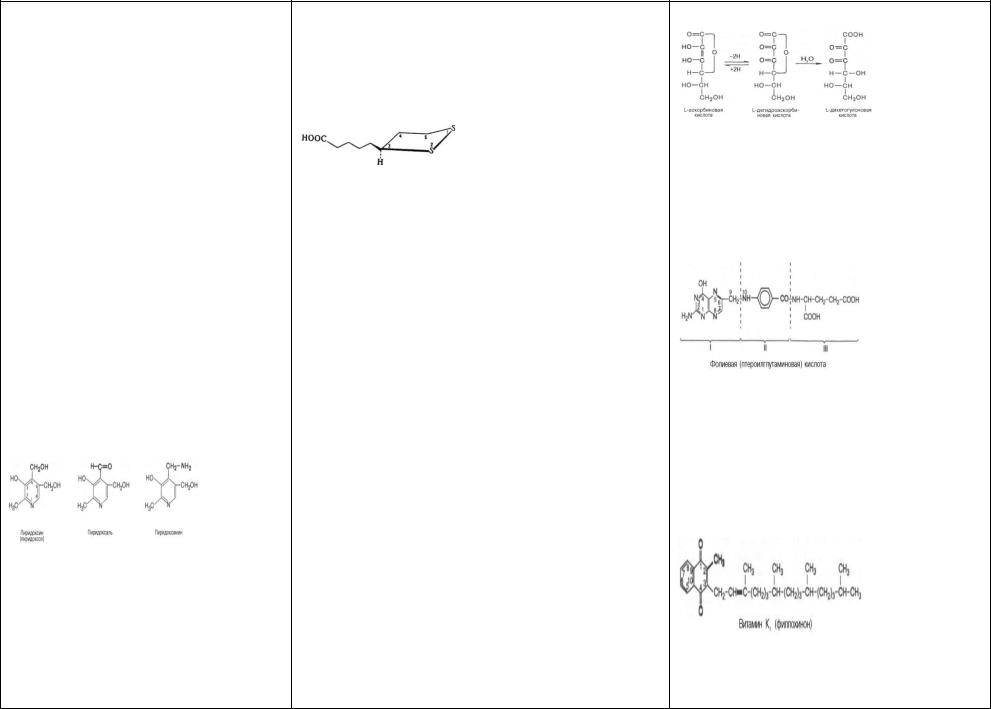
47) Витамин В6 (пиридоксин, антидерматитный)- самост независ пищевой фактор.Термином вит В6, обознач все три производных 3-оксипиридина, об- лад-х одинаковой вит активностью: пиридоксин (пи-
ридоксол), пиридоксаль и пиридоксамин:
У члка недостаточность вит В6 встреч редко, хотя некот пеллагроподобные дерматиты, не поддающиеся леч никотиновой к-той,проходят при введении пиридоксина. Все три производных 3-оксипиридина наделены витаминными св-ми, коферментные ф-и выполн только фосфорилированные производные пиридоксаля и пи-ридоксамина.
48) Пантотеновая кислота (вит В3)- явл комплекс-
ным соединением β-аланина и 2,4-диокси-3,3-
Биологическая роль. Пантотеновая к-та вход в состав кофер-мента А, или коэнзима А (КоА). Название «коэнзим А» (кофермент ацилирования) связано с тем,что это соед-ие участвует в ферментативных реакциях, катализирующих активирование и перенос ацетильного радикала СН3СО; что КоА активирует и перенос также др кислотные остатки (ацилы).
ЛИПОЕВАЯ КИСЛОТА-кофермент, участв в каталитич. р-циях переноса атомов Н и ацильных гр; незаменимый фактор роста (вит) для молочнокислых бакт, кот его не синтезируют.
49) БИОТИН (вит Н)- один из гр витВ; кофермент, участв в карбоксилировании орг. к-т. С ферментами связан пептидной связью, образованной его карбоксильной грй и аминогр остатка лизина в мол апо-
фермента. 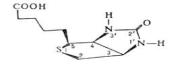
Витамин В12 (кобаламин антианемический вит)- В моле В12 центр атом кобальта соединен с атомами азота четырех восстановленных пиррольных колец, образ порфириноподобное корриновое ядро, и с атомом азота 5,6-диметил-бензимидазола . У члка и жив недостаток В12 приводит к развитию злокач макроцитарной, мегалобластической анемии. Помимо изменений кроветв ф-и, для авитаминоза В12 специфичны также нар деятельности НС. Биологическая роль. Выявлены ферментные системы, в составе кот в качестве простетической гр участвуют не свободный В12,а В12-коферменты, или кобамидные коферменты. Хим реакции, в кот В12 приним участие как кофермент, условно делят на 2 гр в соответствии с его хим природой. К 1 гре относ реакции трансметилирования, в кот метилкобаламин выполн роль промежуточного переносчика метильной гр (реакции синтеза метионина и ацетата).
50) (УТФ) уридинфосфорная кислота, молекула кот содержит 3
остатка фосфорной кислоты; участвует, напр., в биосинтезе рибонуклеиновой кислоты. Пути биосинтеза пиримидиновых нуклеотидов сложнее, чем пути синтеза пуриновых нуклеотидов. Прежде всего исходный УМФ фосфорилируется до ди-, затем трифосфата УТФ .
УТФ превращается цитидинтрифосфат в (ЦТФ ).
51)Аскорбиновая к-таВитамин С (аскорбиновая к-та; антискорбутный витамин) получил название антискорбутного, антицинготного фактора, предохр от развития цинги. По хим структуре С представл собойлактон к-ты со структурой, близкой структуре
L-глюкозы; оконч строение вит С было установлено после синтеза его из L-ксилозы.
Наиб характерным признаком недостаточности вит С явл потеря способности депонировать межкл «цементирующие» ве-ва, что вызыв пораж сосудистых стенок и опорных тк. Биологическая роль. Вит С участвует в окисл-восст проц, хотя до сих пор не выделены ферментные сист, в состав простетических гр кот он входит.
52) Фолиевая к-та (фолацин) –Витамин Вс.
Фолиевая к-та сост из 3 структурных единиц: остатка 2- амино-4-окси-6-метилптеридина (I), парааминобензойной (II) и L-глута-миновой (III) к-т и имеет след структуру:
Фолиевая к-та ограниченно раствор в воде, но хор растворима в разбавл р-рах спирта; В организме фолиевая к-та восст-ся до тетрагидрофолиевой к-ы, явл коферментом, участвв разных метаболич проц. Она необходима для N образования кл крови, включ проц созрев мегалобластов и образов нормобластов. Недостаток фолиевой к-ты тормозит переход мегалобластической фазы кроветворения в нормобластическую.
53) К вита гр К(жирораствор) относ 2 типа хинонов с боковыми цепями, представленными изопреноидными звеньями (цепями): вит К1 и К2 . В основе циклич структуры обоих вит лежит кольцо 1,4-нафтохинона.

диметил масляной к-ты.
Пантотеновая к-та представляет собой вязкую свет- ло-желтую жидкость, хорошо раствор в воде; она малоустойчива и легко гидролизуется поместу пептидной связи под действием слабых кислот и щелочей.
Биологич роль. Вит К приним участие в синтезе протромбина в печени, вероятно, через ферментную сист, необходим как стимулятор биосинтеза в печени мин 4 белковферментов, участв в слож проц свертывания крови.
54)Токоферол (Витамин Е)-жирораствор.- Актив-
ное в-во, предохр от бесплодия, было выделено из масла пшеничных зародышей и хлопкового масла. В наст вр известно 5 природных соединений, облад биологич активностью вит Е.
 Недостаточность вит Е вызыв нар эмбриогенеза и дегенеративные изм репродукт органов- стерильности.У самок в большей степени поражается плацента, чем яичники; проц оплодотворения яйца не нарушен, но скоро плод рассасывается.У самцов происх атрофия половых желез, привод к полной или частичной стерильности. Токоферолы явл наиб активными и главн природн жирораствор антиоксидантами: разруш наиб реактивные формы кислорода и соответственно предохр от окисления полиненасыщенные жирные к-ты.
Недостаточность вит Е вызыв нар эмбриогенеза и дегенеративные изм репродукт органов- стерильности.У самок в большей степени поражается плацента, чем яичники; проц оплодотворения яйца не нарушен, но скоро плод рассасывается.У самцов происх атрофия половых желез, привод к полной или частичной стерильности. Токоферолы явл наиб активными и главн природн жирораствор антиоксидантами: разруш наиб реактивные формы кислорода и соответственно предохр от окисления полиненасыщенные жирные к-ты.
55)Витамин А (ретинол, антиксерофтальмич вит)-
жирораствор.- явл предшественником гр "ретиноидов", к кот принадл ретиналь и ретиноевая к-та. Ретинол образ при окислит расщепл провит β-каротина. Ретиноиды содержатся в животных продуктах(в печени животных), а β-каротин — в свеж фруктах и овощах (в моркови). Ретиналь обуславл окраску зрит пигмента родопсина.Ретиноевая к-та выполн ф-и ростового фактора. При недостатке вит А развив ночн ("куриная") слепота, ксерофтальмия (сух роговой оболочки глаз), наблюд наруш роста.
56) Вит D (кальциферол; антирахитический вит)-
сущ в виде неск соедин, различ-ся как по хим строению, так и по биолог активности. Для члка и животных активными препаратами считаются вит D2и D3.
С хим точки зрения эргостерин(ол) представл собой одноатомный ненасыщ циклич спирт, в основе структуры кот лежит конденсированная кольцевая сист циклопентанпергидрофенантрена. Под действ УФ-лучей эргостерин ч/з ряд промежуточных про-
обмена и нар отложения в костной тк фосфата Са. Поэтому основ симпт рахита обусловл нар N проц остеогенеза. Развивается остеомаляция – размягчение костей. Кости стан мягкими и под тяжестью тела приним О- или Х-образные формы.
57)Углеводы. (сахара) - обширная гр полигидроксикарбонильных соед., вход в состав всех живых организмов; Классификация - принято делить на моносахариды (углеводы,
представл собой полигидроксиальдегиды (альдозы) и полигидрокси-
кетоны (ке-тозы) общей ф-лы СnН2nОn (п = 3-9), в к-рых кажд атом С (кроме карбонильного) связан с группой ОН, и производные этих
соед., содержащие разл. др. функц. группы, а также атом Н вместо одного или неск. гидроксилов.), олигосахариды (углеводы, мол кот построены из неск. моносахаридных остатков (от 2 до 10-20), соедин гликозидными связями (экзоциклич. связь ано-мерного атома С моносахарида с атомом О соседнего моносахаридного остатка). В соответствии со степенью полимеризации различают дисахариды (биозы), трисахари-ды (триозы), тетрасахариды (тетраозы)) и полисахари-
ды((гликаны), полимерные углеводы, мол кот построены из моноса-
харидных остатков, соединенных гликозидными связями.).
У члка и животных углеводы выполн важн ф-и: энергетич (главн вид клеточного топлива), структурную (обязат компонент большинства внутриклеточных структур) и защитную (участие углеводных компонентов иммуноглобулинов в поддержании иммунитета). С нар обмена углеводов тесно связан ряд забол: сах диабет, галактоземия, нар в сист депо гликогена, нетолерантность к молоку.
в организме чла и животного углеводы присутс в меньшем кол-ве (не более 2% от сухой массы тела), чем белки и липиды; в растит организмах за счет целлюлозы на долю углеводов приходится до 80% от сухой массы, поэтому в целом в биосфере углеводов больше, чем всех др органич соединений вместе взятых.
Моносахарид-глицериновый альдегид
Олигосахаридмальтоза,лактоза Полисахаридманноза,галактоза
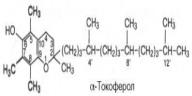
58) По своему функц назначению гомополисахариды м б разделены на 2 гр: структурные и резервные полисахариды. Важным структур-
ным гомополисахаридом явл целлюлоза, а главными резервными – гликоген и крахмал (у животных и растений соответственно).
Крахмал, как отмечалось, является основным резервным материалом растительных организмов
Целлюлоза: 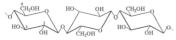
Гетерополисахариды:
Важн представители в органах и ткх животных и члка – гликозаминогликаны (мукополисахариды). Они сост из цепей сложных углеводов, содержащих аминосахара и уроновые к-ты.
гликозаминогликаны – основ компонент внеклеточного в- ва – желатинообразного вещества, заполн межклеточное пространство тканей. Они также содержатся в больших кол-вах в синовиальной жидкости – это вязкий материал, окруж суставы, кот служит смазкой и амортизатором.
Гиалуроновая кислота (Гиалуронат):
59)Биосинтез Мукополисахаридов. включает построение полимерных предшественников и их послед. модификацию путем эпимериза-ции остатков D-глюкуроновой к-ты в L- идуроновую, N-де-ацетилирования и послед. N- сульфатирования остатков N-ацетил-D-глюкозамина, а также сульфатирования гидро-ксильных групп. Этим объясняется образование "гибридных" структур, содержащих в одной молекуле дисахаридные звенья неск. типов (напр., хондроитинсульфата-дерматан-сульфата, гепарансульфата – гепарина.
60)Гликоген-депонированная форма глюко-
зы,высвобождает эту гексозу при участии гликогенфосфо-

дуктов (люмистерин, тахистерин) превращ в вит D2. Недостаток вит D в рационе детей привод к возникн шир известного забол–рахита, в основе кот лежат измен фосфорно-кальциевого
рилазы.Фермент катализирует фосфоролиз 1,4- гликозидной связи с высвобожд остатков глюкозы.
Биосинтез и распад гликогена: Биосинтез осуществл с помощью ферментов гликозилтрансфераз. Исходным в- вом для синтеза м служить
мол олигосахарида, сост из остатков глюкозы, или б, глюкозилированный в резе переноса на него остат- каглюкозы с уридиндифосфатглюкозы. Гликоген расщепл с помощьюфермента фосфорилазы, перенос
остаток глюкозы на фосфорную к-ту с образ -D-
-D-
глюкозо-!-фосфата, и разл. гидролаз (напр., - глюкозидазы), катализир гидролиз связей 1 -> 4 и 1 - > 6. Распад и синтез Гликоген регулируется гормонами надпочечников и поджелудочной железы, напр. инсулином и адреналином. Нар обмена гликогена прив к забол (гликогенозам), связ с накопл его в больш кол-вах в орг-зме (в печени и сердце) или об-
- глюкозидазы), катализир гидролиз связей 1 -> 4 и 1 - > 6. Распад и синтез Гликоген регулируется гормонами надпочечников и поджелудочной железы, напр. инсулином и адреналином. Нар обмена гликогена прив к забол (гликогенозам), связ с накопл его в больш кол-вах в орг-зме (в печени и сердце) или об-
раз мол с отклонениями в строении.
Синтез и распад гликогена в тканях, прежде всего в печени. В присутствии фосфорилазы гликоген распадается с образ фосфорного эфира глюкозы (глю- козо-1-фосфата) без предварительного расщепл на более крупные обломки мол полисахарида.
Синтез гликогена:
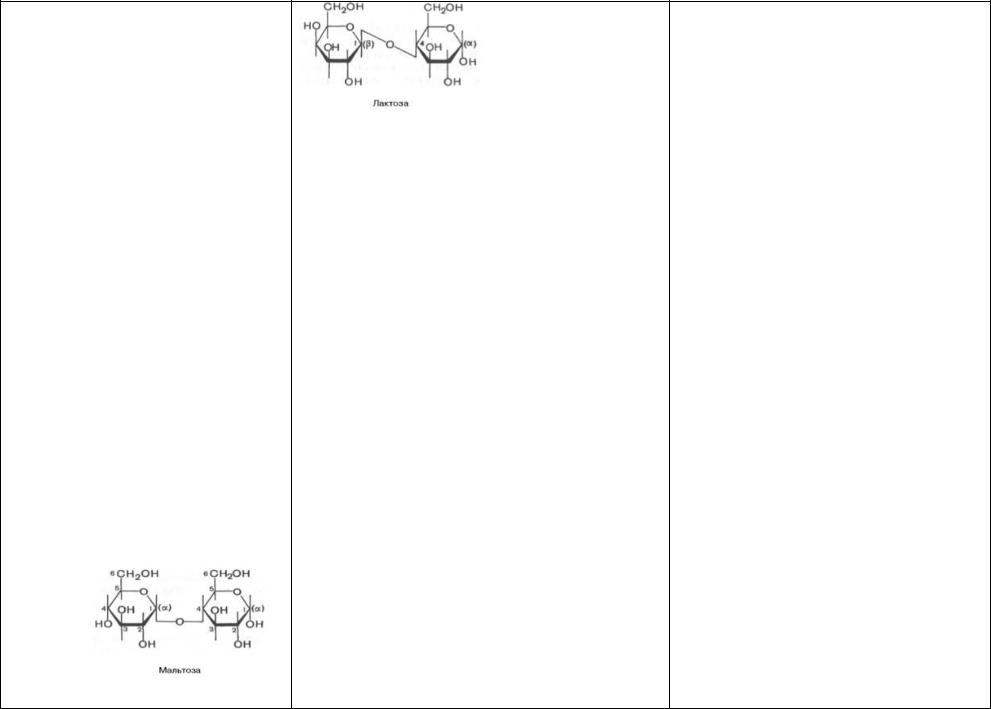
61)Дисахариды- При образ гликозидной связи между аномерной гидроксильной гр 1 моносахарида и ОН-гр др моносахарида получ дисахарид. Поскольку синтез природных дисахаридов с участием ферментов строго стереоспецифичен, гликозидная связь м находиться только в одной из возможных конфигураций (α или β). Дисахариды – сложн сахара, кажд мол кот при гидролизе распад на 2 мол моносахаридов. Дисахариды наряду с полисахаридами явл одними из основных источников углеводов в пище члка и животных. По строению дисахариды – это гликозиды, в кот 2 мо моносахаридов соединены глико-
зидной связью.
Многие дисахариды — ценные пищевые продукты. Примен в микробиологии и медицине.
62)Наследственные нарушения обмена дисахаридов: Непереноси-
мость дисахаридов — наследственная или приобрет недостаточность активности дисахаридаз, обусловливающая нар расщепл и всас дисахаридов; вызыв непереносимость лактозы, сахарозы и/или мальтозы; проявл расстройствами пищевар и питания в виде хронич ферментативной диспепсии.

