
- •Первый Московский Государственный Медицинский Университет
- •Модуль №01. Основы количественного анализа.
- •Перманганатометрия Задания для самостоятельной работы
- •Определение молярной концентрации эквивалента и массы дихромата калия в растворе.
- •Модуль №02. Химическая термодинамика. Энергетика химических реакций.
- •Расчеты
- •Экспериментальные данные
- •Расчеты: Энергию активации Еа реакции рассчитывают по формуле:
- •* В выводах указывают полученные результаты: значения: 1) констант скорости при комнатной и повышенной температурах; 2) энергии активации; 3) температурного коэффициента Вант-Гоффа.
- •Расчеты
- •Экспериментальные данные
- •Расчеты:
- •Задания для самостоятельной работы
- •Наблюдение явлений плазмолиза и гемолиза эритроцитов
- •Модуль №05. Протолитические равновесия и процессы.
- •Экспериментальные данные
- •Задания для самостоятельной работы
- •Лабораторная работа 6.2 Изучение простых и совмещенных протолитических равновесий.
- •Задания для самостоятельной работы
- •Свойства буферных растворов.
- •Экспериментальные данные
- •Расчет рН
- •Экспериментальные данные
- •* В выводе кратко формулируют механизм буферного действия.
- •Задания для самостоятельной работы
- •Буферная емкость растворов.
- •Модуль 06. Гетерогенные равновесия и процессы.
- •Расчет пс:
- •2 Семестр модуль 07. Лигандообменные равновесия и процессы Задания для самостоятельной работы
- •Задания для самостоятельной работы
- •Тема: Простые и совмещенные лигандообменные равновесия
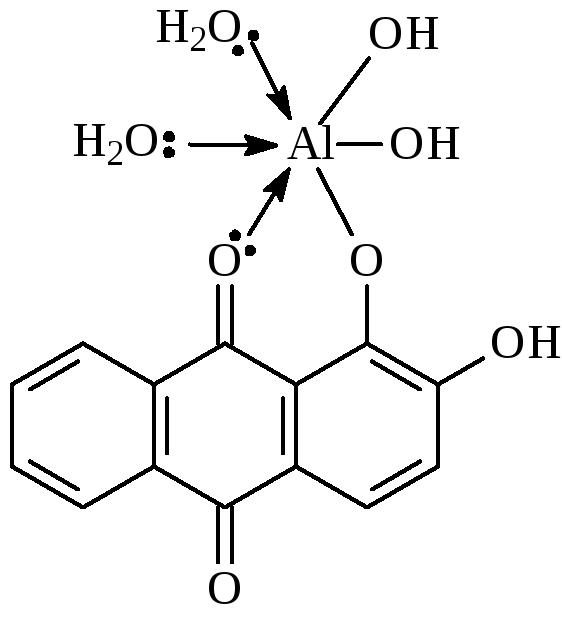
- •1А. Взаимодействие ионов алюминия с ализарином
- •1 Пробирка:
- •2 Пробирка:
- •3 Пробирка:
- •Модуль 08. Редокс-равновесия и редокс-процессы Задания для самостоятельной работы
- •Окислительно-восстановительные свойства веществ. Определение направления редокс-процессов.
- •Задания для самостоятельной работы
- •Изучение зависимости редокс-потенциала от соотношения концентраций окисленной и восстановленной форм
- •Изучение влияния лигандного окружения на редокс-потенциал
- •Задания для самостоятельной работы
- •Изучение влияния рН на редокс-потенциал.
- •Измерение рН растворов с помощью стеклянного электрода
- •Модуль09. Совмещенные равновесия и конкурирующие процессы разных типов Задания для самостоятельной работы
- •Изучение совмещенных равновесий и конкурирующих процессов разного типа
- •Химия биогенных элементов. Принципы качественного анализа.
- •Качественные и групповые реакции ионов.
- •Модуль 10. Физическая химия поверхностных явлений Задания для самостоятельной работы
- •Построение изотермы поверхностного натяжения и адсорбции на поверхности раздела газ-жидкость.
- •Задания для самостоятельной работы
- •Измерение адсорбции уксусной кислоты на активированном угле
- •Влияние различных факторов на адсорбцию из растворов
- •Хроматография
- •Модуль 11.Физическая химия дисперсных систем. Коллоидно-дисперсные системы. Задания для самостоятельной работы
- •Получение, очистка и свойства коллоидных растворов
- •Определение знака заряда коллоидных частиц.
- •Задания для самостоятельной работы
- •Коагуляция золей электролитами. Пептизация.
- •Задания для самостоятельной работы
- •Набухание вмс. Определение изоэлектрической точки желатина по степени набухания. Коллоидная защита.
Задания для самостоятельной работы
7.39; 7.657.70; 7.72
Дата _______
Лабораторная работа 6.7
Тема: Простые и совмещенные лигандообменные равновесия
Цель: Изучить реакции ионов биометаллов и ионов токсикантов с органическими лигандами, а также совмещенные лигандообменные равновесия.
Задание: Выполнить одну или несколько реакций ионов-биометаллов или ионов-токсикантов со специфическими органическими лигандами. Выполнить опыты по изучению влияния рН среды на устойчивость и строение комплексов. Выполнить опыт по совмещенным лигандообменным равновесиям.
Оборудование и реактивы: Штатив с пробирками, пипетки, фильтровальная бумага.
Растворы, содержащие ионы алюминия, меди(П), кобальта (П), никеля (П), цинка, железа (Ш), кальция
(с=0,2 моль/л); насыщенные водные растворы фторид-иона, тартрат-иона, тиоцианата -иона, ализарина, 0,01% р-р дитизона в четыреххлористом углероде, 0,2% р-р 1-нитрозо2-нафтола в 50% уксусной кислоте, 1% р-р диметилглиоксима в этаноле.Водные р-ры ЭДТА натрия , глицина, салицилата натрия. Эриохром черный Т. Буферные р-ры со значениями рН 1; 2,5; 7,4. Аммиачный буферный р-р с рН=9.
Сущность работы: По изменению цвета, возникающего в ходе взаимодействия судят о:
1) возможности образования хелатных соединений (опыт1); 2) преобладающем направлении лигандообменного процесса в случае совмещения нескольких равновесий (опыт 3); 3) зависимости структуры комплекса от рН среды (опыт 4).
Выполнение эксперимента:
Опыт 1. Изучение образования внутрикомплексных соединении ионов металлов с органическими лигандами
1А. Взаимодействие ионов алюминия с ализарином
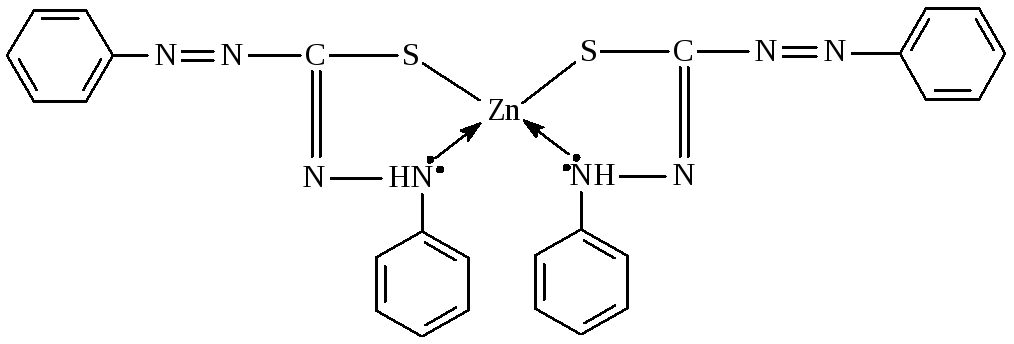
16. Взаимодействие ионов цинка с дитизоном
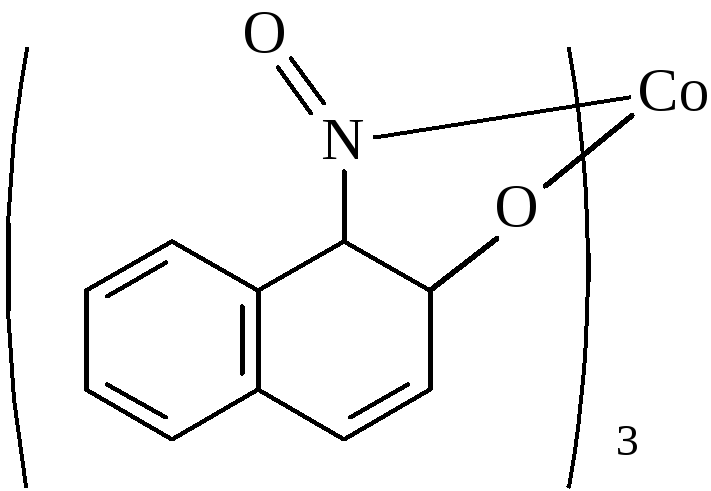
1в. Взаимодействие ионов кобальта с 1-нитрозо -2- нафтолом.
:
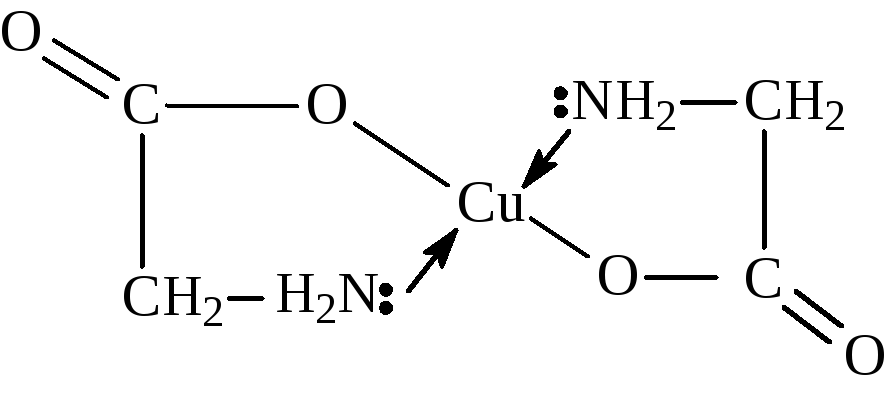
1д.Взаимодействие ионов меди с глицином.
1е. Взаимодействие ионов никеля с диметилглиоксимом.
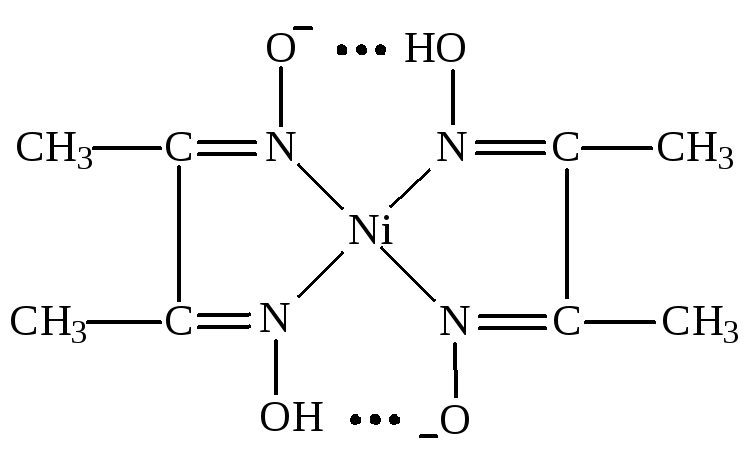
Опыт 3а. Изучение конкурирующих реакций комплексообразования. Конкуренция за ион железа.
|
№ пробирки |
Добавленный реагент |
Цвет соедержимого пробирки |
Формула образовавшегося соединения |
|
1
|
|
|
|
|
2
|
|
|
|
|
3
|
|
|
|
Уравнения реакций:
Опыт 3б. Конкуренция за ион кальция
Схематично взаимодействие иона металла с металлиндикатором и с ЭДТА можно представить следующим образом:
С металлиндикатором Са2+ + Ind ↔ CaInd- + 2H+
С ЭДТА натрия: CaInd- + H2ЭДТА2- ↔ CaЭДТА2- + H2Ind-
Наблюдения:
В выводах к опыту 3 указывают: а) объект конкуренции, б) конкурирующие частицы, в) конкурирующие процессы, г) преобладающий процесс.
Вывод: 3а.
