
- •Российский государственный педагогический университет имени а.И. Герцена
- •Основы химического языка
- •Предисловие
- •Оглавление
- •Химический элемент, химическое соединение
- •1. Лабораторная работа «Основные классы неорганических соединений». Оксиды
- •Гидроксиды
- •Кислоты
- •Металлокомплексные соединения
- •16 Г ch4 занимают объем 22,4 л
- •22,4 Л ch4 содержат 6,02∙1023 молекул
- •1 Моль h2s занимает объем 22,4 л
- •32 Г o2 занимают объем 22,4 л
- •13.1. Определение простейших и молекулярных формул соединений.
- •Индивидуальное домашнее задание № 1
Химический элемент, химическое соединение

Химический элемент – символы и названия.
![]() Химический
элемент
– определенный
вид атомов с одинаковым зарядом атомных
ядер. Символы
химических элементов, а также латинские,
русские и английские их названия
приведены в приложении 1. Корни названий
химических элементов
используются для построения
систематических и традиционных
названий сложных веществ (цинкат, хромат,
хлорат и т.д.). Для названия производных
молибдена и фосфора принято
использовать сокращенные
корни названий
элементов – например: молибдат и
фосфат. Для большинства элементов
корни их русских названий совпадают
с корнями латинских названий.
Для элементов, русское название которых
не совпадает с латинским, в названиях
сложных анионов используют корни
латинских названий элементов:
Химический
элемент
– определенный
вид атомов с одинаковым зарядом атомных
ядер. Символы
химических элементов, а также латинские,
русские и английские их названия
приведены в приложении 1. Корни названий
химических элементов
используются для построения
систематических и традиционных
названий сложных веществ (цинкат, хромат,
хлорат и т.д.). Для названия производных
молибдена и фосфора принято
использовать сокращенные
корни названий
элементов – например: молибдат и
фосфат. Для большинства элементов
корни их русских названий совпадают
с корнями латинских названий.
Для элементов, русское название которых
не совпадает с латинским, в названиях
сложных анионов используют корни
латинских названий элементов:
Таблица 1. Название соединений, образуемых от латинского корня названия
химического элемента.
|
Э |
Латинский корень (название) |
Э |
Латинский корень (название) |
|
Ag |
Арген- (аргентат) |
N |
Нитр-(нитрид, нитрит, нитрат) |
|
As |
Арсен-(арсенид, арсенат) |
Ni |
Николл- (николлат) |
|
Au |
Аур- (аурид, аурат) |
O |
Окс-(оксид), оксиген-оксигенил) |
|
Cu |
Купр- (купрат) |
Pb |
Плюмб- (плюмбат) |
|
C |
Карб- (карбид), Карбон- (карбонат) |
S |
Сульф- (сульфид, сульфат), Тио- (тионат) |
|
Fe |
Ферр- (феррат) |
Sb |
Стиб- (стибид, стибат), Антимон-(антимонид, антимонат) |
|
H |
Гидр- (гидрид), Гидроген- (гидрогенат) |
Si |
Силиц- (силицид, силикат), Сил- (силан) |
|
Hg |
Меркур- (меркурат) |
Sn |
Станн- (станнид, станнат) |
|
Mn |
Манган- (манганат) |
|
|
У![]() пражнения:
пражнения:
Что такое химические структурные элементы вещества? Как они соотносятся с «физическими», «биологическими» и «геологическими» структурными элементами?
Cистему химической символики, которая используется в настоящее время, разработал: Д. Дальтон, М. Ломоносов, Я. Берцелиус, А. Лавуазье?
Приведите примеры названий химических элементов:
а) связанных с запахом и цветом - зловонный, запах, небесно-голубой, зеленоватый, зеленый, зеленый близнец, светло-желтый, темно-красный, розовый, фиолетовый, цвета золота, цвета индиго, радуга, цвет;
б) названных по имени мифологических богов – Ванадис, Ниоба, Прометей, Тантал, Титан, Тор;
в) в честь астрономических объектов – Луна, Солнце, астероид Паллада, планета Уран, планета Нептун, планета Плутон, малая планета Церера; г) по своим специфическим свойствам - безжизненный, несущий свет, неустойчивый, искусственный, разрушающий, тяжелый, неактивный, рождающий кислоты, рождающий воду, рождающий уголь, получаемый с трудом, скрытый, скрывающийся;
д) по географическому месту открытия - Стронтиан (Шотландия), Иттербю (Швеция), Беркли (США), Калифориния (США), Рейн (Германия), Гессен (Германия), Дубна (СССР), Европа, Америка, Скандинавия;
е) в честь государств – Россия, Польша, Франция, Германия;ж) в честь городов – Париж, Стокгольм, Копенгаген;
з) в честь ученых - Ю. Гадолин, П. Кюри и М. Кюри, А. Эйнштейн, Э. Ферми, Д.И. Менделеев, А. Нобель, Э.О. Лоуренс, Э. Резерфорд, Г.Т. Сиборг, Н. Бор, Л. Мейтнер.
Классификация химических элементов.
![]() Классификация
химических элементов основана на
положении элементов в периодической
системе Д.И. Менделеева,
которое определяется характером
электронного строения атомов химических
элементов. Графическим отражением
на плоскости периодической системы
химических элементов являются
различные формы периодических таблиц
– например, короткопериодная таблица
1.2. В соответствии с принципом
периодичности периодическая таблица
состоит из шести полных и седьмого
незавершенного периодов,
содержащих
соответственно – 2, 8, 8, 18, 18,
32 и 23 химических элементов. Первые три
периода называют малыми,
а 4 – 7 – большими
периодами.
Классификация
химических элементов основана на
положении элементов в периодической
системе Д.И. Менделеева,
которое определяется характером
электронного строения атомов химических
элементов. Графическим отражением
на плоскости периодической системы
химических элементов являются
различные формы периодических таблиц
– например, короткопериодная таблица
1.2. В соответствии с принципом
периодичности периодическая таблица
состоит из шести полных и седьмого
незавершенного периодов,
содержащих
соответственно – 2, 8, 8, 18, 18,
32 и 23 химических элементов. Первые три
периода называют малыми,
а 4 – 7 – большими
периодами.
Распределение элементов по периодам приводит к формированию в периодических таблицах вертикальных столбцов, образующих восемь групп. Наличие разного количества элементов в малых и больших периодах приводит к формированию в пределах каждой группы двух подгрупп – главной и побочной, для обозначения которых используют буквы «А» и «В». Главные подгруппы начинаются с элементов 2 периода, а побочные – с элементов 4 (первого большого) периода. Особое место в периодических таблицах занимают IIIB и VIIIB подгруппы. В IIIB подгруппу, наряду со скандием, иттрием, лантаном и актинием, входят два семейства по четырнадцать элементов – лантаноидов и актиноидов. Восьмая группа также содержит «избыточное» количество (12) элементов побочной VIIIB подгруппы – по три элемента из каждого большого периода.
Таблица 2. Короткопериодная таблица периодической системы.
|
Период
|
Ряд
|
Группа
| |||||||||
|
I |
II |
III |
IV |
V |
VI |
VII |
VIII | ||||
|
I |
1 |
H 1s1 |
He 1s2 | ||||||||
|
II |
2 |
Li3 2s1 |
Be4 2s2 |
B5 2s22p1 |
C6 2s22p2 |
N7 2s22p3 |
O8 2s22p4 |
F9 2s22p5 |
Ne10 2s22p6 | ||
|
III |
3 |
Na11 3s1 |
Mg12 3s2 |
Al13 3s23p1 |
Si14 3s23p2 |
P15 3s23p3 |
S16 3s23p4 |
Cl17 3s23p5 |
Ar18 3s23p6 | ||
|
IV |
4 |
K19 4s1 |
Ca20 4s2 |
Sc21 3d14s2 |
Ti22 3d24s2 |
V23 3d34s2 |
Cr24 3d54s1 |
Mn25 3d54s2 |
Fe26 3d64s2 |
Co27 3d74s2 |
Ni28 3d84s2 |
|
5 |
Cu29 4s13d10 |
Zn30 4s23d10 |
Ga31 4s24p1 |
Ge32 4s24p2 |
As33 4s24p3 |
Se34 4s24p4 |
Br35 4s24p5 |
Kr36 4s24p6 | |||
|
V |
6 |
Rb37 5s1 |
Sr38 5s2 |
Y39 4d15s2 |
Zr40 4d25s2 |
Nb41 4d35s2 |
Mo42 4d55s1 |
Tc43 4d55s2 |
Ru44 4d75s1 |
Rh45 4d85s1 |
Pd46 4d105s0 |
|
7 |
Ag47 4d105s1 |
Cd48 4d305s2 |
In49 5s25p1 |
Sn50 5s25p2 |
Sb51 5s25p3 |
Te52 5s25p4 |
I53 5s25p5 |
Xe54 5s25p6 | |||
|
VI |
8 |
Cs55 6s1 |
Ba56 6s2 |
La*57 5d16s2 |
Hf72 5d26s2 |
Ta73 5d36s2 |
W74 5d46s2 |
Re75 5d56s2 |
Os76 5d66s2 |
Ir77 5d76s2 |
Pt78 5d96s2 |
|
9 |
Au79 5d106s1 |
Hg80 5d106s2 |
Tl81 6s26p1 |
Ge82 6s26p2 |
Bi83 6s26p3 |
Po84 6s26p4 |
At85 6s26p5 |
Rn86 6s26p6 | |||
|
VII |
10 |
Fr87 7s1 |
Ra88 7s2 |
Ac**89 6d17s2 |
Rf104 6d27s2 |
Db105 6d37s2 |
Sg106 6d47s2 |
Bh107 6d57s2 |
Hs108 6d67s2 |
Mt109 6d87s2 |
[ ] 110 |
|
11 |
[ ] 111 |
[ ] 112 |
|
|
|
|
|
| |||
*Лантаноиды
|
Ce58 4f2 6s2 |
Pr59 4f3 6s2 |
Nd60 4f4 6s2 |
Pm61 4f5 6s2 |
Sm62 4f6 6s2 |
Eu63 4f7 6s2 |
Gd64 4f7 5d1 6s2 |
Tb65 4f9 6s2 |
Dy66 4f10 6s2 |
Ho67 4f11 6s2 |
Er68 4f12 6s2 |
Tm69 4f13 6s2 |
Yb70 4f14 6s2 |
Lu71 4f14 5d1 6s2 |
**Актиноиды
|
Th90 6d2 7s2 |
Pa91 5f2 6d1 7s2 |
U92 5f3 6d1 7s2 |
Np93 4f4 6d1 7s2 |
Pu94 5f6 7s2 |
Am95 5f7 7s2 |
Cm96 5f7 6d1 7s2 |
Bk97 5f8 6d1 7s2 |
Cf98 5f10 7s2 |
Es99 5f11 7s2 |
Fm100 5f12 7s2 |
Md101 5f13 7s2 |
No102 5f14 7s2 |
Lr103 5f14 6d1 7s2 |
Элементы главных подгрупп образуют семейство непереходных, а элементы побочных подгрупп – семейство переходных элементов. В зависимости от природы внешних электронов (табл. 1.2.) непереходные элементы IA и IIA подгрупп называют s-элементами, а элементы IIIA-VIIIA подгрупп – р-элементами. Переходные элементы также подразделяются на два подсемейства: актиноиды и лантаноиды назвают f-элементами, а остальные элементы побочных подгрупп – d-элементами. Поскольку в виде простых веществ все переходные элементы являются типичными металлами, то семейство переходных элементов и подсемейства d- и f-элементов часто называют – переходные металлы, d-металлы и f-металлы.
В каждой главной подгруппе элементы второго и третьего периода относятся к типическим непереходным элементам, а элементы 4-7 периодов образуют подсемейство непереходных элементов, называемые по имени элемента четвертого периода. Например, кислород и сера являются типическими элементами VIA подгруппы, а селен, теллур и полоний образуют подсемейство селена. Непереходные элементы IA, IIA, VIA, VIIA и VIIIA подгрупп имеют специальные названия – щелочные металлы, щелочноземельные металлы, халькогены (рождающие руды), галогены (рождающие соли) и благородные газы соответственно.
Совокупность переходных d-элементов каждой из IB-VIIB подгруппы называют по имени d-элемента четвертого периода: IB – подгруппа меди (Cu, Ag, Au), IIB – подгруппа цинка (Zn, Cd, Hg), IIIB - подгруппа скандия (Sc, Y, La, Ac), IVB –подгруппа титана (Ti, Zr, Hf, Rf), VB - подгруппа ванадия (V, Nb, Ta, Db), VIB – подгруппа хрома (Cr, Mo, W, Sg), VIIB – подгруппа марганца (Mn, Tc, Re, Bh). Переходные d-элементы VIIIB подгруппы образуют два подсемейства: железа (Fe, Co, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Пример. Классифицируйте следующие химические элементы: Ba, Si, Te, Mo, Rh, Tb, Np.
Решение. Ba – непереходный s-элемент второй группы и шестого периода, подгруппа щелочноземельных металлов, подсемейство кальция;
Si – непереходный р-элемент четвертой группы и третьего периода, типический элемент IVA подгруппы;
Te – непереходный р-элемент шестой группы и пятого периода, подгруппа халькогенов, подсемейство селена;
Mo – переходный d-элемент шестой группы и пятого периода, подгруппа хрома;
Rh – переходный d-элемент восьмой группы и пятого периода, семейство платиновых металлов;
Tb – переходный f-элемент третьей группы и шестого периода, семейство лантаноидов;
Np – переходный f-элемент третьей группы и седьмого периода, семейство актиноидов.
У![]() пражнения:
пражнения:
Какие химические элементы VII группы относятся: к переходным и непереходным элементам и как называются подгруппы непереходных и переходных элементов? Как называют совокупность следующих элементов VIIА подгруппы: фтор, хлор, бром, иод, астат.
Классифицируйте следующие химические элементы: Rb, Y, Ta, Be, Sg, In, Ni, C, Pd, As, Sm, O, Am, I, Ne.
Классификация химических соединений по составу.
![]() Химическое
соединение
– совокупность
химических структурных элементов
(атомов или ионов), объединенных химическим
взаимодействием, называемым
химической связью. Химическая
связь –
взаимодействие между химическими
структурными элементами вещества,
сопровождающееся изменением в их
электронном строении в результате
обобществления электронов и
приводящее к понижению энергии системы.
Химическое
соединение
– совокупность
химических структурных элементов
(атомов или ионов), объединенных химическим
взаимодействием, называемым
химической связью. Химическая
связь –
взаимодействие между химическими
структурными элементами вещества,
сопровождающееся изменением в их
электронном строении в результате
обобществления электронов и
приводящее к понижению энергии системы.
В зависимости от состава химические соединения подразделяют на простые и сложные.











Схема 1. Простые и сложные химические соединения.
Аллотропия – это способность химических элементов образовывать несколько разных простых веществ, отличающихся по своим свойствам. Явление аллотропии может быть обусловлено либо различным составом молекул простого вещества данного элемента (аллотропия состава), либо способом размещения молекул или атомов в кристаллической решетке (аллотропия формы). Например, селен в виде твердого при нормальных условиях простого вещества существует в виде: красного селена, в узлах кристаллической которого находятся циклические молекулы Se, серого селена - кристаллы образованы зигзагообразными цепями Se, и красно-коричневой стекловидной модификации, образованной неупорядоченно расположенными молекулами Se разной длины. Красный и серый селен являются примерами аллотропных модификаций состава, а красный и красно-коричневый селен – примерами аллотропных модификаций формы. Аллотропия – частный случай явления полиморфизма. Способность элемента к образованию аллотропных модификаций связана с электронным строением атома.
Химические соединения, содержащие атомы или ионы двух химических элементов называются бинарными (CS2, NaCl, SiCl4), а более двух химических элементов - многоэлементными (Na2SO4, SeO2F2, K3[Fe(CN)6]).
У![]() пражнения:
пражнения:
Какие химические соединения называются простыми, сложными?
Привести примеры аллотропных модификаций состава и формы для кислорода и серы как простых веществ.
Что такое бинарные химические соединения? Приведите примеры бинарных химических соединений щелочноземельных металлов с галогенами, халькогенами, азотом, фосфором, водородом.
Какие из следующих соединений серы относятся к простым, сложным бинарным и сложным многоэлементным соединениям: (SO3)3, S8, SO2Cl2, FeS2, Na2SO4?
Принципы химической номенклатуры – химические формулы (простейшая, молекулярная, графическая) и химические названия соединений (систематическое, традиционное, специальное, тривиальное).
![]() Химическая
номенклатура
- это язык химии, который включает в себя
формулы
химических
соединений, отображающих состав веществ
с помощью символов химических
элементов, числовых индексов и других
знаков, и названия
соединений – изображение состава
веществ с помощью слова или группы
слов. Переход от химических формул
к названиям и наоборот определяется
системой номенклатурных
правил. Современная
номенклатура разработана Международным
союзом теоретической и прикладной химии
(ИЮПАК, IUPAC).
В основу номенклатуры положен состав
химических
соединений.
Химическая
номенклатура
- это язык химии, который включает в себя
формулы
химических
соединений, отображающих состав веществ
с помощью символов химических
элементов, числовых индексов и других
знаков, и названия
соединений – изображение состава
веществ с помощью слова или группы
слов. Переход от химических формул
к названиям и наоборот определяется
системой номенклатурных
правил. Современная
номенклатура разработана Международным
союзом теоретической и прикладной химии
(ИЮПАК, IUPAC).
В основу номенклатуры положен состав
химических
соединений.
По номенклатурным правилам каждое вещество в соответствии с его формулой получает систематическое название, полностью отражающее его состав (N2 – диазот, Hg2Cl2 – дихлорид диртути). Для ограниченного числа распространенных кислот и их солей правила ИЮПАК рекомендуют использование традиционных названий (H2SO4 – серная кислота, Na2SO4 – сульфат натрия), хотя они не дают точного представления о составе и требуют запоминания. По правилам ИЮПАК допускается использование небольшого числа специальных исторически сложившихся названий – например, вода H2O, аммиак NH3, аммоний NH4+, гидразин N2H4. В технической литературе иногда применяют тривиальные названия: соляная кислота HCl, сода Na2CO3, медный купорос CuSO45H2O, нашатырь NH4Cl.
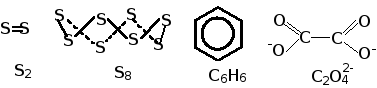
В химической практике в основном используется три типа формул химических соединений – простейшая (эмпирическая), молекулярная и графическая (структурно-графическая). Простейшая формула отражает минимальное соотношение между атомами химических элементов в соединении: S для всех аллотропных модификаций серы как простого вещества, CH для бензола и т.д. Молекулярная формула отображает истинный состав молекул или сложных ионов: S2, S8, S, C6H6, C2O42-. Графическая формула, наряду с истинным составом, отображает расположение атомов химических элементов в соединении и кратность химических связей между ними. Каждая двухцентровая двухэлектронная химическая связь между атомами изображается отдельной «черточкой», а делокализованные между несколькими атома связи – кривой, охватывающей эти атомы:
Для отображения состава и структуры соединений в молекулярных формулах соединений, наряду с символами химических элементов, используются: числовые индексы; круглые, фигурные и квадратные скобки; математические символы «» или «»; буквы греческого алфавита; буквенные обозначения типа кристаллической решетки (куб. – кубическая, тетр. – тетрагональная, монокл. – моноклинная, гекс. – гексагональная, триг. – тригональная, трикл. – триклинная): NH4, NH4+, (NH4)2SO4, [Co(NH3)6]Cl3, Na2SO45H2O, Na2SO45H2O, -Pb, S(ромб).
У![]() пражнения:
пражнения:
В одинаковой ли мере обоснована запись графических формул для соединений с молекулярной и ионной структурой?
Приведите простейшие, молекулярные и графические формулы следующих химических соединений: аммиак, пероксид водорода, азот, белый фосфор, озон, гелий.
Приведите по три примера формул химических соединений использующих, наряду с символами химических элементов, другие обозначения: числовые индексы, круглые и квадратные скобки, математический символ «» или «», буквы греческого алфавита.
Систематические и традиционные названия простых веществ.
С![]() истематические
названия простых веществ
образуются из названия химического
элемента с указанием с помощью
числовых приставок (2 - ди, 3 – три, 4 –
тетра, 5 – пента, 6 – гекса, 7 – гепта,
8 – окта, 9 – нона, 10 – дека, 11 – ундека,
12 – додека) числа атомов в молекуле:
H2
диводород, О3
трикислород, Р4
тетрафосфор, S8
октасера, B12
додекабор. Неопределенное
число атомов обозначается приставкой
«поли-» - Sn
полисера, Pn
полифосфор. Для обозначения твердых
аллотропных модификаций простых
веществ допускается использование
греческих букв и
т.д., начиная с наиболее низкотемпературной
модификации: -Sn
– альфа-олово, -Sn
– бета олово, -Sn
– гамма-олово. Вместо греческих букв
для твердых аллотропных модификаций
может быть использовано буквенное
обозначение типа кристаллической
решетки: -Sn,
или Sn(гекс.)
– бета-олово, или олово гексагональное.
Аморфное состояние твердых простых
веществ указывают буквенным обозначением
«ам.»: C(ам.).
истематические
названия простых веществ
образуются из названия химического
элемента с указанием с помощью
числовых приставок (2 - ди, 3 – три, 4 –
тетра, 5 – пента, 6 – гекса, 7 – гепта,
8 – окта, 9 – нона, 10 – дека, 11 – ундека,
12 – додека) числа атомов в молекуле:
H2
диводород, О3
трикислород, Р4
тетрафосфор, S8
октасера, B12
додекабор. Неопределенное
число атомов обозначается приставкой
«поли-» - Sn
полисера, Pn
полифосфор. Для обозначения твердых
аллотропных модификаций простых
веществ допускается использование
греческих букв и
т.д., начиная с наиболее низкотемпературной
модификации: -Sn
– альфа-олово, -Sn
– бета олово, -Sn
– гамма-олово. Вместо греческих букв
для твердых аллотропных модификаций
может быть использовано буквенное
обозначение типа кристаллической
решетки: -Sn,
или Sn(гекс.)
– бета-олово, или олово гексагональное.
Аморфное состояние твердых простых
веществ указывают буквенным обозначением
«ам.»: C(ам.).
Для ограниченного круга простых веществ допускается использование традиционных названий: Н2, Hal2, О2, N2 - молекулярный водород, галоген (фтор, хлор и т.д.), кислород, азот; О3 озон; S8 кристаллическая сера; P4 белый фосфор и др.
У![]() пражнения:
пражнения:
Приведите систематическое и традиционное название простых веществ: Ne, Cl2, O2, S2, S8, Sn, N2, P4, Pn, B12.
На примере серы продемонстрируйте указание в названии и формуле простых веществ существование их в различных аллотропных модификациях формы.
Степень окисления элементов в химических соединениях.
С остояние
каждого элемента в химическом соединении
принято характеризовать егостепенью
окисления
– формальным зарядом атома
химического элемента в соединении,
вычисленного исходя из предположения
об ионном строении соединения.
Будучи формальной величиной,
не соответствующей ни одной реальной
характеристике атома элемента в
соединении, исторически сложившееся
понятие о степени окисления широко
используется в химической
номенклатуре.
остояние
каждого элемента в химическом соединении
принято характеризовать егостепенью
окисления
– формальным зарядом атома
химического элемента в соединении,
вычисленного исходя из предположения
об ионном строении соединения.
Будучи формальной величиной,
не соответствующей ни одной реальной
характеристике атома элемента в
соединении, исторически сложившееся
понятие о степени окисления широко
используется в химической
номенклатуре.
В формулах химических соединений степень окисления элементов может быть указана в виде верхнего правого индекса символа химического элемента арабскими цифрами со знаком «+» или «-» перед цифрой: Na+2S+6O-24. Для отличия от степени окисления элемента заряд реально существующих простых и сложных ионов указывается справа от его величины: K+, Mg2+, Cl-, SO42-. В названиях химических соединений степень окисления элемента (если это необходимо) указывается римскими цифрами в круглых скобках: FeBr2 – бромид железа (II).
Для определения степени окисления элемента в химическом соединении используют ряд правил:
степень окисления элемента в простых веществах равна нулю;
алгебраическая сумма степеней окисления элементов в составе химического соединения равна заряду соединения – нулю в нейтральных соединениях (Na+2S+6O-24 – [2(+1) + (+6) + 4(-2) = 0]) и величине заряда сложного иона ([S+6O-24]2- - [(+6) + 4(-2) = -2]);
степень окисления фтора во всех соединениях (-1);
за исключением солеобразных гидридов активных металлов (NaH, CaH2 и др.), в которых степень окисления водорода равна –1, степень окисления водорода в соединениях равна +1;
степень окисления кислорода в большинстве соединений –2. Исключение составляют: соединения со связью -О-О- - пероксиды (Na+2O-2, Ca+2O-2), надпероксиды (Cs+O-1/22) и озониды (K+O-1/33), соединения с фтором (O+2F-2);
степень окисления элементов главных подгрупп I, II и III (за исключением таллия Tl) группы периодической системы постоянна и равна номеру группы: +1, +2, +3 соответственно; таллий, наряду со степенью окисления +3, образует также соединения со степенью окисления +1: Tl+3F-3 и Tl+F-;
переменные степени окисления элементов главных подгрупп IV, V, VI и VII группы хорошо согласуются с «менделеевским правилом (N-2) или четности, нечетности» – для элементов четных групп наиболее характерны соединения с четными степенями окисления, а для элементов нечетных групп – соединения с нечетными степенями окисления; таким образом, для элементов главных подгрупп IV, V, VI и VII наиболее характерные степени окисления являются: высшая положительная, совпадающая с номером группы N (за исключением фтора и кислорода), промежуточные – (N-2), (N-4), (N-6) и низшая отрицательная степень окисления, равная (N-8);
степень окисления элементов побочных подгрупп III и II (за исключением ртути) группы постоянна и равна номеру группы N - +3 и +2 соответственно; ртуть, наряду со степенью окисления +2 , образует соединения, содержащие катион Hg22+ с формальной степенью окисления +1;
элементы побочных подгрупп I (за исключением серебра с постоянной степенью окисления +1) , IV, V, VI и VII групп характеризуются переменными положительными степенями окисления, не согласующимися с «менделеевским правилом»; для элементов IV, V, VI и VII группы высшая степень окисления совпадает с номером группы N; наиболее часто встречающиеся на практике соединения элементов побочных подгрупп характеризуются следующими степенями окисления: Cu (+1, +2), Au (+1,+3), Ti (+2, +4), V (+2, +3, +4, +5), Cr (+2, +3, +6), Mn (+2, +4, +6, +7), Fe (+2, +3), Co (+2, +3), Ni (+2).
У![]() пражнения:
пражнения:
15. Какие элементы периодической системы имеют постоянные степени окисления в соединениях?
16. В чем заключается менделеевское правило «четности» или «N-2»? Какие степени окисления наиболее характерны для р-элементов IV-VII групп?
17. Чему равна высшая степень окисления элементов побочных подгрупп II-VII группы?
18. Приведите наиболее характерные степени окисления следующих элементов: Fe, Co, Ni, Cr, Mn, Cu, Ag, Au, Zn, Cd, Hg.
19. Какие степени окисления имеют элементы в следующих соединениях: O3, OsO4, N2O, NiO, Na2O2, OF2, PbO2, Pb3O4, Na2S2O7, Na2S2O8, LiH2PO4, K3PO4, (NH4)2Cr2O7, KPHO3, BaH2, Al(OH)2Cl, Hg2(NO3)2, HIO4, Ba(H3IO6), Ca(IO3)2, Mg(IO2)2, Ca(IO)2, CaCl(ClO).
Систематические и специальные названия одноэлементных ионов.
С истематические
названия одноэлементных катионов Эz+
образуются из слова «катион»
и русского названия элемента в родительном
падеже с указанием (для
элементов с переменной степенью
окисления) римскими цифрами в
круглых скобках его заряда: Fe2+
катион железа (II)
(читается: катион железа-два), Fe3+
катион железа (III),
Са2+
катион кальция.
истематические
названия одноэлементных катионов Эz+
образуются из слова «катион»
и русского названия элемента в родительном
падеже с указанием (для
элементов с переменной степенью
окисления) римскими цифрами в
круглых скобках его заряда: Fe2+
катион железа (II)
(читается: катион железа-два), Fe3+
катион железа (III),
Са2+
катион кальция.
Для многоатомных катионов с помощью числовых приставок указывают число атомов в составе катиона, а его заряд указывают в круглых скобках арабскими цифрами со знаком «+»: Hg22+ катион диртути (2+) (читается: катион диртути-два-плюс). Для катиона О2+, наряду с систематическим названием – катион дикислорода (+1), допускается использование специального названия – катион диоксигенила.
Систематическое название одноэлементных анионов составляются из корня русского, или латинского (табл.) названия элемента и окончания –ид с добавлением через дефис слова «ион»: Н- гидрид-ион, Cl- хлорид-ион, О2- оксид-ион, N3- нитрид-ион. В тексте допускается называть анионы с помощью прилагательных: Cl- - хлоридный ион.
Для многоатомных анионов с помощью числовых приставок указывают число атомов элемента и в круглых скобках арабскими цифрами со знаком «-« общий заряд иона: S22- дисульфид(2-)-ион (читается: дисульфид-два-минус-ион), I3- трииодид(1-)-ион. Для распространенных многоэлементных анионов допускается использование специальных названий: C22- ацетиленид-, N3- азид-, О3- озонид-, О2- надпероксид-, О22- пероксид-ион.
У![]() пражнения:
пражнения:
20. Приведите систематические названия ионов: Cr3+, Ca2+, Hg2+, S82+, H-, Cl-, O2-N3-, I3-, S22-.
21. Приведите систематические и специальные названия ионов: C22-, N3-, O3-, O22-, O2-.
Систематические и специальные названия бинарных соединений.
В соответствии с русским литературным
языком название любого сложного
вещества согласно его формуле
читаетсясправа
налево1:
вначале
называется электроотрицательная
составляющая (условный анион)
формулы в именительном падеже, а
затем – электроположительная
составляющая (условный катион) в
родительном падеже.
соответствии с русским литературным
языком название любого сложного
вещества согласно его формуле
читаетсясправа
налево1:
вначале
называется электроотрицательная
составляющая (условный анион)
формулы в именительном падеже, а
затем – электроположительная
составляющая (условный катион) в
родительном падеже.
Систематические названия бинарных соединений образуются из латинского корня названия наиболее электроотрицательного элемента с суффиксом –ид и русского названия менее электроотрицательного элемента в родительном падеже. Одним из способов образования названий бинарных соединений является способ с применением латинских числовых приставок:
AsCl3 - трихлорид мышьяка, Sb2S5 - пентасульфид дисурьмы,
Na3N - нитрид тринатрия, Tl2O - оксид диталлия,
Hg2Cl2 - дихлорид диртути, Na2S2 - дисульфид динатрия.
Вторым, допускаемым правилами ИЮПАК, способом образования систематического названия сложных соединений является метод Штока. Если менее электроотрицательный элемент может находиться в различных степенях окисления, то степень окисления указывается в скобках римскими цифрами; при этом предполагается, что заряд аниона очевиден:
AsCl3 - хлорид мышьяка (III), Sb2S5 - сульфид сурьмы (V),
Na3N - нитрид натрия, Tl2O - оксид таллия (I),
Hg2Cl2 - хлорид ртути (I), Na2S2 - дисульфид натрия.
Следует отметить, что, несмотря на лаконичность, метод Штока не является универсальным. Его использование практически невозможно для соединений с кратными стехиометрическими соотношениями между составляющими (2:2, 2:4 и т.д.), поскольку в этом случае метод Штока не дает адекватного соответствия между молекулярной формулой соединения и его названием. Например, название хлорид ртути (I) отвечает простейшей формуле HgCl, а не молекулярной – Hg2Cl2.
В обоих методах многоатомные анионы, имеющие специальные названия, сохраняют их в систематических названиях соединений: CaC2 - ацетилинид кальция, PbN3 - азид свинца (II), RbO3 - озонид рубидия, MgO2 - пероксид магния, KO2 - надпероксид калия.
Исключением из правил, используемых для образования систематических названий бинарных соединений, являются водородные соединения р-элементов IV-VII группы, а также бора. Водородные соединения галогенов и халькогенов, проявляюшие свойства кислот, называют по правилам для бескислородных кислот: название образуется из русского названия элемента с добавлением соединительной гласной –о- и окончания «водород»: HCl хлороводород, H2S сероводород (для H2O используется специальной название «вода»). Для большинства водородных соединений р-элементов V и IV группы, а также бора применяют специальные названия с суффиксами –ан и –ин: SiH4 - силан, Si2H6 - дисилан, Si3H8 - трисилан, GeH4 - герман, SnH4 - станнан, PbH4 - плюмбан, PH3 - фосфин, P2H6 - дифосфин, AsH3 - арсин, SbH3 - стибин, BiH3 - висмутин, B2H6 - диборан, B4H10 - тетраборан. Водородные соединения азота имеют исторически сложившиеся специальные названия: NH3 - аммиак, N2H4 - гидразин, HN3 - азидоводород. Водородные соединения углерода называют по специальным правилам для органических соединений.
У![]() пражнения:
пражнения:
22. Приведите систематические названия соединений: CaH2, Al2O3, Fe2O3, Na2S, SF6, SeO2, K3N, Mg3P2, FeSe2, Al2Cl6, SiC, Si3N4, S2I2, OF2.
23. Приведите систематические и специальные названия соединений: NaN3, CaC2, K2O2, CsO2, RbO3.
24. Приведите специальные названия соединений: HF, PH3, N2H4, HI, HN3, H2Se, SiH4, H2Te, As2H4, B2H6.
Функциональная классификация сложных неорганических соединений
Традиционно по химическим свойствам среди основных классов неорганических соединений выделяют оксиды, гидроксиды, бескислородные кислоты, соли и галогенангидриды (см. схему 2):
У![]() пражнения:
пражнения:
25. Приведите примеры химических соединений, относящихся к различным функциональным классам сложных неорганических соединений: несолеобразующий оксид, основной оксид, амфотерный оксид, кислотный оксид, основной гидроксид (основание), амфотерный гидроксид, кислотный гидроксид (оксокислота), галогенангидрид, бескислородная кислота, средняя соль, основная соль, кислая соль, двойная соль, смешанная соль.
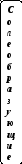






































Схема 2. Основные классы сложных неорганических соединений.
Оксиды.
О ксидами
называются
бинарные соединения элементов
с кислородом
в степени окисления –2.
Характерной особенностью строения
оксидов является наличие в них
только одного типа химической связи:
элемент-кислород. В соответствии
с формальными степенями окисления
элемента (Эя+,
z
= 1-8) и кислорода О2-
возможно образование оксидов с
простейшими формулами: Э2О,
ЭО, Э2О3,
ЭО2,
Э2О5.
ЭО3,
Э2О7,
ЭО4.
Истинные молекулярные формулы
оксидов соответствуют целому
числу структурных
единиц, определяемых простейшей
формулой. Например, молекулярная
формула оксида фосфора (V)
P4O10
соответствует его удвоенной простейшей
формуле P2O5.
В графических формулах оксидов
число химических связей, образуемых
каждым атомом химического элемента,
принимается равным его формальной
степени окисления. Каждый атом
кислорода может образовывать две
химические связи
либо непосредственно с одним
атомом элемента, либо, выступая в
качестве «мостикового
атома», по одной связи с двумя атомами
элемента. Важно отметить, что в оксиды
характеризуются наличием
не более одного мостикового атома
кислорода между двумя атомами
химических элементов.
Это показывает, что бинарные
соединения с кислородом, характеризующиеся
наличием двух и более мостиковых
атомов кислорода, к оксидам не
относятся. Например, как видно из
графических формул:
ксидами
называются
бинарные соединения элементов
с кислородом
в степени окисления –2.
Характерной особенностью строения
оксидов является наличие в них
только одного типа химической связи:
элемент-кислород. В соответствии
с формальными степенями окисления
элемента (Эя+,
z
= 1-8) и кислорода О2-
возможно образование оксидов с
простейшими формулами: Э2О,
ЭО, Э2О3,
ЭО2,
Э2О5.
ЭО3,
Э2О7,
ЭО4.
Истинные молекулярные формулы
оксидов соответствуют целому
числу структурных
единиц, определяемых простейшей
формулой. Например, молекулярная
формула оксида фосфора (V)
P4O10
соответствует его удвоенной простейшей
формуле P2O5.
В графических формулах оксидов
число химических связей, образуемых
каждым атомом химического элемента,
принимается равным его формальной
степени окисления. Каждый атом
кислорода может образовывать две
химические связи
либо непосредственно с одним
атомом элемента, либо, выступая в
качестве «мостикового
атома», по одной связи с двумя атомами
элемента. Важно отметить, что в оксиды
характеризуются наличием
не более одного мостикового атома
кислорода между двумя атомами
химических элементов.
Это показывает, что бинарные
соединения с кислородом, характеризующиеся
наличием двух и более мостиковых
атомов кислорода, к оксидам не
относятся. Например, как видно из
графических формул:
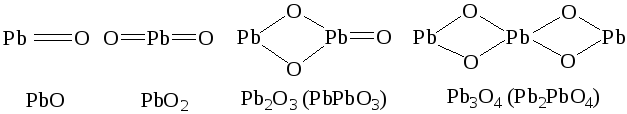
Pb2O3 (PbOPbO2), Pb3O4 (2PbOPbO2), называемые ранее смешанными оксидами, следует рассматривать как свинцовые соли метасвинцовой (H2PbO3) и ортосвинцовой (H4PbO4) кислот.
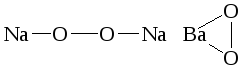 Характерной
особенностью строения пероксидов
является наличие в их структурах
кислородной группировки из O22-
с непосредственной химической связью
между двумя атомами кислорода {-O-O-}
– например, Na2O2,
BaO2.
В связи с этим, несмотря на формальное
подобие молекулярных
формул ЭО2,
BaO2
относится к пероксидам, а PbO2
– к оксидам.
Характерной
особенностью строения пероксидов
является наличие в их структурах
кислородной группировки из O22-
с непосредственной химической связью
между двумя атомами кислорода {-O-O-}
– например, Na2O2,
BaO2.
В связи с этим, несмотря на формальное
подобие молекулярных
формул ЭО2,
BaO2
относится к пероксидам, а PbO2
– к оксидам.
Систематические названия оксидов и пероксидов образуются в соответствии с общими правилами для названий бинарных соединений. Названия складываются из слова оксид (пероксид) и русского названия элемента в родительном падеже с указанием (для элементов с переменной степенью окисления) римскими цифрами в круглых скобках степени окисления элемента:
Na2O - оксид натрия, Fe2O3 - оксид железа (III),
H2O2 - пероксид водорода, BaO2 – пероксид бария.
Либо в названиях оксидов используются латинские числовые приставки:
Na2O - оксид динатрия, Fe2O3 - триоксид дижелеза.
Некоторые оксиды и пероксиды имеют тривиальные названия (приложение 2.), используемые в основном в технической литературе.
В зависимости от способности оксидов к образованию солей при взаимодействию с кислотами, кислотными оксидами, или основаниями и основными оксидами, они подразделяются на солеобразующие и несолеобразующие (CO, NO, N2O) оксиды. Солеобразующие оксиды подразделяются на основные, амфотерные и кислотные:













:





Схема 3. Классификация солеобразующих оксидов.
Основные оксиды с преимущественно ионным характером химической связи Э-О образуют прочные ионные кристаллические решетки с высокими температурами кипения и плавления. В результате этого при нормальных условиях они существуют в виде твердых кристаллических веществ. Такие оксиды образуют наименее электроотрицательные элементы периодической системы с относительно низкой степенью окисления – например, катионы щелочных и щелочноземельных металлов, ряд переходных металлов в низких степенях окисления.
Для кислотных оксидов с преимущественно ковалентным характером связи Э-О характерны менее прочные молекулярные кристаллические решетки с относительно низкими температурами кипения и плавления. Как следствие этого, типичные кислотные оксиды при нормальных условиях являются газами – CO2, SO2, летучими жидкостями, или лекгоплавкими твердыми веществами – (SO3)3 (tкип. = 44,8 оС, tпл. = 16,8 оС). Кислотные оксиды образуют электроотрицательные химические элементы (неметаллы или переходные металлы с высокой степенью окисления).
Амфотерные оксиды характеризуются ионно-ковалентным характером химической связи Э-О и в основном образуют полимерные структуры. При нормальных условиях это твердые вещества. Образованию амфотерных оксидов способствует как промежуточное значение относительной электроотрицательности химического элемента, так и средние значения его степени окисления. Например, увеличение степени окисления хрома: Сr2+Cr3+Cr6+ приводит к ослаблению степени ионности и усилению ковалентности связи Cr-O в оксидах и, как следствие этого, к закономерному переходу от основного оксида CrO к амфотерному Cr2O3 и кислотному оксиду CrO3
В соответствии с характером химической связи основные и кислотные оксиды взаимодействуют с водой с образованием соответствующих основных и кислотных гидроксидов – оснований и кислородсодержащих кислот (оксокислот):
BaO + H2O = Ba(OH)2
SO3 + H2О = Н2SO4 {SO2(OH)2)}
Взаимодействие основных оксидов с кислотами, а кислотных оксидов с основаниями сопровождается образованием соли и воды:
BaO + 2HCl = BaCl2 + H2O
SO3 + 2NaOH = Na2SO4 + H2O
Различный характер химической связи Э-О в кислотных и основных оксидах определяет эффективное взаимодействие их между собой с образование оксосолей: BaO + SO3 = BaSO4
Кислотно-основные свойства амфотерных оксидов выражены значительно слабее. С водой большинство амфотерных оксидов практически не взаимодействуют. Их кислотно-основная двойственность проявляется при взаимодействии с сильными основаниями и кислотами, а также с типично основными и кислотными оксидами:
ZnO + 2HCl = ZnCl2 + 2H2O
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
ZnO + 2NaOH (сплав) = Na2ZnO2 + H2O
ZnO + SO3 = ZnSO4
ZnO + Na2O (сплав) = Na2ZnO2
Следует отметить, что образование оксосолей на основе амфотерных оксидов происходит только в расплавах. В водных растворах продуктами их взаимодействия с основаниями являются соли, содержащие в качестве аниона гидроксокомплексы.
У![]() пражнения:
пражнения:
26. Приведите систематические названия оксидов, распределите оксиды по классам: K2O, BeO, Al2O3, OsO4, CO, CO2, ZnO, N2O, NiO, N2O5, Cr2O3, CrO3, Mn2O7. Какие из данных оксидов будут вступать в реакцию: а) с соляной кислотой, б) с гидроксидом натрия, в) и с соляной кислотой, и с гидроксидом натрия; записать уравнения химических реакций.
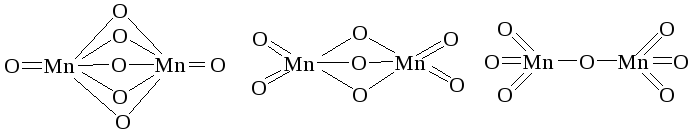
27. Указать, какая из приведенных графических формул отвечает оксиду Mn (VII) и почему:
28. Приведите молекулярные и графические формулы оксидов: магния, алюминия, азота (IV), азота (I), фосфора (V), серы (VI), хлора (VII), марганца (VII), хрома (III). Приведите реакции гидратации (взаимодействия с водой) этих оксидов.
29. Напишите реакции, демонстрирующие кислотный характер следующих оксидов: CrO3, TeO3, Сl2O3, NO2, SeO2.
30. Приведите графические формулы, отражающие молекулярный состав оксидов фосфора(III) P4O6 и фосфора(V) P4O10.
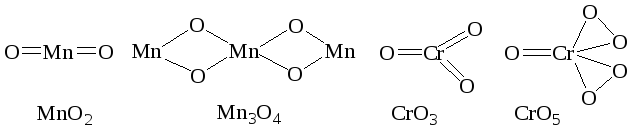
31. На основании структурных формул объясните, какие из приведенных бинарных кислородных соединений относятся к оксидам:
32. Приведите реакции, демонстрирующих кислотно-основные свойства оксидов: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7, CrO, Cr2O3, CrO3.
Гидроксиды – основные (основания), амфотерные, кислотные (оксокислоты).
![]()
Гидроксидами называются сложные вещества, содержащие группировку OH-, которая связана через атом кислорода одинарной химической связью с различными химическими элементами. Подобно оксидам, в зависимости от характера химической связи Э-ОН, гидроксиды подразделяются на основные (основания) (NaOH, Tl(OH), Cu(OH), Mg(OH)2, Ba(OH)2, Cr(OH)2) с преимущественно ионной связью, амфотерные (I(OH), Be(OH)2, B(OH)3), Zn(OH)2, Fe(OH)3, Al(OH)3) с ионно-ковалентным типом связи и кислотные (кислородсодержащие или оксокислоты) (NO2(OH)HNO3, PO(OH)3H3PO4, SO2(OH)2H2SO4, Te(OH)6H6TeO6), ClO3(OH)HClO4, MnO2(OH)2H2MnO4, MnO3(OH)HMnO4) с преимущественно ковалентной связью.
В соответствии с преимущественно ионным характером химической связи Э-ОН основные гидроксиды (основания) при растворении в воде диссоциируют с образованием гидроксид-ионов и катионов, причем, в зависимости от эффективности (степени) диссоциации различают сильные основания (NaOH, Ba(OH)2), диссоциирующие практически нацело, основания средней силы (Tl(OH), Mg(OH)2, Cr(OH)2) и слабые основания (Сu(OH), Fe(OH)2), диссоциация которых протекает частично:
NaOH Na+ + OH-, Fe(OH)2 Fe2+ + 2OH-
Кислотные гидроксиды (оксокислоты) в водных растворах диссоциируют с образованием ионов гидроксония H3O+, которые сокращенно часто изображают в виде катиона водорода H+. Подобно основаниям, кислотные гидроксиды по степени их диссоциации подразделяют на сильные (HNO3, HClO4), средней силы (HAsO3, HClO2) и слабые (HClO, H5IO6) кислоты:
HNO3 + H2O H3O+ + NO3- (HNO3 H+ + NO3-)
HClO
+ H2O
![]() H3O+
+ ClO-
(HClO
H+
+ ClO-)
H3O+
+ ClO-
(HClO
H+
+ ClO-)
Kислоты располагаются в порядке убывания их силы (активности) в так называемом ряду активности кислот:
Сильные Средней силы
HI>HBr>HClO4>HCl>H2SO4>HMnO4>HNO3│>H2Cr2O7>H2CrO4>H2SO3>H3PO4>HF│
Слабые
> HNO2 > HCOOH > CH3COOH > H2CO3 > H2S > HClO > HCN > H3BO3 > H2SiO3
Амфотерные гидроксиды в основном плохо растворимы в воде и проявляют как слабые основные, так и кислотные свойства:
OH- + I+ I(OH), HIO IO- + H+
2OH- + Zn2+ Zn(OH)2 + 2H2O [Zn(OH)4]2- + 2H+
Образование в процессе диссоциации гидроксидов катионов гидроксония, или гидроксид-ионов определяет важнейшее химическое свойство гидроксидов – реакцию нейтрализации, приводящую к образованию воды и соли при взаимодействии оснований и кислот:
NaOH (Na + OH-) + HNO3 (H+ + NO3-) = NaNO3 (Na+ + NO3-) + H2O
OH- + H+ = H2O
Обладая кислотно-основной двойственностью, амфотерные гидроксиды в реакциях нейтрализации могут выступать как в качестве основания, так и кислоты:
I(OH) + HClO4 = IClO4 + H2O
HIO + NaOH = NaIO + H2O
Подобно амфотерным оксидам металлов, взаимодействие с основаниями их гидроксидов в водных растворах приводит к образованию солей, содержащих не оксо-, а гидроксокомплексные анионы:
Al(OH)3 + 3NaOH = Na3[Al(OH)6]
Образование же оксосолей происходит при взаимодействии амфотерных гидроксидов со щелочными расплавами:
Al(OH)3 + NaOH (расплав) = NaAlO2 + 2Н2О
В зависимости от числа OH- группировок, содержащихся в гидроксиде, кислотные гидроксиды подразделяют на одно- (HNO3), двух- (H2SO4), трех- (H3PO4) и т.д. основные кислоты, а основные гидроксиды – на одно- (NaOH), двух- (Ca(OH)2), трех- (Al(OH)3) кислотные основания.
По растворимости основания делятся на растворимые и нерастворимые. Основания щелочных (Li, Na, K, Rb, Cs) и щелочноземельных (Ca, Sr, Ba) металлов являются растворимыми в воде и называются щелочами.
Систематические названия основных и амфотерных гидроксидов образуются из слова гидроксид и русского названия элемента в родительном падеже с указанием (для элементов с переменной степенью окисления) римскими цифрами в круглых скобках степени окисления элемента:
NaOH – гидроксид натрия, Ca(OH)2 -гидроксид кальция,
TlOH - гидроксид таллия (I), Fe(OH)3 –гидроксид железа (III).
Тривиальные названия некоторых гидроксидов, в основном используемые в технической литературе, приведены в приложении 2.
Следует отметить специфику названия водного раствора аммиака, частичная диссоциация которого приводит к образованию в растворе гидроксид-ионов и проявлению слабых основных свойств. Ранее полагали, что в водном растворе аммиак образует гидроксид аммония состава NH4OH. Однако в настоящее время установлено, что основной формой существования аммиака в водном растворе является его гидратированные молекулы, которые условно записывают в виде NH3H2O и называют гидрат аммиака. Подобно аммиаку, водные растворы гидразина N2H4 и гидроксиламина NH2OH также в основном содержат гидратированные молекулы, которые называют: N2H4H2O – гидрат гидразина и NH2OHH2O – гидрат гидроксиламина.
У![]() пражнения:
пражнения:
33. Приведите систематические названия гидроксидов, классифицируйте их по кислотности и растворимости: LiOH, Sr(OH)2, Cu(OH)2, Cd(OH)2, Al(OH)3, Cr(OH)3. Приведите формулы соответствующих им оксидов.
34. Приведите молекулярные и графические формулы гидроксидов: гидроксид железа (III), гидроксид берилия, гидроксид лития, гидроксид хрома (III), гидроксид магния. Какие из данных гидроксидов будут взаимодействовать а) с гидроксидом калия, б) с оксидом бария, в) с соляной кислотой? Написать уравнения реакций.
35. Приведите реакции, демонстрирующие кислотно-основные свойства гидроксидов бария, цинка, калия и хрома (III), а также методы их получения.
Систематические названия кислотных гидроксидов (оксокислот) строятся по правилам номенклатуры для комплексных соединений, которые будут рассмотрены ниже. В тоже время, в отечественной практике широко используются традиционные названия распространенных оксокислот – угольная, серная, фосфорная и т.д. Их применение допустимо, но только для ограниченного круга действительно наиболее распространенных кислот, а в остальных случаях следует применять систематические названия.
Традиционное название оксокислоты состоит из двух слов: названия кислоты, выраженного прилагательным и группового слова кислота. Название кислоты образуется из русского названия кислотообразующего элемента (если в названии элемента есть окончание «й», «о», «а», то оно опускается) с добавлением, в зависимости от степени окисления элемента, различных окончаний (табл. 1.3, 1.4). По традиции H2CO3 называют угольной, а не углеродной кислотой.
В соответствии с менделеевским правилом «четности» для кислотообразующих p-элементов IV-VI группы наиболее характерны степени окисления соответствующие номеру группы N, а также N-2 и N-4.
Как видно из табл. 1.2, для высшей степени окисления элемента N название кислоты образуется добавлением к названию большинства элементов окончаний: -ная, -евая и –овая. Для мышьяка и сурьмы по правилам русского языка используются окончания -янная и –яная. Название кислот со степенью окисления элемента N-2 образуется в основном образуется с помощью окончания –истая (для серы, мышьяка и сурьмы: –нистая, -овистая и – янистая). Кислоты, образованные элементами с наиболее низкими степенями окисления N-4, имеют окончания –новатистая. Для фосфористой H2PHO3 и фосфорноватистой HPH2O2 кислот, характеризующихся специфическими строением в связи с наличием Р-Н связей, рекомендуется использовать специальные названия – фосфоновая и фосфиновая.
В некоторых случаях происходит образование двух форм кислот, в которых кислотообразующий элемент находится в одинаковой степени окисления. К названию кислоты с бóльшим количеством гидроксо-групп прибавляется приставка орто-, а к названию кислоты с мéньшим числом гидроксо-групп прибавляется приставка мета-.
Таблица 3. Традиционные названия оксокислот р-элементов III-VI группы.
|
N |
Эz+ |
Окончание |
Название кислоты | |
|
Высшая степень окисления элемента N | ||||
|
III |
B3+ |
-ная |
H3BO3 ортоборная, HBO2 метаборная,H2B4O7 тетраборная | |
|
Al3+ |
-евая |
H3AlO3 ортоалюминиевая, HАlO2 метаалюминевая | ||
|
IV |
C4+ |
-ная |
H2CO3 угольная | |
|
Si4+ |
-евая |
H4SiO4 ортокремниевая, H2SiO3 метакремниевая | ||
|
Ge4+ |
-евая |
H4GeO4 ортогерманиевая, H2GeO3 метагерманиевая | ||
|
Sn4+ |
-янная |
H4SnO4 ортооловянная, H2SnO3 метаоловянная | ||
|
V |
N5+ |
-ная |
HNO3 азотная | |
|
P5+ |
-ная |
H3PO4 ортофосфорная, HPO3 метафосфорная, H4P2O7 дифосфорная, H5P3O10 трифосфорная | ||
|
As5+ |
-овая |
H3AsO4 ортомышьяковая, HasO3 метамышьяковая | ||
|
Sb5+ |
-яная |
H3SbO4 ортосурьмяная, HSbO3 метасурьмяная | ||
|
VI |
S6+ |
-ная |
H2SO4 серная, H2S2O7 дисерная | |
|
Se6+ |
-овая |
H2SeO4 селеновая | ||
|
Te6+ |
-овая |
H6TeO6 ортотеллуровая, H2TeO4 метателлуровая | ||
|
Степень окисления элемента N-2 | ||||
|
V |
N3+ |
-истая |
HNO2 азотистая | |
|
P3+ |
-истая |
H2PHO3 фосфористая (фосфоновая) | ||
|
As3+ |
-овистая |
H3AsO3 ортомышьяковистая, HasO2 метамышьяковистая | ||
|
Sb3+ |
-янистая |
H3SbO3 ортосурьмянистая, HSbO2 метасурьмянистая | ||
|
VI |
S4+ |
-нистая |
H2SO3 сернистая | |
|
Se4+ |
-истая |
H2SeO3 селенистая | ||
|
Te4+ |
-истая |
H2TeO3 теллуристая | ||
|
Степень окисления элемента N-4 | ||||
|
V |
N+ |
-новатистая |
H2N2O2 азотноватистая | |
|
P+ |
-новатистая |
HPH2O2 фосфорноватистая (фосфиновая) | ||
Традиционные названия оксокислот галогенов (табл. 4) в высшей степени окисления N, также образуются добавлением к названию элемента окончания –ная. Однако, для оксокислот галогенов в степени окисления N-2 используются окончания –новатая, а окончание –истая применяется для названия кислот со степенью окисления галогенов N-4. Оксокислоты галогенов с наиболее низкими степенями окисления N-6 имеют окончания –новатистая.
Несмотря на то, что характерные степени окисления переходных d-элементов не подчиняются менделеевскому правилу «четности», высшая степень окисления d-металлов, образующих побочные подгруппы III-VII группы, также определяются номером группы N и традиционные названия их оксокислот образуются подобно р-элементам c помощью окончаний – овая, -евая: H4TiO4 титановая, H3VO4 ванадиевая, H2CrO4 хромовая, H2Cr2O7 дихромовая, HMnO4 марганцевая. Для оксокислот d-элементов в более низких степенях окисления металла рекомендуется использовать систематические названия, образованные по правилам для комплексных соединений.
Таблица 4. Традиционные названия оксокислот р-элементов VII группы.
|
N |
Эz+ |
Окончание |
Название кислоты |
|
Высшая степень окисления элемента N | |||
|
VII |
Cl7+ |
-ная |
HClO4 хлорная |
|
Br7+ |
HBrO4 бромная | ||
|
I7+ |
H5IO6 ортоиодная, HIO4 метаиодная | ||
|
Степень окисления элемента N-2 | |||
|
VII |
Cl5+ |
-новатая
|
HClO3 хлорноватая |
|
Br5+ |
HBrO3 бромноватая | ||
|
I5+ |
HIO3 иодноватая | ||
|
Степень окисления элемента N-4 | |||
|
VII |
Cl3+ |
-истая |
HClO2 хлористая |
|
Br3+ |
HBrO2 бромистая | ||
|
I3+ |
HIO2 иодистая | ||
|
Степень окисления элемента N-6 | |||
|
VII |
Cl+ |
-оватистая |
HClO хлорноватистая |
|
Br+ |
HBrO бромноватистая | ||
|
I+ |
HIO иодноватистая | ||
У![]() пражнения:
пражнения:
36. Приведите традиционные названия и графические формулы следующих оксокислот: H2SO4, H2S2O7, HNO3, HNO2, H3PO4, HPO3, H4P2O7, H2PHO3, HPH2O2, HClO, HClO2, HClO3, HClO4, H5IO6, HMnO4, H2Cr2O7.
37. Приведите молекулярные и графические формулы следующих оксокислот: бромноватистая, иодная, селенистая, ортотеллуровая, метамышьяковая, дикремниевая, метаоловянная, фосфористая (фосфоновая), фосфорноватистая (фосфиновая), пентафосфорная, метаванадиевая.
38. Приведите реакции, демонстрирующие общие методы получения оксокислот. Приведите примеры оксидов элементов в промежуточных степенях окисления, которые при взаимодействии с водой образуют две кислоты.
39. Напишите реакции дегидратации следующих кислот: H3BO3, HMnO4, H2S2O7, HNO2, H3PO4, H2WO4, H3AsO3, H2CrO4. Приведите названия кислот и получающихся кислотных оксидов (ангидридов кислот).
40. Какие из перечисленных веществ будут взаимодействовать с соляной кислотой: Zn, CO, Mg(OH)2, CaCO3, Cu, N2O5, Al(OH)3, Na2SiO3, BaO? Напишите уравнения реакций.
41. Напишите реакции, демонстрирующие кислотный характер следующих оксидов, назовите соответствующие им кислоты: P4O10, SeO3, N2O3, NO2, SO2, As2O5.
42. Приведите реакции взаимного перехода между фосфорными кислотами: H3PO4HPO3, H3PO4H4P2O7, HPO3H3PO4, HPO3H4P2O7, H4P2O7HPO3, H4P2O7H3PO4.
Пероксокислоты.
![]() Кислотные
гидроксиды, содержащие пероксидную
группу –О-О- получили групповое
название
пероксокислоты.
Пероксидная группа в составе
пероксокислот может замещать как
атом кислорода в гидроксидной
группировке, так и мостиковый кислородный
атом, объединяющий атомы элемента
кислотообразователя в
полиядерных кислотных гидроксидах:
Кислотные
гидроксиды, содержащие пероксидную
группу –О-О- получили групповое
название
пероксокислоты.
Пероксидная группа в составе
пероксокислот может замещать как
атом кислорода в гидроксидной
группировке, так и мостиковый кислородный
атом, объединяющий атомы элемента
кислотообразователя в
полиядерных кислотных гидроксидах:
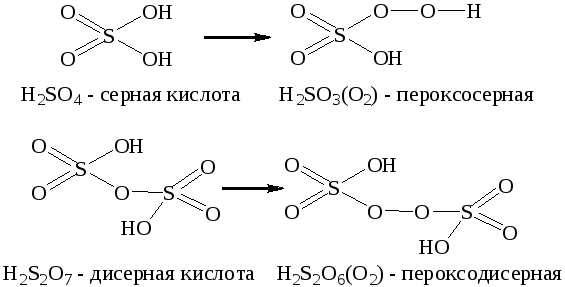
При записи формул пероксокислот рекомендуется пероксидную группу заключать в круглые скобки и записывать в правой части формулы. Традиционные названия пероксокислот образуются из названия соответствущей оксокислоты с добавлением приставки пероксо-. При наличии в составе пероксокислоты нескольких пероксидных группировок их количество указывается численной приставкой: ди-, три-, тетра- и т.д. Например: HNO2(O2) пероксоазотная кислота, H3PO2(O2)2 дипероксофосфорная кислота.
У![]() пражнение:
пражнение:
43.Приведите традиционные названия и графические формулы следующих пероксокислот: H3PO2(O2), H4P2O6(O2), H3BO2(O2).
Тиокислоты, политионовые и другие замещенные оксокислоты*- раздел для углубленного изучения.
Оксокислоты, в которых часть или все атомы кислорода замещены на атомы серы, называют тиокислотами. При записи формул тиокислот рекомендуется серу помещать на последнее место справа - H3PO3S, H3PO2S2, H3POS4, H3PS4:
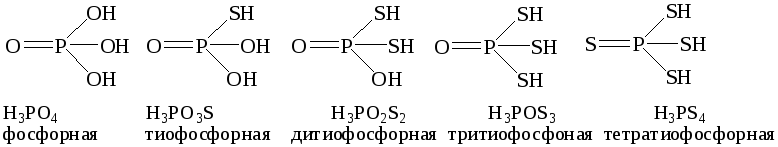
Традиционные названия тиокислот образуются из названия соответствующей оксокислоты с добавлением приставки тио-; при замещении двух и более атомов кислорода на атомы серы их количество указывается численными приставками: ди-, три-, тетра- и т.д.
Оксокислоты общей формулы H2(O3S-Sn-SO3) (n = 04) называют политионовыми. Характерной особенностью их строения (за исключение H2S2O6) является наличие мостиковых атомов серы, объединяющих две структурные {SO3}-группировки:
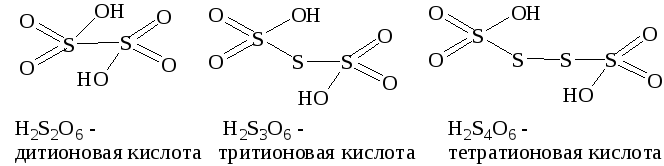
В дитионовой кислоте две структурные группировки объединениы непосредственно атомами серы-кислотообразователями H2(O3S-SO3). Традиционные названия политионовых кислот состояи из чмсловой приставки, указывающей общее количество атомов серы в составе и группового окончания –тионовая кислота.
Кислотные гидроксиды, в которых часть гидроксидных группировок или атомов кислорода замещена на другие атомы галогенов или -NH2, =NH группировки, называют замещенными кислотами. Традиционные названия таких кислот образуются от названия соответствующей оксокислоты с добавлением приставки, составленной из названия замещающих атомов галогенов или групп (NH2 – амид, NH – имид) и соединительной гласной –о. В формулах таких кислот замещающие атомы или группы помещают на последнее место.
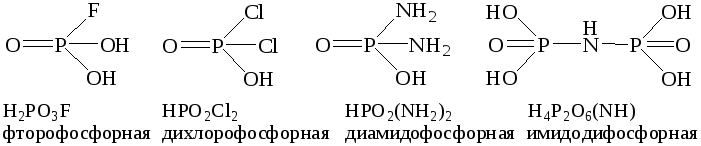
По традиции, замещенные серные кислоты называют сульфоновыми кислотами:
HSO3F - фторсульфоновая, HSO3Cl - хлорсульфоновая,
HSO3(NH2) – амидосульфоновая, H2S2O4(NH) - имидодисульфоновая кислота.
У![]() пражнения:
пражнения:
44. Приведите традиционные названия замещенных оксокислот: HSeO3F, HAsO2Cl2, H2CS3, H3POS3, H2AsO3(NH2).
45. Приведите молекулярные и графические формулы кислот: тиосерная, тритионовая, дитиосурьмяная, амидосульфоновая, диброммышьяковая, амидоугольная.
Бескислородные кислоты.
![]() Водные растворы
водородных соединений халькогенов
(H2S,
H2Se,
H2Te)
и галогенов (HF,
HCl,
HBr,
HI),
а также псевдогалогенов
(HCN,
HNCS,
HCNO,
HN3),
в которых роль электроотрицательных
составляющих (анионов) играют
группы атомов, обладающих
галогенидоподобными свойствами,
проявляют кислотные свойства и
диссоциируют с образованием ионов
гидроксония. Они образуют семейство
бескислородных
кислот.
Водные растворы
водородных соединений халькогенов
(H2S,
H2Se,
H2Te)
и галогенов (HF,
HCl,
HBr,
HI),
а также псевдогалогенов
(HCN,
HNCS,
HCNO,
HN3),
в которых роль электроотрицательных
составляющих (анионов) играют
группы атомов, обладающих
галогенидоподобными свойствами,
проявляют кислотные свойства и
диссоциируют с образованием ионов
гидроксония. Они образуют семейство
бескислородных
кислот.
Систематическое название бескислородных кислот образуется из русского названия элемента или специального названия псевдогалогенидной группировки с добавлением соединительной гласной –о и словосочетания водородная кислота:
HF - фтороводородная кислота, H2Te - теллуроводородная кислота,
HCN - циановодородная кислота, HNCS - тиоцианатоводородная кислота,
HN3 - азидоводородная кислота (или азотистоводородная кислота).
Исторически для водных растворов ряда бескислородных кислот в химической практике применяют и тривиальные названия (см. приложение 2):
HF - плавиковая кислота, HCl - соляная кислота,
HCN - синильная кислота, H2S - сероводородная вода.
![]()
Упражнение:
46. Приведите систематические и тривиальные названия бескислород-ных кислот: HCl, HCN, HBr, HNCS, HI, H2S, HF, H2Se.
47. Приведите формулы следующих кислот: синильная, бромоводородная, плавиковая, азидоводородная, сероводородная, родановодородная, иодоводородная, циановодородная, тиоционатоводородная кислота.
Галогенангидриды.
Г![]() алогенангидридаминазывают
сложные вещества, которые можно
рассматривать как продукты полного
замещения гидроксидных группировок
в молекулах оксокислот
атомами галогенов.
Таким образом, галогенангидриды
являются конечным членом ряда
последовательных превращений
оксокислоты при замещении
гидроксидных групп на атомы галогенов:
оксокислота
галогензамещенная оксокислота
галогенангидрид. Например,
POCl3
является конечным членом ряда
последовательного замещения
трех гидроксидных групп в ортофосфорной
кислоте:
алогенангидридаминазывают
сложные вещества, которые можно
рассматривать как продукты полного
замещения гидроксидных группировок
в молекулах оксокислот
атомами галогенов.
Таким образом, галогенангидриды
являются конечным членом ряда
последовательных превращений
оксокислоты при замещении
гидроксидных групп на атомы галогенов:
оксокислота
галогензамещенная оксокислота
галогенангидрид. Например,
POCl3
является конечным членом ряда
последовательного замещения
трех гидроксидных групп в ортофосфорной
кислоте:
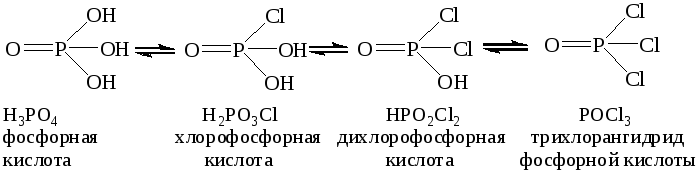
Некоторые галогенангидриды могут быть рассмотрены как производные неустойчивых оксокислот – например, CCl4 и PCl5 формально являются хлорангидридами полностью гидратированных кислотных гидроксидов углерода (IV) H4CO4 и фосфора (V) H5PO5, в которых число гидроксидных групп совпадает со степенью окисления элемента-кислотообразователя. Галогенангидриды могут содержать либо атомы только одного галогена, либо атомы разных галогенов: POCl3, POBrCl2, POIBrCl.
В химической практике для галогенангидридов используют несколько методов построения их названий:
по правилам систематической номенклатуры для сложных соединений с использованием латинских числовых приставок указывающих количество электроотрицательных галогенидных и оксидных ионов галогенангидрида:
PCl3 - трихлорид фосфора, PCl5 - пентахлорид фосфора,
POCl3 - трихлорид-оксид фосфора, POBrCl2 - дихлорид-бромид-оксид фосфора;
по правилам систематической номенклатуры для бинарных соединений с указанием по методу Штока римскими цифрами в круглых скобках степени окисления элемента:
PCl3 - хлорид фосфора (III), PCl5 - хлорид фосфора (V);
традиционные названия образуют с помощью числовых приставок, указывающих количество атомов галогенов, русского названия галогенов, окончания – ангидрид и названия килоты в родительном падеже: PCl3 - трихлорангидрид фосфористой кислоты, POCl3 - трихлорангидрид фосфорной кислоты, POBrCl2 - дихлорбромангидрид фосфорной кислоты;
для галогеннгидридов серной и сернистой кислоты допускается ограниченное использование специальных названий, в которых применяются специальные названия катионов: SO22+ - сульфурил и SO2+ - тионил:
SO2Cl2 - сульфурилхлорид, SO2FCl - сульфурилхлоридфторид,
SOBr2 - тионилбромид, SOF2 - тионилфторид.
Характерным химическим свойством галогенангидридов является их эффективное взаимодействие с водой с образованием галогеноводородной и оксокислоты:
PCl5 + 3H2O = H3PO4 + 5HCl
POBrCl2 + 3H2O = H3PO4 + 2HCl + HBr
![]() Упражнения:
Упражнения:
48. Приведите систематические и традиционные названия галогенангидридов и напишите реакции их взаимодействия с водой: SbOCl, SeO2F2, NOBr, NO2F2, NF3, AsOCl2F, CO2Cl2, SOCl2, SO2Br2.
49. Приведите молекулярные и графические формулы галогенангидридов: хлорид-оксид бора, бромид кремния(IV), дифторид-оксид кремния, сульфурилфторид, дихлорангидрид селенистой кислоты, сульфурилбромид, тионилхлорид, хлоробромойодоангидрид ортофосфорной кислоты, дихлоробромоангидрид ортомышьяковой кислоты, тионилфторид.
Соли.
С оли
являются одним из наиболее емких по
числу химических соединений
классов неорганических соединений.
Они образуются в результате самых
разнообразных химических
процессов и, в частности, являются
продуктами кислотно-основных реакций
взаимодействия основных и кислотных
бинарных ЭnXm
и полиэлементных химических
соединений, характеризующихся
соответственно преимущественно
ионным и ковалентным характером
химической связи Э-Х (табл. 1.5).
оли
являются одним из наиболее емких по
числу химических соединений
классов неорганических соединений.
Они образуются в результате самых
разнообразных химических
процессов и, в частности, являются
продуктами кислотно-основных реакций
взаимодействия основных и кислотных
бинарных ЭnXm
и полиэлементных химических
соединений, характеризующихся
соответственно преимущественно
ионным и ковалентным характером
химической связи Э-Х (табл. 1.5).
Таблица 1.5. Кислотно-основные реакции солеобразования.
|
Соединения |
Реакция солеобразования | |
|
Основные |
Кислотные | |
|
NaF |
PF5 |
NaF + PF5 = Na[PF6] |
|
Na2O |
P2O5 |
3Na2O + P2O5 = 2Na3[PO4] Na2O + P2O5 = 2Na[PO3] |
|
Na2S |
P2S5 |
3Na2S + P2S5 = 2Na3[PS4] Na2S + P2S5 = 2Na[PS3] |
|
Na3N |
P3N5 |
Na3N + P3N5 = Na4[PN3] |
|
NaH |
AlH3 |
NaH + AlH3 = Na[AlH4] |
|
NaOH |
Al(OH)3 |
NaOH + Al(OH)3 = Na[Al(OH)4] NaOH + Al(OH)3 = Na[AlO2] + H2O |
|
NaNO3 |
I(NO3) |
NaNO3 + I(NO3) = Na[I(NO3)2] |
|
NaOH |
HNO3 |
NaOH + HNO3 = Na[NO3] + H2O |
|
Al(OH)3 |
H3PO4 |
Al(OH)3 + H3PO4 = Al[PO4] + 6H2O 2Al(OH)3 + 3H3PO4 = Al2[HPO4]3 + 6H2O Al(OH)3 + 3H3PO4 = Al[H2PO4]3 +3H2O 3Al(OH)3 + 2H3PO4 = (AlOH)3[PO4]2 + 6H2O 3Al(OH)3 + H3PO4 = {Al(OH)2}3[PO4] + 3H2O |
|
NaOH + Ba(OH)2 |
H3PO4 |
NaOH + Ba(OH)2 + H3PO4 = (NaBa)[PO4] + 3H2O |
|
Al(OH)3 |
H2SO4+ HNO3 |
Al(OH)3 + H2SO4 + HNO3 = Al[(SO4)NO3] + H2O |
В составе солей можно выделить катионную и анионную составляющие, являющиеся производными исходных основных и кислотных соединений и имеющих преимущественно ионный характер химической связи. Вследствие этого в расплавах и растворах соли подвергаются процессу электролитической диссоциации, приводящей к образованию катионов и анионов.
В зависимости от состава соли классифицируются по природе катионов и анионов:
соли со сложными катионами на основе двух разных ионов металла или иона аммония и металла ({(KAl)[SO4]2, {(NH4)2Fe}[SO4]2) называются двойными солями, а соли со сложными анионами (Ca[(ClO)Cl], Fe[(SO4)NO3]) – смешанными солями:
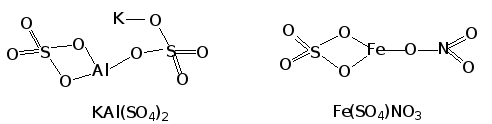
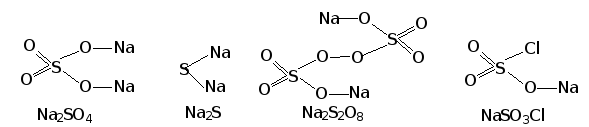
в зависимости от того, анионы каких кислот входят в состав соли, выделяют: соли оксокислот и бескислородных кислот (Na2SO4 и Na2S), а также соли различных замещенных оксокислот (Na2S2O8, Na2SO3S, NaSO3Cl и т.д.):
cоли, в состав катионов которых входят гидроксидные группировки (Al(OH)[SO4], {Al(OH)}2[SO4], Al(OH)2Cl) и способные проявлять основные свойства за счет образования OH--ионов в результате процесса электролитической диссоциации катиона – например:
Al(OH)SO4Al(OH)2+ + SO42-
Al(OH)2+ Al3+ + OH-
называются основными. Такие соли могут быть рассмотрены как продукты частичного замещения гидроксидных групп в основных гидроксидах на группировки, являющиеся кислотными остатками соответствующих оксо- или бескислородных кислот:

соли, анионы которых содержат атомы водорода ((NH4)[HSO4], NaHS) и способны проявлять кислотные свойства за счет образования ионов гидроксония при электролитической диссоциации аниона – например:
NaHS Na+ + HS-, HS- H+ + S2-
называются кислыми. Такие соли могут быть рассмотрены как продукты частичного замещения водорода в кислотах на катионы металла или аммония:

соли, являющиеся продуктами полного замещения гидроксидных групп на кислотные остатки или атомов водорода на катионы металла (аммония), называются средними или нормальными.
Некоторые соли при кристаллизации из водных растворов образуют кристаллические решетки, содержащие молекулы воды – например: CuSO45H2O, Na2SO410H2O. Такие соли называются кристаллогидратами.
Как видно из табл. 1.5, кислые и основные соли образуются в результате реакций нейтрализации при различных соотношениях многосновных кислот и многокислотных оснований и легко переходят как друг в друга, так и в средние соли: Al(H2PO4)3 + Al(OH)3 = Al2(HPO4)3 + 3H2O
Al2(HPO4)3 + Al(OH)3 = 3AlPO4 + 3H2O
2AlPO4 + Al(OH)3 = (AlOH)3(PO4)2
(AlOH)3(PO4)2 + 3Al(OH)3 = 2{Al(OH)2}3PO4
{Al(OH)2}3PO4 + H3PO4 = (AlOH)3(PO4)2 + 3H2O
(AlOH)3(PO4)2 + H3PO4 = 3AlPO4 + 3H2O
2AlPO4 + H3PO4 = Al2(HPO4)3
Al2(HPO4)3 + H3PO4 = 2Al(H2PO4)3
Систематические названия средних солей бескислородных солей образуют по общим правилам для бинарных соединений:
Na2S - сульфид натрия, FeCl3 - хлорид железа (III) (трихлорид железа),
Cu(CN)2 - цианид меди (II), AgCNS - тиоцианат серебра.
Систематические названия солей оксокислот и их производных образуются по правилам номенклатуры для комплексных соединений, которые будут рассмотрены далее. В то же время, как и для кислот, в химической практике для наиболее распространенных солей оксокислот широко используют традиционные названия.
Традиционные названия солей состоят из названий анионов и катионов. Название анионов средних солей распространенных оксокислот строится из корней русских или латинских (Табл. 1.) названий кислотообразующих элементов с соответствующими окончаниями и приставками в зависимости от их степени окисления (Табл. 6, 7) и через дефис групповым словом –ион. Для р-элементов III-VI группы в высшей степени окисления в названии анионов используют окончание –ат, в более низкой степени (N-2) – суффикс –ит и для N+ и P+ - пристаку гипо- и окончание –ит.
Для галогенов в степени окисления +7 в названии анионов используют приставку пер- и окончание –ат; для степеней окисления: +5 – окончание -ат, +3 – окончание –ит и для наиболее низкой +1 – приставку гипо- и окончание –ит.
Различные приставки: мета-, орто-, ди-, три- и т.д., используемые в названии оксокислот для указания их формы, сохраняются и в названиях анионов.
Для оксоанионов образованных d-элементами в основном используются систематические названия и только для ограниченного круга анионов (Табл. I-5.) в химической практике применяют традиционные названия.
В целом, традиционное название средних солей оксокислот строится из названия аниона (групповое слово –ион опускается) и русского названия катиона в родительном падеже с указанием римскими цифрами в круглых скобках его степени окисления (если она может быть переменной):
Fe2(S2O7) - дисульфат железа (III), Na3PO4 - ортофосфат натрия,
Ba5(IO6) - ортопериодат бария, NiSeO3 - селенит никеля (II),
NaPH2O2 - гипофосфит натрия, KMnO4 - перманганат калия.
Таблица 6. Традиционные названия оксоанионов p-элементов III-VI групп.
|
N |
Эz+ |
Приставка/окончание |
Анион, название-ион |
|
Высшая степень окисления N | |||
|
VI |
S6+ |
/-ат |
SO42- сульфат-, S2O72- дисульфат- |
|
Se6+ |
SeO42- селенат- | ||
|
Te6+ |
TeO42- метателлурат-, TeO66- ортотеллурат- | ||
|
V |
N5+ |
NO3- нитрат- | |
|
P5+ |
PO43- ортофосфат-, PO3- метафосфат-, P2O74- дифосфат- | ||
|
As5+ |
AsO43- ортоарсенат-, AsO3- метаарсенат- | ||
|
Sb5+ |
SbO43- ортоантимонат- | ||
|
Bi5+ |
BiO3- висмутат- | ||
|
IV |
C4+ |
CO32- карбонат- | |
|
Si4+ |
SiO32- силикат- | ||
|
Ge4+ |
GeO32- германат- | ||
|
Sn4+ |
SnO32- станнат- | ||
|
Pb4+ |
PbO44- ортоплюмбат-, PbO32- метаплюмбат- | ||
|
III |
B3+ |
BO33- ортоборат-, BO2- метаборат-, B2O74- диборат- | |
|
Al3+ |
AlO2- метаалюминат- | ||
|
Степень окисления N-2 | |||
|
VI |
S4+ |
/-ит |
SO32- сульфит-, S2O52- дисульфит- |
|
Se4+ |
SeO32- селенит- | ||
|
Te4+ |
TeO32- теллурит- | ||
|
V |
N3+ |
NO2- нитрит- | |
|
P3+ |
PHO32- фосфит- (фосфонат-) | ||
|
As3+ |
AsO33- ортоарсенит-, AsO2- метаарсенит- | ||
|
Sb3+ |
SbO33- ортоантимонит-, SbO2- метаантимонит- | ||
|
Степень окисления N-4 | |||
|
V |
N+ |
Гипо-/-ит |
N2O22- гипонитрит- |
|
|
P+ |
PH2O2- гипофосфит- (фосфинат-) | |
|
|
|
|
|
Таблица 7. Традиционные названия оксоанионов p-элементов VII группы.
|
Приставка/окончание |
Анион, название-ион |
|
Высшая степень окисления +7 | |
|
Пер-/ат- |
ClO4- перхлорат-, BrO4- пербромат-, IO65- ортопериодат-, IO4- метапериодат |
|
Степень окисления +5 | |
|
-/ат- |
ClO3- хлорат-, BrO3- бромат-, IO3- иодат- |
|
Степень окисления +3 | |
|
-/ит- |
ClO2- хлорит-, BrO2- бромит-, IO2- иодит- |
|
Степень окисления +1 | |
|
Гипо-/ит- |
ClO- гипохлорит-, BrO- гипобромит-, IO- гипоиодит- |
Таблица 8. Традиционные названия оксоанионов d-элементов.
|
Группа |
Элемент |
Анион, название-ион |
|
III |
Sc3+ |
ScO2- скандиат- |
|
IV |
Ti4+, Zr4+, Hf4+ |
TiO44- ортотитанат-, TiO32- метатитанат-, ZrO44- ортоцирконатат-, ZrO32- мецирконат-, HfO44- ортогафниат-, HfO32- мегафниат- |
|
V |
V5+, Nb5+, Ta5+ |
VO3- ванадат-, NbO3- ниобат-, TaO3- танталат- |
|
VI |
Cr6+, Mo6+, W6+ |
CrO42- хромат-, Cr2O72- дихромат-, MoO42- молибдат-, WO42- вольфрамат- |
|
Cr3+ |
CrO2- хромит- | |
|
VII |
Mn+7, Tc7+, Re7+ |
MnO4- перманганат-, TcO4- пертехнеат-, ReO4- перренат- |
|
Mn6+ |
MnO42- манганат- | |
|
Mn4+ |
MnO44- ортоманганит-, MnO32- метаманганит- | |
|
VIII |
Fe6+, Ru6+ |
FeO42- феррат-, RuO42- рутенат- |
|
Fe3+ |
FeO2- феррит- | |
|
I |
Сu3+ |
СuO2- купрат- |
|
II |
Zn2+ |
ZnO22- цинкат- |
При традиционном названии двойных и смешанных солей, входящие в их состав катионы и анионы последовательно перечисляются:
KAl(SO4)2 - сульфат алюминия-калия, Сa(ClO)Cl - хлорид-гипохлорит кальция.
Тривиальные названия солей, используемые в технической литературе, приведены в приложении 2.
Традиционные названия солей замещенных оксокислот содержат специальные приставки, указывающие природу замещающей группировки:
- пероксо- для солей пероксокислот (NaSO3(O2) - пероксосульфат натрия, BaS2O6(O2) - пероксодисульфат бария);
- тио- для солей тиокислот (K3PO3S - тиофосфат калия, BaSO3S - тиосульфат бария, Na3PO2S2 - дитиофосфат натрия, Na3PS4 - тетратиофосфат натрия);
- галогено-, амидо-, имидо-, селено- и т.д. для соответствующих солей замещенных кислот (ZnSeO2F2 - дифтороселенат цинка, Na2PO3(NH2) - амидофосфат натрия, Na4P2O6(NH) - имидодифосфат натрия, Na3PO3Se - селенофосфат натрия);
- исторически в названии солей замещенной серной кислоты (как и для самих кислот) после приставки используют групповое название –сульфонат (KSO3Cl - хлорсульфонат калия, Ba(SO3F)2 - фторсульфонат бария, NaSO3(NH2) - амидосульфонат натрия);
- в традиционных названиях солей политионовых кислот используют групповое название -тионат c указанием числовыми приставками количества атомов серы (Na2S2O6 - дитионат натрия, (NH4)2S4O6 - тетратионат аммония).
Кислые соли – традиционные названия кислых солей образуются из названий соответствующих средних солей с добавлением к названию аниона приставки гидро- и числительного ди-, три-, тетра- и т.д., указывающего число незамещенных атомов водорода в кислотном остатке:
KHSO3 - гидросульфит калия, Fe(H2P2O7) - дигидродифосфат железа (II), NaH4IO6 - тетрагидропериодат натрия, Ca(HS)2 - гидросульфид кальция. Следует отметить, что, несмотря на наличие в составе солей фосфористой H2PHO3 и фосфорноватистой HPH2O2 кислот атомов водорода – Na2PHO3, NaPH2O2, данные соли являются средними (фосфит и гипофосфит натрия), поскольку оставшиеся атомы водорода не замещаются на катионы металла или аммония.
Основные соли – традиционные названия основных солей также образуют из названий средних солей с добавлением к названию аниона приставки гидроксо- и числительного ди-, три- и т.д., указывающего число незамещенных гидроксидных группировок в соответствующем основном гидроксиде: (FeOH)NO3 - гидроксонитрат железа (II), {Al(OH)2}3AsO4 - дигидроксоарсенат алюминия, (BaOH)Cl - гидроксохлорид бария.
Основные соли, содержащие две незамещенные гидроксидные группировки могут подвергаться (подобно мнокислотным основным гидроксидам) процессу дегидратации с образованием солей, содержащих оксокатионы:
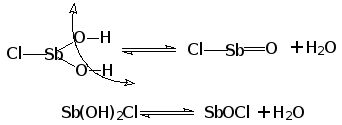
Такие соли рекомендуется называть по типу соединений, содержащих оксидные O2—ионы – например: SbOCl хлорид-оксид сурьмы, BiO(NO3) нитрат-оксид висмута, UO2SO4 сульфат-диоксид урана. Однако традиционно такие соединения часто рассматривают как соли, содержащие оксокатионы металлов, которые называют добавляя окончание –ил к русскому или латинскому (Табл. I-1.) названию металла: SbO+ - антимонил (стибил), BiO+ - висмутил, CrO+ - хромил, UO22+ - уранил. Вследствие этого в химической практике такие соли часто называют по типу средних солей, используя соответствующие названия оксокатионов:
SbOCl - хлорид антимонила, BiO(NO3) - нитрат висмутила,
UO2SO4 - сульфат уранила.
Кристаллогидраты солей – названия кристаллогидратов солей состоят из группового слова гидрат с приставкой ди, три, тетра и т.д., указывающей число молекул воды в составе соли, и традиционного или систематического названия соли: Pb(BrO3)2H2O - гидрат бромата свинца (II), Mn(H2PO4)22H2O - дигидрат дигидрофосфата марганца (II), Na2CO310H2O - декагидрат карбоната натрия.
У![]() пражнения:
пражнения:
50.Приведите традиционные названия средних оксосолей: FeSO4, Fe2(S2O7)3, CoSO3, K2TeO4, Na6TeO6, Hg2(NO3)2, CsNO2, Ca3(PO4)2, Mg2P4O7, NiBr2, CaPHO3, LiPH2O2, K2CO3, Na3BO3, PbPbO3 (Pb2O3), Pb2PbO4 (Pb3O4), KBO2, (CH3COO)2Pb, Na2B4O7, K2ZnO2, Na2CrO4, K2Cr2O7, Fe2FeO4 (Fe3O4), KMnO4, K2MnO4, LiClO4, NaClO3, Mg(ClO2)2, KClO.
51.* Приведите традиционные названия солей замещенных оксокислот: K2S2O8, Na2S2O3, Mg(SO3Cl)2, K2SeO2F2, K2SO3Br, Na3PS4.
52. Приведите молекулярные и графические формулы средних солей: пербромат калия, перхлорат магния, метапериодат цезия, перманганат калия, хлорит кальция, нитрит лития, бериллат натрия, бромид железа(II), дихромат аммония, ацетат натрия, манганат цезия, ортоарсенат цинка.
53.* Приведите молекулярные и графические формулы солей замещенных кислот: фторсульфонат натрия, тритиокарбонат бария, тиоортофосфат калия.
54. Приведите традиционные названия кислых и основных оксосолей: Na2H2P2O7, NaH2PO4, Na2HPO4, Ca(HSO3)2, Na2H3IO6, [Al(OH)2]SO4, Fe(OH)NO2, (CuOH)2CO3.
55.Написать реакции образования Mg3(PO4)2, Ca(NO3)2 и Ba(ClO4)2 при взаимодействии: а) кислоты и основания, б) кислоты и основного оксида, в) кислотного и основного оксидов, г) кислотного оксида и основания.
56. Приведите молекулярные и графические формулы кислых и основных солей: дигидроарсенат хрома(III), гидросульфат железа(III), нитрит гидроксоалюминия, фосфит гидроксомагния.
57. Приведите традиционные названия и графические формулы солей, содержащих оксокатионы: UO2(NO3)2, (BiO)SO4, SbOClO4.
58. Приведите традиционные названия и графические формулы смешанных и двойных солей: KAl(SO4)2, Ca(ClO)Cl.
59. Приведите традиционные названия кристаллогидратов: CuSO45H2O, Na2B4O710H2O, (СrO)3AsO412H2O.
60. Приведите систематические названия и графические формулы солей бескислородных кислот: Fe(HS)2, Mg(OH)CN, [Al(OH)2]2Se, AsOCl.
61. Напишите уравнений реакций образования средних, кислых и основных солей в результате взаимодействия: а) гидроксида магния и угольной кислоты, б) гидроксида алюминия и ортофосфорной кислоты, в) гидроксида железа (III) и серной кислоты. Назовите продукты реакций и напишите их графические формулы.
62. Напишите уравнения реакций превращения следующих солей в средние соли, назовите исходные вещества и продукты реакций: [Al(OH)2]2SO4, KH2PO4, NiOHBr, Na2HAsO4, Cr(OH)2NO3, Ca(HCO3)2.
63. Напишите уравнения реакций, протекающих между данными веществами в растворе: Al(H2PO4)3 и Ba(OH)2, Pb(CH3COO)2 и KI, FeS и HCl, K2CrO4 и BaCl2, Fe(OH)SO4 и NaOH, CrCl3 и KOH (изб.).
64. Какие из перечисленных солей Al(OH)(NO3)2, K3PO4, NaHSO4, CH3COONH4, NiOHCl, BaClBr, KAg(NO3)2 будут взаимодействовать: а) с KOH, б) H2SO4? Напишите уравнения возможных еакций, назовите исходные вещества и продукты реакций.
65. Осуществить следующие превращения, назвать продукты реакций:
a) Zn → ZnSO4 → Zn(OH)2 → ZnOHBr → ZnBr2
↓ ↓
ZnO → Na2ZnO2 K2[Zn(OH)4] → ZnCl2 → AgCl
б) S → SO2 → SO3 → H2SO4 → NaHSO4 → Na2SO4 → BaSO4
↓ ↓ NH3∙H2O NH3∙H2O
Li2SO3 CuSO4 → (CuOH)2SO4 → [Cu(NH3)4](OH)2
в) H4P2O7 → P4O10 → Ca3(PO4)2 → CaCl2 → CaCO3 → Ca(HCO3)2
Основные положения координационной теории.
О сновы
теории координационных соединений были
заложены в 1893 г. А. Вернером2.
В состав комплексного
соединения
входит координационный
центр –
центральный
атом или
ион,
называемый комплексообразователем,
и непосредственно
взаимодействующие с ним
(координирующиеся вокруг него)
другие структурные элементы
(атомы, ионы, молекулы) – лиганды3.
Одно из
наиболее общих определений4
гласит - «координационными
называются соединения, существующие
как в кристаллическом состоянии,
так и в растворе, особенностью которых
является наличие центрального
атома (акцептора электронов),
окруженного лигандами (донорами
электронов)”.
сновы
теории координационных соединений были
заложены в 1893 г. А. Вернером2.
В состав комплексного
соединения
входит координационный
центр –
центральный
атом или
ион,
называемый комплексообразователем,
и непосредственно
взаимодействующие с ним
(координирующиеся вокруг него)
другие структурные элементы
(атомы, ионы, молекулы) – лиганды3.
Одно из
наиболее общих определений4
гласит - «координационными
называются соединения, существующие
как в кристаллическом состоянии,
так и в растворе, особенностью которых
является наличие центрального
атома (акцептора электронов),
окруженного лигандами (донорами
электронов)”.
Совокупность центрального атома (иона) комплексообразователя и лигандов составляет внутреннюю координационную сферу комплекса, которая и представляет собой собственно комплексную (координационную) частицу, существующую при определенных условиях как единое целое. В зависимости от соотношения зарядов координационного центра и лигандов комплексная частица может быть как нейтральной, так и положительно или отрицательно заряженной. Компенсация избыточного отрицательного или положительного заряда комплексной частицы происходит в результате ее электростатического взаимодействия с противоположно заряженными с катионами или анионами, которые образуют внешнюю сферу комплекса. Внутреннюю сферу комплекса при записи химической формулы, как правило, отделяют от внешней квадратными скобками: K4[Fe(CN)6], [Co(NH3)5Cl]Cl2, Na2[SO4], [NH4]Cl. Следует отметить, что в формулах часто встречающихся солей, кислот квадратные скобки часто опускаются. Однако с точки зрения координационной теории в этих соединениях также можно выделить внутрисферную и внешнесферную составляющие. Например, в сульфате натрия внутреннюю сферу образуют атом серы (гипотетический ион S6+) и непосредственно координированные к нему четыре эквивалентных атома кислорода (оксидных O2—иона), каждый из которых образует по одной -связи с серой и участвует в образовании двух делокализованных по всей внутренней сфере -связей. Суммарный отрицательный заряд комплекса [SO4]2- компенсируется двумя катионами Na+, связанными с комплексным сульфат-ионом преимущественно ионной связью.
 Принципиальным
отличием внутрисферных лигандов и
внешнесферных частиц комплекса
является с одной стороны отсутствие
непосредственного взаимодействия
внешнесферных частиц с координационным
центром, а с другой – различный
характер химической связи:
преимущественно ионный
между внешнесферными частицами
и комплексной частицей и ионно-ковалентный
(донорно-акцепторный)
характер взаимодействия между
лигандами и координационным центром
во внутренней сфере комплекса.
Это приводит к различной эффективности
процессов электролитической диссоциации
комплексных соединений в водных
растворах. Диссоциация комплексных
соединений на внутреннюю и внешнюю
сферу, называемая первичной
диссоциацией,
протекает практически нацело по
типу сильных электролитов, а вторичная
диссоциация – образование
в объеме раствора гидратированных
компонентов внутренней сферы
комплекса по типу слабых электролитов:
Принципиальным
отличием внутрисферных лигандов и
внешнесферных частиц комплекса
является с одной стороны отсутствие
непосредственного взаимодействия
внешнесферных частиц с координационным
центром, а с другой – различный
характер химической связи:
преимущественно ионный
между внешнесферными частицами
и комплексной частицей и ионно-ковалентный
(донорно-акцепторный)
характер взаимодействия между
лигандами и координационным центром
во внутренней сфере комплекса.
Это приводит к различной эффективности
процессов электролитической диссоциации
комплексных соединений в водных
растворах. Диссоциация комплексных
соединений на внутреннюю и внешнюю
сферу, называемая первичной
диссоциацией,
протекает практически нацело по
типу сильных электролитов, а вторичная
диссоциация – образование
в объеме раствора гидратированных
компонентов внутренней сферы
комплекса по типу слабых электролитов:
K4[Fe(CN)6] [Fe(CN)6]4- + 4K+
[Fe(CN)6]4- Fe2+ + 6CN-
Это служит одним из экспериментальных приемов установления состава внутренней и внешней сферы комплексных соединений. Например, при проведении реакции взаимодействия комплекса [Co(NH3)5Cl]Cl2 с нитратом серебра в результате обменной реакции: [Co(NH3)5Cl]Cl2 + 2AgNO3 = 2AgCl + [Co(NH3)5Cl]NO3 осаждается только два хлоридных иона, что указывает на присутствие третьего иона хлора в составе внутренней сферы комплекса.
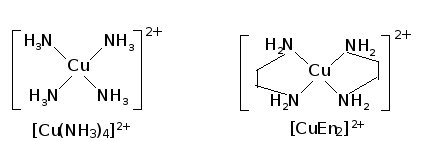 Количественный
состав внутренней сферы комплекса
определяется величиной координационного
числа
центрального атома (иона) – числом
координированных лигандов.
Так, в K[Ag(CN)2],
Na2[CO3],
[NH4]Cl,
Ni(CO)4,
PF5,
[Co(H2O)6]Cl3
- координационные числа Ag+,
C4+,
N3-,
Ni,
P5+,
Co3+
составляют: 2, 3, 4, 5 и 6. Количество
связей, которые образует один лиганд с
комплексообразователем, называется
дентатностью
лиганда.
Каждый из лигандов в рассмотренных выше
комплексах занимает одно координационное
место. Такие лиганды называются
монодентатными.
В тоже время, один лиганд может занимать
несколько координационных мест
во внутренней сфере комплекса в
результате образования нескольких
донорно-акцепторных связей с
координационным центром. Например,
в отличие от молекулы аммиака, способной
образовывать только одну
донорно-акцепторную связь с
участием неподеленной пары азота,
этилендиамин NH2-CH2-CH2-NH2
(En)
характеризуется наличием двух донорных
атомов азота и может образовывать
две связи с центральным ионом
комплексообразователем:
Количественный
состав внутренней сферы комплекса
определяется величиной координационного
числа
центрального атома (иона) – числом
координированных лигандов.
Так, в K[Ag(CN)2],
Na2[CO3],
[NH4]Cl,
Ni(CO)4,
PF5,
[Co(H2O)6]Cl3
- координационные числа Ag+,
C4+,
N3-,
Ni,
P5+,
Co3+
составляют: 2, 3, 4, 5 и 6. Количество
связей, которые образует один лиганд с
комплексообразователем, называется
дентатностью
лиганда.
Каждый из лигандов в рассмотренных выше
комплексах занимает одно координационное
место. Такие лиганды называются
монодентатными.
В тоже время, один лиганд может занимать
несколько координационных мест
во внутренней сфере комплекса в
результате образования нескольких
донорно-акцепторных связей с
координационным центром. Например,
в отличие от молекулы аммиака, способной
образовывать только одну
донорно-акцепторную связь с
участием неподеленной пары азота,
этилендиамин NH2-CH2-CH2-NH2
(En)
характеризуется наличием двух донорных
атомов азота и может образовывать
две связи с центральным ионом
комплексообразователем:
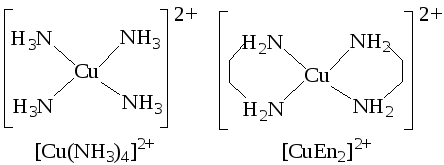
В результате этого каждая молекула этилендиамина занимает два координационных места во внутренней сфере комплекса. Такие лиганды, занимающие в координационной сфере центрального атома (иона) несколько координационных мест, называются полидентатными (би-, три-, тетра-, пента-, гексадентатными) лигандами. Наряду с органическими диаминами, бидентатными лигандами могут выступать и другие соединения с двумя донорными атомами:
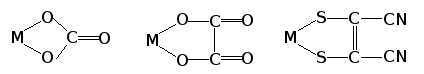
В настоящее время известны комплексы с разнообразными полидентатными лигандами, некоторые из которых представлены в табл. I-7. Полидентатные лиганды, строение которых приводит к образованию циклов при их комплексообразовании, называются хелатными5 лигандами, а соответствующие комплексы на их основе хелатными комплексами.
Таблица 9. Полидентатные хелатные лиганды.
|
|
Дентатность |
Графическая формула |
|
(DMG) |
2 |
|
|
Триаминопропан |
3 |
|
|
Триаминотриэтиламин |
4 |
|
|
Этилендиаминтетраацетат-ион (ЭДТА) |
6 |
|

Полидентатные лиганды своими разными донорными атомами часто образуют с координационным металлическим центром два типа связей – донорно-акцепторные и ковалентные. Это характерно, в частности, для аминокислот и других органических соединений, содержащих одновременно атом азота и гидроксидную группу. В этом случае бидентатный лиганд образует с центральным атомом одну ковалентную связь за счет неспаренного электрона атома кислорода, остающегося после отщепления атома водорода от гидроксидной группы, а другую донорно-акцепторную связь за счет неподеленной электронной пары атома азота. Примером такого взаимодействия может служить комплекс никеля (II) c двумя молекулами диметилглиоксима, в каждой из которых происходит отщепление атома водорода только от одной гидроксидной группы. Такого рода комплексные соединения называются внутрикомплексными. Они обладают высокой устойчивостью и часто характерной яркой окраской – например, NiDMG имеет ярко-красную окраску, что определяет широкое использование внутрикомплексных соединений в аналитической практике для определения многих металлов.
 Комплексные
соединения, содержа-щие только один
координационный центр, называются
моноядерными,
а несколько – полиядерными
комплексами.
Наряду с полиядерными комплексами,
объединение металлических
центров в которых обеспечивается
мостиковыми лигандами, существует
большой круг полиядерных комплексов,
характеризующихся
образованием прочных химических
связей непосредственно между
металлическими центрами. Такие
комплексные соединения называются
кластерными
комплексами.
Комплексные
соединения, содержа-щие только один
координационный центр, называются
моноядерными,
а несколько – полиядерными
комплексами.
Наряду с полиядерными комплексами,
объединение металлических
центров в которых обеспечивается
мостиковыми лигандами, существует
большой круг полиядерных комплексов,
характеризующихся
образованием прочных химических
связей непосредственно между
металлическими центрами. Такие
комплексные соединения называются
кластерными
комплексами.
В зависимости от заряда комплексы подразделяются на катионные ([Co(NH3)6]3+, [Сu(H2O)4]2+), нейтральные (Ni(CO)4, [Pt(NH3)2Cl2]), анионные ([FeCl6]3-, [Hg(CN)4]2-) и катионно-анионные ([Cr(NH3)6][Cr(CN)6], [CuEn2][Ag(CN)2]2), тогда как по природе лигандов – на смешанно-лигандные комплексы ([Cu(NH3)(H2O)Cl(NO2]) и комплексы с однородным лигандным окружением центрального атома.
Среди наиболее часто встречающихся в химической практике комплексов с однородным лигандным окружением можно выделить:
-аммиачные и аминные, содержащие во внутренней сфере молекулы аммиака и органических аминов: [Cu(NH3)4](NO3)2, [Ni(En)2]Br2;
-аква-, гидроксо- и оксокомплексы, в качестве лигандов у которых выступают молекулы воды и продукты их кислотной диссоциации – гидроксидные ОН- и оксидные О2--ионы:
[Zn(H2O)4]2+ [Zn(OH)4]2- + 4H+
[Zn(OH)4]2- [ZnO2]2- + 2H2O;
-ацидокомплексы, содержащие во внутренней сфере разнообразные кислотные остатки: [NiCl4]2-, [HgBr4]2-, [TiF6]2-, [Co(NO2)6]3-, [Pd(CN)4]2-, [Fe(NCS)6]2-.
Изомерия в комплексных соединениях. Сложное многокомпонентное строение комплексных соединений приводит к существованию различных изомерных соединений с одинаковой простейшей эмпирической формулой, но разным строением и свойствами. Среди характерных для комплексов типов изомерии можно отметить:
координационную изомерию - различное распределение лигандов между двумя комплексообразователями в катионно-анионных комплексах:
[Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6];
координационную полимерию – комплексные соединения одного эмпирического состава, но разной молекулярной массы:
[Pt(NH3)4][PtCl4] и [Pt(NH3)4][Pt(NH3)Cl3]2;
ионизационную изомерию (ионизационную метамерию) – комплексы с различным распределением лигандов между внутренней и внешней сферой:
[Co(NH3)5SO4]Cl и [Co(NH3)5Cl]SO4;
гидратную изомерию, которая является частным случаем ионизационной изомерии и связана с различным распределением молекул воды между внутренней и внешней сферой: [Cr(H2O)6]Cl3, [Cr(H2O)5Cl]Cl2H2O, [Cr(H2O)4Cl2]Cl2H2O, [Cr(H2O)3Cl3]3H2O;
связевую изомерию – координация амбидентатных лигандов к координационному центру различными донорными атомами:
Na2[Pt(NO2)6] и Na2[Pt(NO2)5(ONO)];
изомерию лигандов (конформационную изомерию) – наличие в составе комплексов изомеров многоатомных лигандов. Например, органический диамин общей формулы C3H6(NH2)2 может существовать в виде 1,2-диаминопропана (pn) и 1,3-диаминопропана (tn). Это приводит к образованию на их основе изомерных комплексов:
[Cu(pn)2]Cl2 и [Cu(tn)2]Cl2;
геометрическую изомерию – различное пространственное расположение лигандов во внутренней сфере комплексов. Наиболее часто встречающимся типом этой изомерии является цис-транс изомерия в комплексах с октаэдрическим и плоскоквадратным строением:
оптическую изомерию – существование комплексов в двух зеркально-симметричных пространственных формах, называемых энантиомерами, которые обладают различной оптической активностью – вращают плоскость поляризации света в противоположных направлениях:
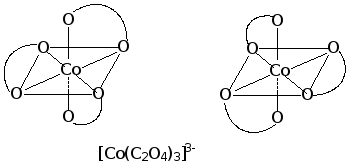
У![]() пражнения:
пражнения:
66. Определите координационный центр, его заряд и координационное число, а также лиганды и их заряд в следующих соединениях: SF6, SO2Cl2, [SO4]2-, [CrO4]2-, [ZnO2]2-, [Mn(H2O)6]2+, [NiCl4]2- Ni(CO)4, [Ni(CN)4]2-, [Co(NH3)6]3+, [Al(OH)6]3-.
67. Чем отличается характер химической связи во внутренней и внешней сфере координационного соединения? Определите внутреннюю и внешнюю сферу и их заряды в следующих соединениях: Na2SO4, K2Cr2O7, Ba2[Fe(CN)6], Rb[B(OH)4], H3PO4, [UO2]Cl2, [Co(NH3)5Cl]Cl2, NH4NO3, [Cr(H2O)6][Cr(CN)6].
68. Что такое дентатность лиганда? Определите дентатность лигандов в следующих комплексных соединениях кобальта (III): Na[Co(NH3)4(CO3)2], [Co(NH3)4CO3]ClO4, Na[CoEn2(CO3)2], Na[Co(ЭДТА)], Na[Co(ЭДТА)Сl2].
69. Какие комплексы называются: моноядерными, полиядерными, хелатными, внутрикомплексными? Приведите примеры.
7 0.*
Какой из гетероциклических дииминов
– 2,2’-бипиридил (2,2’-bpy)
или 4,4’-бипиридил (4,4’-bpy)
может выступать в качестве
мостикового лиганда и в
качестве хелатирующего
лиганда?
0.*
Какой из гетероциклических дииминов
– 2,2’-бипиридил (2,2’-bpy)
или 4,4’-бипиридил (4,4’-bpy)
может выступать в качестве
мостикового лиганда и в
качестве хелатирующего
лиганда?
71. К какому типу комплексов (моно- или полиядерных; катионных, анионных, нейтральных или катионно-анионных; смешанно-лигандных или аква-, гидроксо-, оксо-, ацидокомплексов, аммиакатов, аминатов) относятся следующие соединения: NaPF6, SO3, Na2S2O7, H2CrO4, UO2(NO3)2, K4[Fe(CN)6], (K2[ZnO2], Ba[Al(OH)4]2, NH4Cl, [Mn(H2O)6]SO4, [Cr(H2O)3Cl3], Li2[NiCl4], Ni(CO)4, Na2[Ni(CN)4], [Co(NH3)4CO3]2(SO4), [Pt(NH3)4][PdCl4].
72. Приведите по 2 примера различных типов изомерных комплексов: геометрических, связевых, гидратных, ионизационных, координационных.
Номенклатура комплексных соединений.
Систематическая номенклатура комплексных соединений определяет правила записи формул и названий комплексных соединений.
При написании формулы комплекса с однородным составом внутренней сферы вначале записывается центральный атом, а затем лиганды с указанием нижним числовым индексом их количества; всю внутреннюю сферу заключают в квадратные скобки и в зависимости от того является ли комплекс катионом или анионом слева или справа от комплекса помещают внешнесферный ион: Na[FeCl4], Ba3[Co(CN)6]2, [Cu(NH3)4]SO4, [Zn(H2O)4](NO3)2. Для нейтральных комплексов, а также распространенных солей и кислот допускается запись их формул без квадратных скобок: Fe(CO)5, K2SO3, UO2(NO3)2.
Для смешанно-лигандного комплекса, содержащего лиганды с различным зарядом (L+, L, L-), в формуле комплекса их располагают в следующем порядке: [M(L+)(L)(L-)] – например, формула смешанно-лигандного комплекса железа (III) c NO+, NH3 и Cl- в качестве лигандов имеет вид [Fe(NO)(NH3)4Cl]SO4.
Лиганды, одинаковые по типу заряда, но разные по химическому составу, записывают справа налево в порядке увеличения относительной электроотрицательности их первых (слева) элементов независимо от сложности лигандов. Так, среди нейтральных лигандов H2О и NH3 первым (слева) во внутренней сфере комплекса рекомендуется записывать воду: [Co(H2O)4(NH3)2]Cl3; среди отрицательных лигандов C2O42- и ОН- оксалатный лиганд рекомендуется записывать левее чем гидроксидный: Na3[Fe(C2O4)(OH)4]. Если разные лиганды имеет совпадающий первый элемент в их формуле, то порядок их расположения во внутренней сфере комплекса определяется увеличением числа разных элементов в составе лиганда – вначале рекомендуется записывать одноэлементный лиганд, затем двух-, трех и т.д. – например: [Ru(N2)(NH3)4(NH2OH)2]2+.
При сокращенном буквенном обозначении лигандов (этилендиамин – En, диметилглиоксим – DMG и др.) порядок их записи в формуле комплекса определяется теми же правилами, что и при использовании их химических формул.
Во избежание разночтений разные лиганды, входящие в состав смешанно-лигандных комплексов, отделяются друг от друга круглыми скобками. Для лигандов, которые при одинаковом составе могут иметь различный заряд, – например: NO+, NO, NO- или O22-, O2-, в формуле комплекса допускается указание их заряда с помощью правого верхнего индекса у обозначения лиганда: [Pd{P(C6H5)}2(O20)], [Co(CN)5(O2-)]4-.
Если в формуле комплексного соединения степень окисления центрального атома не очевидна, то она может быть указана в формуле комплекса с помощью правого верхнего индекса у символа центрального атома римскими цифрами: [СoIII(NH3)6][CrIII(CN)6].
Название комплексного соединения также состоит из названий лигандов и центрального атома внутренней сферы и названия внешнесферного катиона или аниона.
Лиганды.
- название отрицательно заряженных лигандов образуется из полного названия ионов с добавлением соединительной гласной –о: Br- бромо-, О2- оксо-, О2- надпероксо-, О22- пероксо-, Н- гидридо-, N3- нитридо-, S22- дисульфидо(-2)-, OH- гидроксо-, CN- циано-, NH2- амидо-, NH2- имидо-, NCS- тиоцианато- СО32- карбонато-, P2O74- дифосфато-, НSO3- гидросульфато-, S2O32- тиосульфато- TeO66- ортотеллурато-, ClO- гипохлорито-. IO56- ортопериодато-. Аналогично строятся названия лигандов органических кислот: HCOO- формиато-, C2O42- оксалато-, HON=C(CH3)C(CH3)=NO- диметиглиоксимато-, СH3COO- ацетато-, NH2CH2COO- глицинато-, {OOCCH2)2NCH2CH2N(CH2COO)2}4- этилендиаминтетраацетато-. По традиции лиганд S2- называют тио-. Анионы углеводородов в качестве лигандов называют без соединительно гласной -о: CH3- метил, С6Н5- фенил, С5Н5- циклопентадиенил.
- если в качестве лигандов выступаю положительно заряженные частицы, то в их названиях либо сохраняется окончание –ий, либо его добавляют: N2H5+ -гидразиний, NO+ нитрозилий. Катион H+ по традиции называют гидро-.
- название нейтральных лигандов в составе внутренней сферы комплекса остается неизменным: N2 диазот, O2 дикислород, SO2 диоксид серы, N2H4 гидразин, P(C6H5) трифенилфосфин. По традиции для ряда лигандов используют специальные названия: H2O - аква, NH3 - аммин, СО - карбонил, CS - тиокарбонил, NO - нитрозил.
Число одинаковых лигандов во внутренней сфере комплекса указывается приставками: ди-, три-, тетра- и т.д., которые записывают слитно с названием лиганда: (Н2О)4 тетрааква-, Br3 трибромо-, (SO4)2 дисульфато-, (NH3)5 пентааммин. Если в названии самого сложного лиганда уже используется числовая приставка, например О2 – дикислород, NH2CH2CH2NH2 – этилендиамин, то для указания числа таких лигандов во внутренней сфере применяют умножающие приставки: 2 – бис, 3 – трис, 4 – тетракис и т.д., а название самого лиганда заключают в скобки: (N2)2 – бис(диазот), (P(C6H5)3)3 – трис(трифенилфосфин). Название лиганда также заключается в скобки, если в его названии используются цифры или символы химических элементов: (C6H5N)2 – (2,2’-бипиридил), (NCS)- - (тиоцианато-N). Название лиганда заключается также в скобки, если образующееся при названии внутренней сферы словосочетание может првести к неоднозначности в природе лиганда: (N)2 ди(азот), что указывает на присутствие во внутренней сфере двух атомов азота, в отличие от (N2) – диазот для одной молекулы азота. Рекомендуется также выделять круглыми скобками названия лигандов с характеристичными приставками – пер-, тио-, гидро-, орто-, мета-, и названия сложных органических лигандов.
Центральный атом (ион). Систематическое название центрального атома, указываемое после названия лигандов, зависит от заряда комплекса:
для нейтральных комплексов применяют русское название элемента комплексообразователя в именительном падеже:
[Co(NH3)3Cl3] - трихлоротриамминкобальт,
[Cr(H2O)3(C2O4)Cl] - хлорооксалатотриаквахром,
[Fe(NH3)2(NCS)4] - тетра(тиоцианато-N)диамминжелезо,
[MnH(CO)5] - пентакарбонилгидромарганец,
SO2Cl2 - дихлородиоксосера;
для катионных комплексов русское название элемента комплексообразователя дается в родительном падеже с указанием римскими цифрами в круглых скобках его степени окисления:
[Ag(NH3)2]+ диамминсеребра(I),
[Ru(NH3)5(N2)]2+ (диазот)пентаамминрутения(II),
[UO2]2+ диоксоурана(VI).
Для элементов с постоянной степенью окисления допускается применение названий элементов без указания на его степень окисления: [Al(H2O)5(OH)]2+ гидроксопентаакваалюминия;
название элемента комплексообразователя в анионных комплексах образуется из латинского корня названия элемента с добавлением окончания –ат и указанием римскими цифрами в круглых скобках его степени окисления: [Fe(CN)6]4- - гексацианоферрат(II),
[HgI4]2- - тетраиодомеркурат(II),
[Pt(NO2)4Cl2]2- - дихлоротетранитроплатинат(IV).
Для элементов с постоянной степенью окисления допускается название элемента без указания его степени окисления:
[Zn(OH)4]2- - тетрагидроксоцинкат,
[HF2]- - дифторогидрогенат.
Полное название соединений с комплексным катионом или анионом включает также традиционное название внешнесферных ионов: [Ir(NH3)4(NCS)2]ClO4 - перхлорат ди(тиоцанато-S)тетраамминирридия(III), (NH4)3[Pt(NH3)(NO2)5] - пентанитроамминплатинат(IV) аммония,
H[AuCl4] - тетрахлороаурат водорода,
(KAl)[Fe(CN)6] - гексацианоферрат(II) алюминия-калия,
[Co(NH3)6](SO4)(HSO4) - гидросульфат-сульфат гексаамминкобальта(III). Полное название комплексов катион-анионного типа состит из систематического названия комплексного аниона и комлексного аниона: [Pt(NH3)4][PtCl4] - тетрахлороплатинат(II) тетраамминплатины(II), [Co(NH3)5Cl]3[Cr(CN)6]2 - гексацианохромат(III) хлоропентаамминкобальта(III).
Для различия геомерических цис-транс изомеров в формулах и названнях комплексов используют соответствующие цис- и транс- приставки: транс-[Pd(NH3)2Cl2] транс-дихлородиамминпалладий, транс-[CoEn2(CN)2]Cl хлорид транс-дицианобис(этилендиамин)кобальта(III), цис-Na3[Cr(OH)4Cl2] цис-дихлоротетрагидроксохромат(III) натрия.
Упражнения:
7![]() 3.Приведите
названия лигандов в составе внутренней
сферы комплексов:H-,
Cl-,
S2-,
OH-,
CN-,
N3-,
NCS-,
NO2-,
SO42-,
H2O,
NH3,
CO,
NO,
N2,
PPh3
(Ph
= C6H5),
H2NC2H4NH2
(En),
[(OOCCH3)2NCH2CH2N(CH3COO)2]4-
(Edta).
3.Приведите
названия лигандов в составе внутренней
сферы комплексов:H-,
Cl-,
S2-,
OH-,
CN-,
N3-,
NCS-,
NO2-,
SO42-,
H2O,
NH3,
CO,
NO,
N2,
PPh3
(Ph
= C6H5),
H2NC2H4NH2
(En),
[(OOCCH3)2NCH2CH2N(CH3COO)2]4-
(Edta).
74. Напишите названия следующих нейтральных комплексов: триаммин-тригидроксокобальт, дигидразиндибромоиодоцианоплатина, тритио-цианатотриаквахром, дигидроксиламиндихлоропалладий, триаква-тринитрородий.
75. Приведите систематические названия следующих моноядерных соединений: K2MnO4, H2SO4, Na[B(OH)4], Ca[Fe(CN)6], (NH4)2[HgI4], H[AuCl4], Al[Cr(NCS)6], Na[PtCl(OH)5], [Ag(NH3)2]Cl, [CuEn2](NO3)2, [Zn(H2O)4]ClO4, [Rh(NH3)4CO3]NO3, [Co(NH3)5NO2]Cl2, [Co(N2)3(N2H4)2]Br3, [Pt(NH3)2ClBr], [Cr(H2O)3С2O4I], Ni(CO)4, K2[PdCl4], [Pt(PPh3)4], [Co(NH3)6][Co(CN)3(SCN)3], [PdII(NH2OH)4][PtIV(I)3(CN)3].
76. Напишите формулы следующих соединений: гексафторофосфат(V) натрия, тетраоксоманганат(VI) калия, тетрагидроксоцинкат магния, тринитродихлороакваирридат(III) калия, тетраиододиамминплатина, роданодицианотриаквакобальт, сульфитодиамминпалладий, нитрат транс-бисэтилендиаминдихлорокобальта(III), гексафторохромат(III) гексааквахрома(III), тетрацианоплатинат(II) тетраамминпалладия(II).
Соединения постоянного и переменного состава (дальтониды и бертоллиды)* - раздел для углубленного изучения.
О писание
химических соединений с помощью
молекулярных формул, отражающих
целочисленные количественные соотношения
между атомами химических
элементов в соединениях независимо от
метода их получения, основано
на законе постоянства состава,
являющегося одним из важнейших
стехиометрических законов
в рамках атомно-молекулярного
учения. Соединениями постоянного
состава, которые называютсястехиометрическими6
или
дальтонидами,
являются вещества молекулярного
строения, поскольку состав молекул
однозначно определяется
строением образующих их
атомов.
писание
химических соединений с помощью
молекулярных формул, отражающих
целочисленные количественные соотношения
между атомами химических
элементов в соединениях независимо от
метода их получения, основано
на законе постоянства состава,
являющегося одним из важнейших
стехиометрических законов
в рамках атомно-молекулярного
учения. Соединениями постоянного
состава, которые называютсястехиометрическими6
или
дальтонидами,
являются вещества молекулярного
строения, поскольку состав молекул
однозначно определяется
строением образующих их
атомов.
В начале XX века было установлено, что в кристаллическом состоянии многие вещества характеризуются переменным составом, зависящим от условий их образования. Такие соединения называются нестехиометрическими или бертоллидами. В отличие от дальтонидов, бертоллиды в кристаллическом состоянии характеризуются не молекулярными, а атомными или ионными кристаллическими решетками, в структуре которых в зависимости от условий их образования возможно образование дефектов двух типов. Так, в отличие от идеальной кристаллической решетки соединения АВ, атомы (ионы) А и В которого занимают строго фиксированные положения в узлах решетки, в реальных кристаллах некоторые узлы решетки могут быть не заняты, тогда как в междоузлиях могут располагаться избыточные частицы А и (или) В. Это приводит к тому, что по сравнению с идеальным составом АВ реальные образцы кристаллического соединения взависимости от метода их получения, будут иметь переменный состав А1xB1y. Например, в зависимости от метода получения, состав оксида титана (II) изменяется от Ti0,7O до TiO1,3.
Следует отметить, что среди неорганических соединений почти 95% не имеют молекулярного строения и, следовательно, являются нестехиометрическими соединениями. Однако для большинства соединений непереходных элементов отклонения от стехиометрического состава крайне незначительны и ими можно пренебречь. В то же время, оксиды, сульфиды, нитриды, карбиды, гидриды переходных металлов образуют типично нестехиометрические соединения. Более того, в ряде случаев их соединения, состав которых соответствует молекулярной формуле (например - FeO), - неустойчивы и могут быть получены только в особых условиях.
В зависимости от того, какую информацию требуется отобразить в формулах бертоллидов, применяют различные обозначения. Общим обозначением бертоллида является математический знак «» (приблизительно), который ставят перед молекулярной формулой: FeO, TiO, FeS, Cu2O. Для более полного обозначения в формулу вводят переменный коэффициент «х»: Fe1-xS, TiO1+x. Если хотят показать, что отклонение от стехиометрического состава невелико, то вместо «х» применяют «»: NaCl1- Для бертоллидов известного состава указывают численное значение «х»: Fe1-0,123S или Fe0,877S. Пределы возможного изменения количественного состава указывают после формулы в круглых скобках: PbS1+ (0 ≤ ≥ 0,005), TiO1+x (-0,23 ≤ x ≥ 0,3).
Для отражения нестехиометричности к названию соединения с молекулярным составом в скобках добавляют указание на нестехиометричность: Fe1-xS сульфид железа(II) (недостаток железа), MnO1+x оксид марганца(II) (избыток кислорода).
Аддукты* - раздел для углубленного изучения.
 Если химическая
связь между составными частями соединения
относится к различным типам
сильного или слабого межмолекулярного
взаимодействия или природа
этой связи выяснена недостаточно, то
она формулах обозначается «точкой»
(8Ar46H2O)
и такие соединения называют аддуктами.
При
донорно-акцепторном характере
межмолекулярного взаимодействия
«точку» заменяют «стрелкой»,
направленной от донора к
акцептору – например: H3NBF3.
Водородная связь между составными
частями аддукта изображается
тремя точками “…” между символами
элементов: HFHF,
H2OH2O,
H2ONH3.
Если химическая
связь между составными частями соединения
относится к различным типам
сильного или слабого межмолекулярного
взаимодействия или природа
этой связи выяснена недостаточно, то
она формулах обозначается «точкой»
(8Ar46H2O)
и такие соединения называют аддуктами.
При
донорно-акцепторном характере
межмолекулярного взаимодействия
«точку» заменяют «стрелкой»,
направленной от донора к
акцептору – например: H3NBF3.
Водородная связь между составными
частями аддукта изображается
тремя точками “…” между символами
элементов: HFHF,
H2OH2O,
H2ONH3.
Названия аддуктов. Продукты присоединения воды к простым и сложным веществам носят групповое название гидраты. Количество молекул воды указывается числовыми приставками – ди-, три-, тетра-, поли-: Ca(NO3)24H2O тетрагидрат нитрата кальция, Cl26H2O гексагидрат хлора. Если состав гидрата более сложен, то названия также начинаются со слова гидрат, затем называют другую составную часть, а в конце указывают в круглых скобках арабскими цифрами в виде дроби стехиометрическое соотношение составных частей: 3CdSO48H2O гидрат сульфата кадмия (8/3).
Названия других аддуктов на основе сольватов образуют из названий составных частей в именительном падеже, которые разделяют тире; стехиометрическое отношение указывается арабскими цифрами в виде дроби в круглых скобках причем, первая цифра отвечает первой составной части: 2Na2CO33H2O2 карбонат натрия – пероксид водорода (2/3), 10PCl329Br2 хлорид фосфора (III) – дибром (10/29), I3NnNH3 нитрид иода (I) – аммиак (1/n).
Важными представителями аддуктов являются соединения включения, которые называют также клатратами. К клатратам, например, относятся гидраты газов, которые образуются за счет включения в междоузельные пространства кристалла льда (хозяин) различных молекул газов (гость): Cl2, CH4, H2S, SO2, Ar, Xe и др. В одной из модификаций льда на 46 молекул воды приходится 6 свободных полостей. В результате этого состав таких клатратов приблизительно отвечает формуле 6X46H2O. Известны клатраты, полости хозяев, которых образованы кристаллическими решетками и других веществ с водородными связями – например: гидрохинон, фенол, толуол. Названия клатратов образуются подобно другим аддуктам: 6Xe46H2O ксенон-вода (6/46).

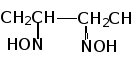 Название
Название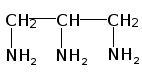 Диметилглиоксим
Диметилглиоксим