
testy_po_neorganike_dlya_studentov_TM_TP
.doc
17. Молекула аммиака имеет форму...
[1] тетраэдра;
[2] пирамиды;
[3] плоской молекулы; ,|
[4] куба.
|
18. Полярные молекулы аммиака...
[1] практически не растворимы в воде;
[2] очень хорошо растворимы в воде;
[3] в жидком аммиаке связаны ионными связями;
[4] в водном растворе практически мгновенно диссоциируют на ионы N+3 и Н+1.
19. В отличие от аммиака фосфин...
[1] практически не растворяется в воде;
[2] не образует гидроксида фосфония;
[3] является газообразным веществом;
[4] проявляет свойства восстановителя.
20. Валентность азота равна его степени окисления в молекуле...
[1] азота;
[2] оксида азота (II);
[3] азотной кислоты;
[4] аммиака.
21. Валентный угол HNH в ионе аммония NH4+ составляет...
[1] 109°28';
[2] 90°;
[3] 120°;
[4] 104°30'.
22. Пентахлорид фосфора широко используется как хлорирующий агент в органической химии. Так, например, ацетон реагируете пентахлоридом фосфора в безводной среде, образуя при этом:
[1] 1,3-дихлорпропан;
[2] 2,2-дихлорпропан;
[3] 2-хлорпропановую кислоту;
[4] 1-хлорпропан.
23. При взаимодействии некоторого металла массой 2,64 г с азотом образовался нитрид массой 2,92 г. Определите формулу нитрида.
[1] AlN;
[2] Li3N;
[3] Sr3N2;
[4] Na3N.
24. При взаимодействии некоторого металла массой 4,11 г с фосфором образовался фосфид массой 4,73 г. Определите формулу фосфида.
[1] АlР;
[2] К3Р;
[3] Mg3P2;
[4] Ва3Р2.
25. При обработке водой смеси нитрида и фосфида щелочноземельного металла с равными массовыми долями образовалась газовая смесь с плотностью по криптону 0,2998. Установите, какой металл входил в состав соединений.
[l] Mg;
[2] Са;
[3] Sr;
[4] Ва.
26. Валентность и степень окисления азота в азотной кислоте соответственно равны:
[1] V и +5;
[2] IV и +5;
[3] V и +4;
[4] III и -3.
27. Валентность и степень окисления азота в ионе аммония соответственно равны:
[1] III и +5;
[2] V и -4;
[3] IV и -3;
[4] III и -5.
28. Оксид азота (III) при обычных условиях — синяя жидкость, являющаяся...
[1] несолеобразующим оксидом;
[2] ангидридом азотной кислоты;
[3] амфотерным оксидом;
[4] ангидридом азотистой кислоты.
29. Оксид фосфора (III) (истинная формула Р4О6) — это...
[1] ангидрид фосфористой кислоты;
[2] ангидрид фосфорноватистой кислоты;
[3] ангидрид ортофосфорной кислоты;
[4] несолеобразующий оксид.
30. Оксид фосфора (V) (простейшая формула Р2О5, истинная формула Р4О10) — это...
[1] ангидрид метафосфорной кислоты;
[2] ангидрид ортофосфорной кислоты;
[3] ангидрид пирофосфорной кислоты;
[4] ангидрид фосфорноватистой кислоты.
31. При взаимодействии Р4О6 с водой образуется...
[1] ортофосфорная кислота;
[2] пирофосфорная кислота;
[3] фосфорноватистая кислота;
[4] фосфористая кислота.
32. Структурная формула фосфористой кислоты
[ 1]
О
1]
О

 Н----О----Р
Н----О----Р

О;
[2]
 Н----О
Н----О

 Н----О----Р----О
Н----О----Р----О
Н----О;
[3]

 Н----О О
Н----О О

 Р
Р
Н----О Н
[4].

 О
О
 Н----О----Р----Н
Н----О----Р----Н
Н
33. Среди перечисленных ниже кислот назовите одноосновную кислоту:
[1] Н3РO3;
[2] Н3РO2;
[3] Н3РO4;
[4] таковой среди перечисленных кислот нет.
34. Для азотной кислоты характерны реакции...
[1] восстановления;
[2] диспропорционирования;
[3] нейтрализации;
[4] окисления.
35. При взаимодействии концентрированной азотной кислоты с цинком в качестве газообразного продукта получен...
[1] кислород;
[2] водород;
[3] оксид азота (IV);
[4] аммиак.
36. При взаимодействии разбавленной азотной кислоты с медью в качестве газообразного продукта получен...
[1] водород;
[2] оксид азота (IV);
[3] оксид азота (II);
[4] медь не реагирует с азотной кислотой, поскольку находится в ряду активности металлов правее водорода.
37. Какой металл не реагирует с охлажденной концентрированной азотной кислотой?
[1] Сu;
[2] Fe;
[3] Ag;
[4] А1.
38. Царской водкой называют водную смесь, содержащую...
[1] азотную кислоту и хлороводород в мольном соотношении 1:3;
[2] азотную кислоту и хлороводород в мольном соотношении 3:1;
[3] азотную кислоту и перманганат калия в мольном соотношении 1:1;
[4] азотную кислоту и дихромат калия в объемном соотношении 2:1.
39. При прокаливании большинства твердых нитратов выделяется...
[1] азот;
[2] оксид азота (IV);
[3] кислород;
[4] оксид азота (I).
40. Все нитраты щелочных металлов (кроме лития) при прокаливании разлагаются в соответствии с уравнением:
[1] 2MeNO3 = 2Ме + 2NO2↑ + O2↑;
[2] 2MeNO3 = 2Ме + N2↑ + 3O2↑;
[3] 2MeNO3 = Ме2O + N2O↑ + 2O2↑;
[4] 2MeNO3 = 2MeNO2 + O2↑.
41. Большинство нитратов двухвалентных металлов при прокаливании разлагаются по уравнению:
[1] 2M(N03)2 = 2МО + 4NO2↑+ O2↑;
[2] M(N03)2 = М + 2NO2↑ + O2↑;
[3] 2M(N03)2 = 2МО + N2↑ + 5O2↑;
[4] M(N03)2 - M(NO2)2 + O2↑.
42. Какое из веществ называется гидрофосфитом калия?
[1]К2НРO4;
[2] КН2РO3;
[3]К2НРO3;
[4] КН2РO2.
43. Какие нитраты называют селитрами?
[1] Ca(NO3)2; Cu(NO3)2; AgNO3;
[2] Fe(NO3)2; Fe(NO3)3; Al(NO3)3;
[3] Ba(NO3)2; Mg(NO3)2; Zn(NO3)2;
[4] NaNO3; KNO3; NH4NO3.
44. Какие два вещества вступили в реакцию, если в результате образовались НРO3 и N2PO5:
[1]Р2O3 + HNO3;
[2] Р2O5 + HNO3;
[3]Р + HNO3;
[4] Н3РO4 + N2O.
45. Какие два вещества вступили в реакцию, если в результате образовались MgSО4 + (NH4)2SO4?
[1] Mg + NH4HSO4;
[2] MgS04 + NH4OH;
[3] Mg3N2 + H2SO4;
[4] [MgOH]2SO4 + NH4HSO4.
46. Среди перечисленных минеральных удобрений укажите преципитат:
[1] Са(Н2РO4)2;
[2] (NH4)2HPO4;
[3] NH4NO3;
[4] CaHPO4 2Н2O.
47.112 л аммиака путем ряда последовательных превращений превратили в азотную кислоту. Какой объем оксида азота (IV) выделился при реакции полученной кислоты с избытком меди?
[1] 112 л;
[2] 224 л;
[3] 56 л;
[4] при взаимодействии HNO3 с медью всегда выделяется водород.
ПОДГРУППА УГЛЕРОДА И КРЕМНИЯ
1. После кислорода самый распространенный элемент в земной коре —...
[1] кремний;
[2] углерод;
[3] свинец;
[4] железо.
2. Среди перечисленных ниже веществ к аллотропным модификациям углерода относятся...
[1] фуллерен;
[2] озон;
[3] кварц;
[4] алмаз.
3. В отличие от углерода кремний...
[1] в свободном состоянии не встречается;
[2] имеет аллотропные модификации;
[3] является твердым веществом;
[4] проявляет типичные восстановительные свойства.
4. Приведите уравнения радиоактивного распада, на которых основан метод определения «возраста» предметов органического происхождения (так называемый «метод геохронологии»).
[1]
![]() ;
;
[2]
![]() ;
;
[3]
![]() ;
;
[4]
![]() .
.
5. В вашем распоряжении оказались порошкообразные графит и фуллерен. Можно ли как-то различить эти аллотропы?
[1] графит — порошок черно-серого цвета; фуллерен — порошок золотисто-желтого цвета;
[2] графит сгорает в атмосфере кислорода, фуллерен нет;
[3] фуллерены в отличие от всех других аллотропов углерода растворяются в бензоле, давая при этом растворы красно-фиолетовой окраски;
[4] графит и фуллерен практически невозможно различить.
6. Алмаз — это...
[1] аморфное вещество коричневого цвета;
[2] самое твердое из известных веществ;
[3] один из лучших проводников электрического тока;
[4] ангидрид угольной кислоты.
7. В карбине и графите атомы углерода находятся соответственно в состоянии...
[1] sp-гибридизации и sр2-гибридизации;
[2] sр2-гибридизации и sp-гибридизации;
[3] sр3-гибридизации и sр3-гибридизации;
[4] sр2-гибридизации и sр3-гибридизации.
8. В зависимости от условий кремний может быть получен восстановлением его соединений в одной из двух аллотропных модификаций, называемых...
[1] кремнием кубическим и гексагональным;
[2] кварцем и кремнеземом;
[3] кремнием кристаллическим и аморфным;
[4] тридимитом и кристобалитом.
9. Графит и кремний — типичные...
[1] окислители;
[2] восстановители;
[3] металлы;
[4] полудрагоценные камни.
10. Соединения: а) углерода, б) кремния с металлами называют...
[1] а) карбонатами; б) силикатами;
[2] а) карборундами; б) кремнеземами;
[3] а) карбинами; б) силанами;
[4] а) карбидами; б) силицидами.
11. При взаимодействии углерода с концентрированной серной кислотой выделилось 13,44 л газов (н. у.). Рассчитайте массу углерода, вступившего в реакцию.
[1]1,0г;
[2] 2,0 г;
[3] 2,4 г;
[4] 3,6 г.
12. Для полного растворения кремния можно использовать...
[1] концентрированную плавиковую кислоту;
[2] концентрированную серную кислоту;
[3] царскую водку;
[4]смесь концентрированных азотной и плавиковой кислот, в которой молярное соотношение HN03 : HF = 1 : 3.
13. Оксид углерода (II) — это...
[1] ядовитый газ без цвета и запаха;
[2] газ с запахом чеснока;
[3] твердое вещество белого цвета;
[4] легкокипящая жидкость.
14. Оксид углерода (II) формально можно считать...
[1] несолеобразующим оксидом;
[2] амфотерным оксидом;
[3] ангидридом муравьиной кислоты;
[4] ангидридом угольной кислоты.
15. В присутствии катализатора или при облучении СО окисляется хлором, образуя...
[1] тетрахлорид углерода и озон; ,
[2] ядовитый газ фосген;
[3] углекислый газ и четыреххлористый углерод;
[4] оксид углерода (II) невозможно окислить хлором.
16. При нагревании со многими металлами оксид углерода (II)образует летучие жидкости, называемые...
[1] карбенами;
[2] карбокатионами;
[3] карбоанионами;
[4] карбонилами.
17. При нагревании оксида углерода (II) с водородом при повышенном давлении идет обратимая реакция с образованием...
[1] водяного газа;'
[2] этилового спирта;
[3] метилового спирта;
[4] муравьиной кислоты.
18. Карбонилы металлов широко используют...
[1] для получения металлов высокой чистоты;
[2] в качестве катализаторов в органической химии; [3] в парфюмерной промышленности;
[4] для получения технических алмазов.
19. Какой газ тяжелее углекислого газа?
[1] воздух;
[2] угарный газ;
[3] пропан;
[4] озон.
20. Сколько граммов углекислого газа можно получить из 9 г карбина?
[1]33г;
[2] 44 г;
[3] 22,4 г;
[4] углекислый газ получают не из карбина, а из карбида кальция.
21. Массовая и мольная доли оксида углерода (IV) в его смеси с неизвестным газом равны. Какое это вещество?
[1] ангидрид сернистой кислоты;
[2] угарный газ;
[3] пропан;
[4] озон.
22. При обычных давлениях и комнатной температуре твердый оксид углерода (IV)...
[1] самопроизвольно воспламеняется на воздухе;
[2] самопроизвольно распадается на углерод и кислород;
[3] легко переходит в жидкое состояние;
[4] переходит в газообразное состояние, минуя жидкое.
23. Оксид углерода (IV) — это...
[1] амфотерный оксид;
[2] основный оксид;
[3] ангидрид уксусной кислоты;
[4] ангидрид угольной кислоты.
24. Угольная кислота в свободном виде...
[1] представляет собой летучую жидкость;
[2] представляет собой тяжелую, густую жидкость;
[3] не существует, так как она чрезвычайно неустойчива и легко разлагается;
[4] представляет собой газообразное вещество тяжелее воздуха.
25. Угольная кислота — двухосновная; она образует средние и кислые соли, называемые...
[1] карбидами и гидрокарбидами;
[2] карбонатами и гидрокарбонатами;
[3] карбонилами и гидрокарбонилами;
[4] карборундами и гидрокарборундами.
26. Качественная реакция на соли угольной кислоты —...
[1] действие сильных кислот;
[2] действие щелочей;
[3] взаимодействие с нитратом серебра;
[4] взаимодействие с озоном.
27. Из всех карбонатов в воде растворимы карбонаты...
[1] металлов, стоящих в ряду активности после водорода;
[2] металлов, стоящих в ряду активности до водорода;
[3] щелочных металлов и аммония;
[4] щелочно-земельных металлов.
28. Угольная кислота, так же как и кремниевая, относится типичным...
[1] восстановителям;
[2] сильным кислотам;
[3] окислителям;
[4] слабым кислотам.
29. Гидрокарбонаты щелочных металлов при нагревании..
[1] разлагаются на карбонаты, углекислый газ и воду.
[2] разлагаются на оксид щелочного металла, оксид , углерода (II) и воду;
[3] диспропорционируют;
[4] плавятся и переходят в жидкое состояние.
30. Из солей угольной кислоты наибольшее практическое значение имеет...
[1] глауберова соль;
[2] бертолетова соль;
[3] гидроксокарбонат меди (II);
[4] сода.
31. Соединение NaHCO3 называется...
[1] гидроксокарбонатом натрия;
[2] известняком;
[3] гидрокарбонатом натрия;
[4] питьевой содой.
32. Основные количества соды получают...
[1] по реакции 2NaOH + СO2 = Na2CO3 + Н2O;
[2] методом Сольвэ;
[3] используя каталитический процесс Габера;
[4] диспропорционированием известняка.
33. Поташ в отличие от соды...
[1] окрашивает пламя не в желтый, а в фиолетовый цвет;
[2] окрашивает пламя не в фиолетовый, а в желтый цвет;
[3] не может быть получен методом Сольвэ;
[4] не может быть получен взаимодействием щелочи
с углекислым газом.
34. В раствор гидроксида кальция опущены электроды, соединенные с источником тока. В цепь включена лампочка. Приведите график зависимости накала лампочки от объема углекислого газа, пропускаемого через раствор.
[1]



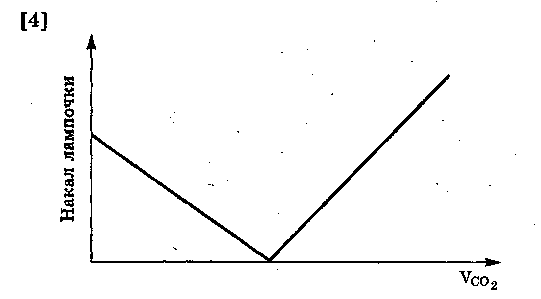
35. Зеленые растения под действием света поглощают углекислый газ. При этом происходит реакция:
[1] СO2
![]() С + O2;
С + O2;
[2] 6СO2
+ 6Н2O
![]() С6Н12O6
+ 6O2;
С6Н12O6
+ 6O2;
[3] СO2
+ С ![]() 2СО;
2СО;
[4] СO2
+ Н2O
![]() Н2СO3.
Н2СO3.
36. Оксид кремния (IV) — это...
[1] газообразное вещество без цвета и запаха;
[2] основный оксид;
[3] ангидрид кремниевой кислоты;
[4] твердое, очень тугоплавкое вещество.
37. Кремнезем растворяется в...
[1] соляной кислоте;
[2] царской водке;
[3] воде;
[4] плавиковой кислоте.
38 Силикаты получают сплавлением Si02 со щелочами или карбонатами. Какое количество силиката натрия образовалось при сплавлении гидроксида калия и оксида кремния (IV), если при этом выделилось 4,5 л водяных паров (измерено при 100 °С и 101,3 кПа)?
[1] 0,15 моль;
[2] 0,3 моль;
[3] 1 моль;
[4] 2 моль.
39. Концентрированные растворы силикатов натрия и калия называют...
[1] жидкими кристаллами;
[2] кристаллогидратами;
[3] жидким стеклом;
[4] жидким мылом.
40. Простейшее водородное соединение кремния называется...
[1] метан;
[2] боран;
[3] силан;
[4] алкан.
41. Щелочи реагируют с силаном по уравнению:
[1] SiH4 + 2KOH = SiO2 + 2KH + 2Н2↑;
[2] SiH4 + 2КОН + Н2O = K2SiO3 + 4H2↑;
[3] SiH4 + 4КОН = K4Si + 4H2↑ + 2O2↑;
[4] SiH4 + ЗКОН = K2SiO3 + КН + ЗН2↑.
42. Среди карбидов и силицидов особое место занимает карборунд SiC, который...
[1] имеет высокую температуру плавления;
[2] по твердости близок к твердости алмаза;
[3] химически чрезвычайно реакционноспособен;
[4] хорошо растворим в воде.
ЩЕЛОЧНЫЕ
И МЕЛОЧНО-ЗЕМЕЛЬНЫЕ МЕТАЛЛЫ
1. Все элементы главных подгрупп I и II групп Периодической системы, а также гелий относят к...
[1] типичным окислителям;
[2] типичным металлам;
[3] переходным элементам;
[4] s-элементам.
2. Все s-элементы, кроме водорода и гелия, являются... [1] газообразными веществами без цвета и запаха;
[2] жидкостями при комнатной температуре;
[3] металлами;
[4] полупроводниками.
3. Атомы а) щелочных, б) щелочно-земельных элементов имеют...
[1] а) только по одному электрону на внешней оболочке; б) только по два электрона на внешней оболочке;
[2] а) полностью заполненную внешнюю электронную оболочку; б) полностью заполненную внешнюю электронную оболочку;
[3] а) возможность терять единственный внешний электрон, образуя катионы с зарядом +1; б) возможность терять два внешних электрона, образуя катионы с зарядом +2;
[4] а) размеры, меньшие размеров атома водорода; б) размеры, большие размеров любого из щелочных металлов.
4. Франций, завершающий I группу, и радий, завершающий II группу, являются...
[1] очень твердыми;
[2] самыми распространенными в земной коре среди всех s-элементов;
[3] радиоактивными элементами;
[4] надежными изоляторами.
5. Литий, натрий и калий объединяет то обстоятельство, что...
[1] при внесении любого из этих металлов или их соединений в пламя, оно окрашивается в красный цвет;
[2] каждый из этих металлов легче воды;
[3] в свободном виде ни один из этих металлов не: реагирует с кислородом;
[4] каждый из этих металлов реагирует с азотом уже при комнатной температуре.
6. Назовите металл, который почти вдвое легче воды.
[1] литий;
[2] радий;
[3] натрий;
[4] стронций.
7. Кристаллическое строение металлов обусловливает их важнейшие свойства. Рентгеноструктурные исследования позволили установить три основных типа металлических структур: гексагональная плотная упаковка (ГПУ), гранецентрированная кубическая упаковка (ГКУ) и объемно-центрированная кубическая упаковка (ОЦКУ). Какие типы упаковок имеют: а) щелочные, б) щелочноземельные металлы?
[1] а) ОЦКУ; б) бериллий и магний — ГПУ, кальций и стронций — ГКУ, барий — ОЦКУ;
[2] а) ГПУ; б) ОЦКУ;
[3] а) литий — ОЦКУ, натрий, калий, рубидий и цезий — ГКУ; б) ГКУ;
[4] а) ГКУ; б) ГПУ.
8. Все s-металлы очень активны и поэтому...
[1] самовоспламеняются на воздухе;
[2] хранятся в воде;
[3] хранятся в керосине;
[4] способны взаимодействовать со всеми металлами, стоящими в ряду активности после водорода.
9. Поскольку внешние электроны s-металлов находятся далеко от ядра и легко переходят к другим элементам, все s-металлы являются...
