
- •Любая система стремится перейти в состояние равновесия, которое является наиболее устойчивым состоянием системы.
- •Любая система стремится к уменьшению свободной энергии и устойчивому состоянию, которому соответствует состояние с наименьшим значением свободной энергии.
- •А b с - последовательные реакции
- •А параллельне реакции
- •Основные положения теории катализа.
Основные положения теории катализа.
1) Катализ применим для изменения скорости только термодинамически возможных процессов (для каталитических реакций G<0).
2) Катализаторы изменяют механизм реакции, направляя её по пути с меньшей энергией активации, что и приводит к увеличению скорости процесса.
Например, реакция разложения перекиси водорода ускоряется в присутствии сульфата железа (II) в 105 раз, а под действием фермента каталазы – в 1010 раз, что связано с соответствующим уменьшением энергии активации процесса:
2H2O2 2H2O + O2 Еакт=75 кДж/моль
2H2O2 [Fe2+];(((( 2H2O + O2 Еакт=40 кДж/моль
2H2O2 [каталаза];(((( 2H2O + O2 Еакт = 7 кДж/моль
3) Катализатор не влияет на тепловой эффект процесса.
4) Катализатор не влияет на положение химического равновесия, так как в равной степени ускоряет прямую и обратную реакции, сокращая тем самым время достижения равновесия.
5) Катализаторы действуют селективно, т. е. ускоряют одни процессы и не влияют на протекание других.
Так, из этанола в зависимости от катализатора и условий проведения реакции можно получить до 40 разных продуктов, например:
C2H5OH [Al2O3];350-360 C;(((((( C2H4 + H2O
C2H5OH [Cu];200-250 C;((((((( CH3CHO + H2
В отсутствие катализатора обе реакции протекают параллельно.
зависимости от фазового состояния катализатора и реагентов различают гомогенный и гетерогенный катализ.
При гомогенном катализе катализатор и реагенты находятся в одной фазе.
При гетерогенном катализе катализатор образует отдельную фазу, на поверхности которой протекает каталитическая реакция.
Механизм гомогенного катализа основан на образовании катализатором и реагентами в той же фазе реакционноспособных промежуточных соединений. В результате каталитическая реакция протекает по новому механизму, который складывается из элементарных стадий с меньшими энергиями активации, чем некаталитическая реакция, например (см. рис.1):
в отсутствие катализатора
А В Еакт=Е1
в присутствии катализатора К
 А
[K];(( В
А
[K];(( В
 1
стадия А + К
АК Еакт=Е2
1
стадия А + К
АК Еакт=Е2
2 стадия АК В + К Еакт=Е3.
Примером гомогенной каталитической реакции может служить разложение ацетальдегида в присутствии паров иода:
без катализатора
CH3CHO(г) CH4(г) + CO(г) Еакт=190 кДж/моль
в присутствии катализатора
CH3CHO(г) [I2];(((CH4(г) + CO(г) Еакт= 136 кДж/моль

1 стадия CH3CHO + I2 CH3I + HI + CO
2 стадия CH3I + HI CH4 + I2
В качестве гомогенных катализаторов используют кислоты, основания, комплексные соединения переходных металлов. Примером гомогенного катализа является ферментативный катализ.
Механизм гетерогенного катализа более сложен и включает несколько последовательных стадий:
-
диффузия реагентов к поверхности катализатора;
-
активированная адсорбция реагентов на поверхности катализатора, в результате которой происходит сближение реакционных центров и повышение их активности под действием силового поля поверхностных атомов катализатора и, как следствие, понижение энергии активации;
-
химическое взаимодействие;
-
десорбция продуктов каталитической реакции с поверхности катализатора;
-
отвод продуктов от поверхности катализатора путем диффузии.
Таким образом, и в гетерогенном катализе ускоряющее действие катализатора связано с понижением энергии активации, которое происходит за счет образования реагирующими веществами промежуточных поверхностных соединений на активных участках катализатора. Например, энергия активации реакции 2NH3 N2 + 3H2 в присутствии платинового катализатора уменьшается с 330 до 160 кДж/моль.
Катализаторами для гетерогенного катализа служат металлы (Pt, Pd, Ni, Fe, Co), оксиды металлов (Al2O3, V2O5, MnO2, Cr2O3, MoO3), сульфиды металлов (MoS2, CoS).
Химическое равновесие
Реакции, которые могут идти в двух взаимнопротивоположных направлениях, называются обратимыми.
Пример:


пр
= kпр
![]()
кинетическое выражение для скорости
прямой реакции,
кинетическое выражение для скорости
прямой реакции,
обр
= kобр
![]()
кинетическое выражение для скорости
обратной реакции.
кинетическое выражение для скорости
обратной реакции.
Химическое равновесие характеризуется равенством скоростей прямой и обратной реакций и постоянством концентраций всех веществ.
пр = обр;
Концентрации
![]()
остаются постоянными.
остаются постоянными.
![]()
 ;
;  .
.
В общем виде:
a
 A
+ bB cC + dD
A
+ bB cC + dD
![]() кинетическое
уравнение для константы равновесия.
кинетическое
уравнение для константы равновесия.
Констаната равновесия обратимой химической реакции равна отношению произведения концентраций продуктов реакции, взятых в некоторых степенях, к произведению концентраций исходных веществ в некоторых степнях.
Константу равновесия можно рассчитать по стандартной изотерме Вант-Гоффа:
G = RT ln Kр
![]()
Пример расчёта равновесных концентраций.
При
некоторой температуре в системе,
образованной смешением SO2
и О2,
установилось равновесие при концентрациях
![]() =
0,035моль/л,
=
0,035моль/л,![]() =
0,015моль/л и
=
0,015моль/л и
![]() =
0,065моль/л. Вычислить константу равновесия
и исходные концентрации веществ.
=
0,065моль/л. Вычислить константу равновесия
и исходные концентрации веществ.
![]()
 .
.
По
уравнеию химической реакции 2 моль SO3
образуется из 2 моль SO2
и 1 моль O2,
следовательно, 0,065 моль SO3
образовалось из 0,065 моль SO2
и
![]() моль
О2,
тогда
моль
О2,
тогда
|
ν, моль |
SO2 |
O2 |
SO3 |
|
νисх. |
0,1 |
0,0475 |
0 |
|
νистрач. |
0,065 |
0,0325 |
- |
|
νравн. |
0,035 |
0,015 |
0,065 |
Ответ: Кравн.= 230, Сисх.(SO2) = 0,1моль/л, Сисх.(О2) = 0,0474 моль/л.
Смещение равновесия.
Если не изменяются условия существования системы, то равновесие может существовать сколь угодно долго. Если изменить хотя бы одно из условий, то система выйдет из равновесия – скорости прямого и обратного процесса изменятся неодинаково – будет протекать реакция. Процесс изменения концентраций, вызванный нарушением равновесия, называется сдвигом или смещением равновесия.
Сдвиг равновесия вправо, это сдвиг в сторону продуктов реакции. Сдвиг равновесия влево, это сдвиг в сторону исходных веществ.
Принцип смещения равновесия сформулировал Ле - Шателье:
Если изменить одно из условий, при которых система находится в равновесии, то в системе усиливается та реакция, которая противодействует произведённому изменению, т. е. система сопротивляется производимым изменениям.
Используя этот принцип, всегда можно определить направление смещения равновесия.
Пример:

-
При увеличении температуры в системе усиливаются те процессы, в результате которых температура будет снижаться, т.е. равновесие сместится в направлении эндотермической реакции, в данном случае – в сторону обратной реакции, т.е. влево.
-
При уменьшении температуры в системе усиливаются те процессы, в результате которых температура может увеличиться, т.е. равновесие сместится в направлении экзотермической реакции, в данном случае – в сторону прямой реакции, т.е. вправо.
-
При увеличении давления равновесия смещается в сторону образования меньшего числа молекул газа, что приведет к снижению давления в данном объеме системы, т.е. в данном случае – вправо.
-
При уменьшении давления равновесие смещается влево, т. е. в сторону образования большего количества молекул газа.
Изменение давления влияет на смещение равновесия только в тех случаях, когда в системе имеются газы.
Изменение давления не влияет на смещение равновесия, если не меняется число молекул газообразных веществ.
-
При увеличении концентрации исходных веществ или уменьшении концентрации продуктов реакции равновесие смещается вправо, т.е. в сторону продуктов реакции.
-
При увеличении концентрации продуктов реакции или уменьшении концентрации исходных веществ равновесие смещается влево, т. е. в сторону исходных веществ.
Концентрации газообразных веществ пропорциональны их парциальным давлениям, поэтому в кинетическом уравнении концентрацию газа можно заменять парциальным давлением:
![]()
Если реакция гетерогенная, то концентрации твёрдых веществ не входят в кинетическое уравнение для константы равновесия.
Пример:
![]() ;
;

СТРОЕНИЕ ВЕЩЕСТВА
Строение атома
Радиус
атома: rа
0.1 нм; радиус ядра rя
10-6нм.
Как видно, величина ядра очень мала по
сравнению с размером атома, но плотность
ядра очень велика (=1014![]() ),
поэтому строение ядра более сложно и
требует подробного рассмотрения.
),
поэтому строение ядра более сложно и
требует подробного рассмотрения.
Состав ядра:
Ядро состоит из нуклонов (протонов и нейтронов). Масса протона: mp = 1.00076 а.е.м.; масса нейтрона: mn = 1.0009 а.е.м. Заряд протона: zp =1.610-19 кулон, соответствует элементарному заряду (+1), заряд электрона (1).
Протон
обозначается ![]() ,
нейтрон
,
нейтрон
![]() .
.
Массовое
число атома равно: А
= N
+ Z,
где N
сумма нейтронов, Z
сумма протонов, масса же электрона
ничтожно мала (![]() ),
т. е. суммой масс электронов можно
пренебречь.
),
т. е. суммой масс электронов можно
пренебречь.
Из таблицы Менделеева можно извлечь следующие данные:
-
массовое число атомная масса;
-
порядковый номер элемента заряд ядра, он же и число протонов в ядре;
-
число нейтронов вычисляется по формуле: N = A Z.
Пример.
Указать состав атома
![]() .
.
А = 19, Z = 9, N = 19 9 = 10, e-1 = 9.
Совокупность атомов, обладающих одинаковым зарядом ядра, называется химическим элементом. Атомы, обладающие одинаковым зарядом ядра, но разными массами, называются изотопы.
Массу
атомов и молекул принято выражать в
виде относительной величины, в атомных
единицах массы (а.е.м.). В настоящее время
это углеродная единица, равная 1/12 части
масссы атома углерода (![]() ).
).
Строение электронных оболочек атомов.
В 1903 г. Томпсон предположил модель атома, состоящего из положительного ядра, в который вкраплены отрицательные заряды. Впоследствии эта модель была отвергнута, и Э. Резерфордом в 1911 г. была выдвинута планетарная модель атома. Он предположил, что положительно заряженное ядро находится внутри атома, а вокруг него, на большом расстоянии вращаются отрицательно заряженные электроны.
В 1913 г. Н Бор выдвинул 2 постулата:
-
Электорон, вращаясь по стационарной орбите, не излучает энергию.
-
При переходе с одной стационарной орбиты на другую, электрон может поглощать или излучать энергию, причём, если он переходит с дальней орбиты на ближнюю, он излучает энергию, а при переходе с ближней на дальнюю поглащает энергию.
Следствия:
E = E2 E1; Е = h квант энергии, где h постоянная Планка, равная 6,62610-34 Дж/с;
частота излучения, она равна количеству колебаний световой волны, которые происходят на отрезке в 300000 км., за 1 секунду, или сколько длин волны укладывается на этом отрезке в 1 с.
2-ой постулат Бора гласит, что энергия квантуется (когда какая-нибудь величина имеет ряд строго определённых значений, говорят, что она квантована).
Однако, теория Бора не обьясняет, где находится электрон, когда переходит с одной орбиты на другую.
Основные положения квантовой химии.
1-ая идея квантовой химии: а) вещество дискретно; б) энергия квантуется.
2-ая идея квантовой химии: корпускулярно-волновой дуализм.
3-я идея квантовой химии: вероятностный характер законов микромира.
-
Дискретность вещество состоит из отдельных микрочастиц. Именно эти частицы изучает квантовая химия. Идею квантования энергии, основываясь на спектрах излучения нагретых тел, выдвинул Планк.
-
Корпускулярно-волновой дуализм. Микрочастицы в микромире обладают и свойствами частицы, и свойствами волны.
Впервые корпускулярно-волновой дуализм был предположен для света (электромагнитного излучения). С одной стороны свет, это электромагнитная волна и для него характерны такие свойства, как интерференция и дифракция, а с другой стороны при наблюдении явления фотоэффекта, было выдвинуто предположение, что свет это поток частиц - фотонов. Была измерена даже масса фотона. Энергия фотона равна mc2.
Электрон тоже обладает двойственной природой: с одной стороны это частица, обладающая определённой массой и скоростью, с другой стороны электрон может вести себя как волна. Для потока электронов были обнаружены свойства интерференции и дифракции.
Электронография метод изучения строения вещества, основанный на волновых свойствах потока электрона.
Уравнение, связывающее корпускулярные и волновые свойства, это уравнение де Бройля.
Е
= mc2;
E
= h
= h![]() ;
mc2
= h
;
mc2
= h![]() ;
где
длина волны, с
скорость света, m
масса фотона.
;
где
длина волны, с
скорость света, m
масса фотона.
![]()
уравнение
де Бройля для световой волны.
уравнение
де Бройля для световой волны.
Для электрона уравнение де Бройля имеет вид:
![]() ,
где
скорость электрона. Когда
,
0,
=
,
где
скорость электрона. Когда
,
0,
=
![]() ,
.
,
.
-
Вероятностный характер законов микромира.
В 1927 г. Гейзинберг выдвинул принцип неопределённости; согласно этому принципу невозможно точно определить местоположение частицы и её импульс в данный момент времени.
![]() ,
где px
погрешность импульса вдоль оси Х, x
погрешность координаты,
,
где px
погрешность импульса вдоль оси Х, x
погрешность координаты,
![]()
квант действия
константа.
квант действия
константа.
Пусть
px
0, тогда x
,
т. к.
![]() ,
и наоборот, если x
0,
,
и наоборот, если x
0,
px .
Примечание. Эта неопределённость не связана с неточностью приборов, она является следствием самой природы электрона.
Следствия принципа неопределённости:
-
Движение электронов в атоме это движение без траектории, поэтому понятие “орбита”, выдвинутая Бором, в настоящее время не принимается, т.е. можно говорить только с той или иной степенью вероятности о нахождении электрона на определенном расстоянии от ядра.
-
На основании принципа неопределенности можно объяснить, почему электрон не падает на ядро.
Законы движения микрочастиц в квантовой химии выражены уравнением Шредингера, который применил волновую функцию , для описания движения электрона в 3х мерном пространстве.
![]() ;
;
![]() ,
где
оператор “набла”,
волновая функция, Е
полная энергия, Еп
потенциальая энергия, (Е
Еп)
кинетичская энергия.
,
где
оператор “набла”,
волновая функция, Е
полная энергия, Еп
потенциальая энергия, (Е
Еп)
кинетичская энергия.
2dV вероятность нахождения электрона в элементарном обьёме dV.
Решение уравнения Шреденгера в полярной системе координат даёт 3 независимые величины, которые называются квантовыми числами электрона: n, l, me. Вводят также ms спиновое квантовое число, которое характеризует движение электрона вокруг своей оси.
Квантовые числа прастранственные и энергитические характеристики электрона. Электроны в атоме образуют электронную оболочку, которая состоит из электронных слоёв, а электронные слои состоят из атомных орбиталей.
Атомная орбиталь область наиболее вероятного нахождения электрона.
1). n главное квантовое число, оно характеризует размер электронного облака, т. е. расстояние от ядра до наиболее плотной части этого облака. Электроны, имеющие облака одинакового размера, независимо от формы, составляют электронный слой оболочки атома или энергитический уровень.
n принимает значения 1;2;3;…;. n соответствует номеру периода.
2). ℓ орбитальное квантовое число, оно характеризует форму электронного облака или энергетический подуровень. ℓ принимает значения от 0 до n 1.
Электроны, характеризующиеся значениями орбитального квантового числа 0,1, 2 и 3, называют соответственно s-электронами,р-электронами, d-электронами и f-электронами. При данном значении главного квантового числа n наименьшей энергией обладают s-электроны, затем р-, d- и f-электроны.
|
n |
ℓ |
Форма облака |
|
1 2 3 4 |
0 0,1 0,1,2 0,1,2,3 |
s s,p s,p,d s,p,d,f |
3). mℓ магнитное квантовое число, оно характеризует ориентацию электрона в поле, которое создают другие электроны.
Магнитное квантовое число принимает значения 2ℓ + 1 ( ℓ, … 0, …+ ℓ).
|
ℓ |
подуровень |
mℓ |
|
0 |
s |
1 (m = 1) |
|
1 |
p |
1, 0, +1 (m = 3) |
|
2 |
d |
2, 1, 0, +1, +2 (m = 5) |
|
3 |
f |
3, 2, 1, 0, +1, +2, +3 (m = 7) |
Электронное облако определённого размера (с определённым значением n), определённой формы (с определённым значением ℓ), и определённым образом ориентированное в пространстве (с определённым значением m), называется электронной орбиталью и изображается в виде квантовой ячейки.
s d
p f
4). ms спиновое число.
Спиновое квантовое число отражает наличие у электрона собственного момента движения. Проекция собственного момента количества движения электрона на избранное направление и называется спином.
ms = ½ , т. е. электроны могут вращаться по часовой или против часовой стрелки. На одной электронной орбите могут находиться два электрона с противоположно направленными спинами.
Распределение электронов в многоэлектронных атомах.
Распределение электронов в многоэлектронных атомах основано на трех положениях: принципе минимума энергии, принципе В. Паули и правиле Ф Хунда.
1. Заполнение энергетических уровней и подуровней происходит согласно принципу минимальной энергии: минимальной энергией обладают уровни и подуровни, ближайшие к ядру: 1s, 2s, 2p, 3s, 3p, 4s, 3d и т. д.
Правила Клечковского:
1). Минимальной энергии соответствует минимальное значение суммы n + ℓ.
2). Если эта сумма для двух электронов одинакова, то минимальная энергия (Emin) соответствует минимальному значению n.
-
nℓ
n + ℓ
1s
1 + 0 =1
2s
2 + 0 = 2
2p
2 + 1 = 3
3s
3 + 0 = 3
3p
3 + 1 = 4
3d
3 + 2 = 5
4s
4 + 0 = 4
4p
4 + 1 =5
4d
4 + 2 = 6
4f
4 + 3 = 7
5s
5 + 0 = 5
5p
5 + 1 = 6
5f
5 + 2 = 7
5f
5 + 3 = 8
6s
6 + 0 = 6
6p
6 + 1 =7
Emin: 1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f≈5d<6p.
2. Принцип Паули состоит в том, что
в атоме не может быть электронов, имеющих одинаковый набор всех четырех квантовых чисел.
Вспомним, что электрон может характеризоваться только одним набором 4-х квантовых чисел (n, l,ml и ms), а одной пространственной атомной орбитали (АО) соответствует состояние с фиксированными значениями 3-х квантовых чисел (n, l, ml). Тогда по принципу Паули для конкретной АО возможно лишь столько состояний электрона, сколько различных значений возможно для четвертого квантового числа ms. Для последнего возможны лишь два значения. Поэтому максимальное количество электронов для одной АО – 2. Два электрона, находящихся на одной орбитали и обладающие противоположно направленными спинами, называются спаренными. Согласно принципу Паули максимально возможное количество электронов на подуровне Nmax =2(2ℓ + 1), так как каждому значению ℓ соответствует (2ℓ + 1) значение магнитного квантового числа, т.е. (2ℓ + 1) АО, а на каждой может находиться по 2 электрона.
На s подуровне Nmax = 2;
На р подуровне Nmax = 6;
На d подуровне Nmax = 10;
На f подуровне Nmax = 14.
Максимально возможное число таких комбинаций всех 4-х квантовых чисел при заданном значении n, чтобы не было двух одинаковых, дает нам максимальное число электронов на уровне Nmax=2n2.
-
Правило Хунда. Это правило определяет порядок размещения электронов в пределах одной электронной подоболочки для наиболее устойчивого состояния атома.
Оно гласит: в наиболее устойчивом состоянии атома электроны размещаются в пределах электронной подоболочки так, чтобы их суммарный спин был максимален.
Например: для электронной конфигурации 2р3 возможны следующие варианты размещения электронов


















1 2
1.Суммарный спин электронов: ½ +½ +½ = 3/2
2. Суммарный спин электронов: ½ - ½ +½ = ½
3. Суммарный спин электронов: ½ - ½ +½ = ½
Только в первом случае, когда каждой АО соответствует электрон со спином +1/2, достигается максимальный суммарный спин. Значит, это и есть энегетически самое выгодное состояние системы.
Правило Хунда не запрещает другого распределения электронов в пределах электронной подоболочки. Состояние атома с меньшими значениями суммарного спина электронов будут энергетически менее выгодными и, в отличие от первого, называемого основным, будут относиться к возбужденным состояниям.
Составление электронных формул по двум квантовым числам.
Максимальное заполнение энергетических уровней и подуровней.
|
n |
N = 2n2 |
ℓ |
N = 2(2ℓ + 1) |
Запись электронного состояния |
|
1 |
2 |
0(s) |
2 |
1s2 |
|
2 |
8 |
0(s) 1(p) |
2 6 |
2s2p6 |
|
3 |
18 |
0(s) 1(p) 2(d) |
2 6 10 |
3s2p6d10 |
|
4 |
32 |
0(s) 1(p) 2(d) 3(f) |
2 6 10 14 |
4s2p6d10f14 |
|
5 |
32 |
0(s) 1(p) 2(d) 3(f) |
2 6 10 14 |
5s2p6d10f14 |
|
6 |
8 |
0(s) 1(p) |
2 6 |
6s2p6 |
-
Чтобы правильно составить электронную формулу элемента, нужно определить его положение в таблице Менделеева. Z заряд ядра, А = Z + N; ē = Z.
-
n – главное квантовое число и, значит, число энергетических уровней, соответствует № периода.
-
№ группы соответствует числу валентных электронов (участвующих в образовании связей), причём, если это главная подгруппа (А), то все валентные электроны находятся на верхнем энергетическом уровне. Если это побочная подгруппа, то на внешнем энергетическом уровне находятся 1 или 2 валентных электрона, остальные находятся на предвнешнем энергетическом уровне.
Пример: ![]() ; n
= 1,2 ,3,4; VII
A; z
= 35;
; n
= 1,2 ,3,4; VII
A; z
= 35;
![]() =
35;
=
35;
![]() =
45; ē = 35.
=
45; ē = 35.
Br: 1s22s2p63s2p6d104s2p5 на последнем энергетическом уровне, находятся валентные электроны.
У десяти элементов побочной подгруппы наблюдается проскок электронов (Cu, Au, Ag, Mo, Cr, Nb, Ru, Rh, Pt, Pd).
Периодический закон Д.И. Менделеева
В зависимости от того, на какой энергетический подуровень пришёл последний электрон, различают электронные семейства элементов (s, p, d, и f элементы).
-
s элементы, это элементы первой группы главной подгруппы и второй группы главной подгруппы (IA, IIA). На внешнем энергетическом уровне у них 1 или 2 электрона. Все s элементы типичные металлы (исключение Be - амфотерный).
В своих соединениях s элементы имеют степени окисления +1 и +2.
IA щелочные металлы, их оксиды обладают основным характером.
Пример: Na2O + H2O = NaOH щёлочь.
IIА Be амфотерный металл, Mg – типичный металл. Их оксиды не реагируют с водой, гидроксиды не растворимы в воде. Ca, Sr, Ba щелочноземельные элементы. Их оксиды непосредственно реагируют с водой, обладают основным характером.
Пример: CaO + H2O = Ca(OH)2
Пример:![]() :
1s22s2; n
= 1,2; IIA.
:
1s22s2; n
= 1,2; IIA.
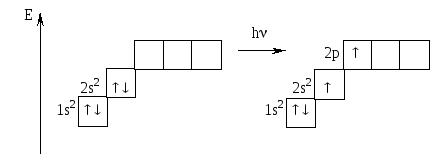
Be Be*
Бериллий в основном состоянии не имеет неспаренных электронов, но при поглощении кванта энергии спаренные s-электроны распариваются и занимают свободные ячейки на p-подуровне. Таким образом, в возбужденном состоянии атом бериллия имеет валентность, равную 2.
Валентность элемента равна количеству неспаренных электронов в возбужденном состоянии.
2. p элементы, это элементы c третьей группы главной подгруппы по восьмую группу главной подгруппы (IIIA VIIIA), в основном – это неметаллы. Они занимают верхний правый угол в таблице Менделеева:
Неметаллы могут проявлять как положительные, так и отрицательные степени окисления: отрицательную степень окисления в соединениях с водородом и металлами.
Минимальная степень окисления равна (№ группы-8): C-4 H4, N-3H3, H2S-2, HCl-1.
В соединениях с кислородом и с другими более электроотрицательными элементами, неметаллы могут проявлять положительную степень окисления, максимальная степень окисления равна номеру группы.
Пример:
![]() хлорноватистая
кислота;
хлорноватистая
кислота;![]() 2
хлористая кислота;
2
хлористая кислота;
![]() хлорноватая
кислота;
хлорноватая
кислота;
![]()
хлорная кислота.
хлорная кислота.
Т.
е. все оксиды неметаллов обладают
кислотным характером и растворимы в
воде (исключение SiO2).Пример:
![]() ;
n
= 1,2,3,4; VA;
p
элемент.
;
n
= 1,2,3,4; VA;
p
элемент.
As: 1s22s2p63s2p6d104s2p3
 As As*
As As*
As-3: 1s22s2p63s2p6d104s2p6;
As + 3ē → As-3; As-3H3 арсин.
As 3ē → As+3; As+3: 1s22s2p63s2p6d104s2; As2O3 оксид мышьяка (Ш), амфотерный характер.
As2O3 + H2O = 2HAsO2 мышьяковистая кислота. Соли мышьяковистой кислоты NaAsO2 арсениты.
As 5ē → As+5; As2O5 кислотный оксид; As2O5 + H2O = 2HAsO3 мышьяковая кислота. Соли мышьяковой кислоты, NaAsO3 арсенаты.
Существуют следующие р элементы - металлы:
IIIA: Al (амф.), In, Tl (типичные металлы).
IVA:
Ge,
Sn,
Pb
( типичные амфотерные элементы), могут
проявлять степень окисления +2, +4, могут
проявлять отрицательную степень
окисления:
![]() .
.
VA: Sb (амф.).
VIA: Po (амф.).
Рассмотрим соединения олова:
![]() :
1s22s2p63s2p6d104s2p6d105s2p2;
n = 1,2,3,4,5; IVA; p
элемент.
:
1s22s2p63s2p6d104s2p6d105s2p2;
n = 1,2,3,4,5; IVA; p
элемент.
Sn+2: 1s22s2p63s2p6d104s2p6d105s2;
Sn+4: 1s22s2p63s2p6d104s2p6d104s2p6d10.
Оксид олова (II) SnO – амфотерный
 HCl
SnCl2
хлорид олова
HCl
SnCl2
хлорид олова
S n(OH)2
n(OH)2
NaOH Na2SnO2 станнит натрия
Оксид олова (IV) - SnO2 – амфотерный
 HCl
SnCl4
HCl
SnCl4
S n(OH)4
n(OH)4
NaOH Na2SnO3 станнат натрия
H4SnO4; H2SnO3 – оловянная кислота, орто- и мета-форма.
3) d элементы это элементы, у которых происходит заполнение электронами предвнешнего d подуровня. Они составляют побочные подгруппы. У d элементов на внешнем уровне 1- 2 электрона (искл. Pd 0 электронов). Валентными являются электроны внешнего уровня и предвнешнего d подуровня. Все d элементы металлы, проявляют только положительную степень окисления. Характер оксидов и гидрооксидов зависит от степени окисления элементов. Низшая положительная степень окисления как правило +2, (искл. Ag, Au, Cu, степень окисления этих элементов +1), характер оксидов и гидрооксидов - основной. Промежуточная степень окисления равна +3, +4, характер оксидов и гидрооксидов - амфотерный. Высшая положительная степень окисления равна номеру группы (искл. Ag, Au, Cu степень окисления +3), характер оксидов и гидрооксидов - кислотный.
Рассмотрим пример типичного d элемента, Mn (марганец).
![]() :
1s22s2p63s2p6d54s2;
n = 1,2,3,4; VII B.
:
1s22s2p63s2p6d54s2;
n = 1,2,3,4; VII B.
Mn2+: MnO основной оксид, Mn(OH)2 – основной гидроксид.
Mn4+: MnO2 – амфотерный оксид, Mn(OH)4 амфотерный гидрооксид, H2MnO3 марганцеватистая кислота. Соли марганцеватистой кислоты: Mg2MnO3 манганиты.
Мn6+; MnO3 кислотный оксид, H2MnO4 марганцовистая кислота. Соли марганцовистой кислоты: K2MnO4 манганаты.
Mn7+; Mn2O7 кислотный оксид, HMnO4 марганцевая кислота. Соли марганцевой кислоты: KMnO4 перманганаты.
4) f элементы. К ним относятся лантаноиды и актиноиды. В них происходит достраивание предпредвнешнего f- подуровня.
La: // // // 5d16s2
Ac: // // // 6d17s2
![]() :
1s22s2p63s2p6d104s2p6d10f15s2p6d16s2
:
1s22s2p63s2p6d104s2p6d10f15s2p6d16s2
Лантаноиды и актиноиды похожи на типичные d элементы.
Периодический закон и периодическая система элементов.
Свойства элементов находятся в периодической зависимости от заряда ядра их атомов.
1. Радиусы атомов. В пределах периода с увеличением порядкового номера элемента, размеры атомов уменьшаются, т. к. увеличивается положительный заряд ядра, а количество энергетических уровней остаётся постоянным. Чем больше заряд ядра, тем сильнее электроны притягиваются к ядру, поэтому радиус атома уменьшается.
В пределах группы, с увеличением порядкового номера, размеры атомов возрастают, т. к. несмотря на увеличение заряда ядра, увеличивается количество энергетических уровней и ослабляется притяжение электронов к ядру.
Радиусы ионов, по сравнению с радиусами атомов могут увеличиваться или уменьшаться, в зависимости от того, принимает атом электрон, или отдаёт.
2. Энергия ионизации или Нион. это то количество энергии, которое необходимо затратить, чтобы оторвать электрон от невозбуждённого атома и удалить его за пределы взаимодействия.
Нион. > 0, причём, каждый последующий электрон отрывается труднее
Н1 < Н2 < Н3 <…< Нn
Величина Нион. характеризует способность элемента отдавать электроны, т. е. характеризует его восстановительные свойства. Чем меньше Нион., тем выше восстановительные свойства элементов. В пределах периода с уменьшением радиуса атомов энергия ионозации увеличивается, а в пределах группы с увеличением радиуса атомов энергия ионизации уменьшается.
3. Энергия сродства к электрону - это энергия, которая выделяется при присоединении электрона к невозбуждённому атому, молекуле или радикалу.
Э + е → Э, Н < 0 процесс экзотермический.
В периодах слева направо сродство к электрону увеличивается, а в пределах группы сверху вниз сродство к электрону уменьшается, т. к. увеличивается радиус атома.
Сродство
к электрону характеризует окисляющие
свойства элемента, т. е. чем больше
сродство к электрону, тем более сильным
окислителем является элемент. Самым
сильным окислителем является F
(фтор):![]() .
.
4. Электроотрицательность. Чтобы учесть и Нион. и Нср-ва, вводят понятие электроотрицательности.
![]() .
.
Электроотрицательность (по Полингу) это способность атома, связанного в молекуле и ионе, притягивать к себе электроны, участвующие в образовании связей.
Вводится шкала электроотрицательности по Полингу:
![]()
В пределах периода электроотрицательность возрастает слева направо. А в пределах группы электроотрицательность уменьшается сверху вниз.
5. Кислотно-основные свойства оксидов и гидроксидов.
В пределах периода, слева направо возрастают кислотные свойства оксидов и гидроксидов. Рассмотрим, например III период:
NaOH Mg(OH)2 Al(OH)3
щёлочь н/р в воде основание амфотерный гидроксид
H2SiO3 H3PO4 H2SO4 HClO4
слабая кислота средней силы кислота сильная кислота очень сильная кислота
В пределах группы возрастают основные свойства оксидов и гидроксидов. Возьмём IV группу, главную подгруппу:
H2CO3 кислота;
H2SiO3 не растворимая в воде кислота;
H2GeO3 ≡ Ge(OH)4 амфотерный гидроксид, с преобладанием кислотных свойств;
H2SnO3 ≡ Sn(OH)4 амфотерный гидроксид;
Pb(OH)4 амфотерный гидроксид, с преобладанием основных свойств.
6. Окислительно-восстановительная способность элемента. См. п. 2 и 3.
ХИМИЧЕСКАЯ СВЯЗЬ.
Определение. Химической связью называют взаимодействие между атомами, приводящее к образованию молекул или ионов и прочному удерживанию атомов друг около друга.
Химическая связь имеет электронную природу, т. е. осуществляется за счёт взаимодействия валентных электронов. В зависимости от распределения валентных электронов в молекуле, различают следующие виды связей: ионная, ковалентная, донорно-акцепторная, металлическая и др.
Ионная связь.
Основные положения современной теории ионной связи:
-
Ионная связь образуется при взаимодействии элементов, резко отличающихся друг от друга по свойствам, т. е. между металлами и неметаллами.
-
Образование химической связи объясняется стремлением атомов к достижению устойчивой восьмиэлектронной внешней оболочки (s2p6).
Пример: Na + Cl2 = NaCl2
Na: 1s22s2p63s1 Na0 1e = Na+ Na+: 1s22s2p6
Cl: 1s22s2p63s2p5 Cl0 + 1e = Cl Cl: 1s22s2p63s2p6
3.) Образовавшиеся разноимённо заряженные ионы удерживаются друг около друга за счёт электростатического притяжения.
-
Ионная связь не направленная.
-
Не существует 100%-ной ионной связи, т. е. полностью атомы не отдают свои электроны другому атому.
Пример: Fr+0,93F-0,93 93%

 FrF
Fr+
+ F-
- при растворении. Ионная связь
частный случай ковалентной связи.
FrF
Fr+
+ F-
- при растворении. Ионная связь
частный случай ковалентной связи.
Ковалентная связь. Основные положения современной теории ковалентной связи.
-
Ковалентная связь образуется между элементами, сходными по свойствам, т. е. неметаллами.
-
Каждый элемент предоставляет для образования связей 1 электрон, причём спины электронов должны быть антипараллельными.
-
Если ковалентная связь образована атомами одного и того же элемента, то эта связь не полярная, т. е. общая электронная пара не смещена ни к одному из атомов. Если же ковалентная связь образована двумя разными атомам, то общая электронная пара смещена к наиболее электроотрицательному атому, это полярная ковалентная связь.
-
При образовании ковалентной связи происходит перекрывание электронных облаков взаимодействующих атомов, в результате, в пространстве между атомами возникает зона повышенной электронной плотности, притягивающая к себе положительно заряженные ядра взаимодействующих атомов, и удерживающая их друг от друга

r расстояние между взаимодействующими векторами.
Для описания ковалентной связи используют 2 метода: метод валентных связей (ВС) и метод молекулярных орбиталей (ММО).
Основные положения метода валентных связей.
В основе метода ВС лежат следующие положения:
1. Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. Комбинации таких двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем.
2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Для наглядного изображения валентных схем обычно пользуются следующим способом.
H: 1s1;
N: 1s22s2p3;
Cl: 1s22s2p63s2p5.
![]()
![]()

Число общих электронных пар, связывающих атом данного элемента с другими атомами, или, иначе говоря, число образуемых атомом ковалентных связей, называется ковалентностью по методу ВС. Так, ковалентность водорода равна 1, азота - 3.
По способу перекрывания электронных облаков, связи бывают двух видов: - связь и - связь.
- связь возникает при перекрывании двух электронных облаков по оси, соединяющей ядра атомов.

- связь образуется при перекрывании электронных облаков по обе стороны от линии, соединяющей ядра взаимодействующих атомов.

Основные характеристики ковалентной связи:
-
Длина связи, ℓ. Это минимальное расстояние между ядрами взаимодействующих атомов, которое соответствует наиболее устойчивому состоянию системы.
-
Энергия связи, Emin – это то количество энергии, которое необходимо затратить для разрыва химической связи и для удаления атомов за пределы взаимодействия.
-
Дипольный момент связи
 ,
,
 qℓ.
Дипольный момент служит количественной
мерой полярности молекулы. Для неполярных
молекул дипольный момент равен 0, для
полярных не равен 0. Дипольный момент
многоатомной молекулы равен векторной
сумме диполей отдельных связей.
qℓ.
Дипольный момент служит количественной
мерой полярности молекулы. Для неполярных
молекул дипольный момент равен 0, для
полярных не равен 0. Дипольный момент
многоатомной молекулы равен векторной
сумме диполей отдельных связей.
Рассмотрим, например, СО2:
O
 C O
C O
![]()
![]()
![]() = 0
= 0
H2O:

 H
H
![]()
O


![]() ≠ 0
≠ 0
H
-
Ковалентная связь характеризуется направленностью, валентным углом и определённой формой молекулы.
Перекрывание валентных облаков происходит только при определённом валентном угле.
1). Линейная молекула, φ = 180˚ H – Cl
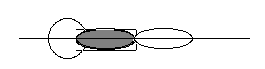
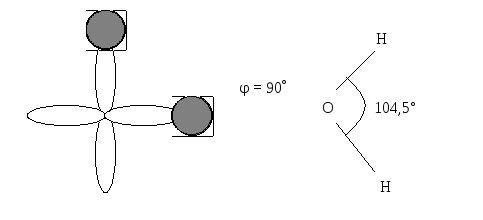
2). Угловые молекулы, обычно трёхатомные. Пример – H2O
3). Пирамидальные молекулы, обычно 4-х атомные. Пример – NH3, PCl3.

5. Насыщаемость ковалентной связи - это число ковалентных связей, которые может образовывать атом. Оно ограничено, т.к. элемент обладает ограниченным количеством валентных электронов. Максимальное число ковалентных связей, которые может образовывать данный атом в основном или возбуждённом состоянии, называется его ковалентностью.
Пример: водород – одноковалентен, кислород – двухковалентен, азот – трёх- ковалентен и т. д.
Некоторые атомы могут повышать свою ковалентность в возбуждённом состоянии за счёт разъединения спаренных электронов.
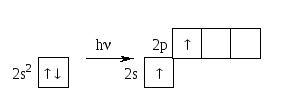
Пример Be:
Be: 1s22s2
Be0 Be*
Ковалентность Be0 = 0, а ковалентность Be* = 2. Образуется Sp – гибридизация. Sp – гибридные облака имеют форму неправильной гантели, с валентным углом, равным 180˚.

Cl Be Cl
B0: 1s22s2p1

Валентность = 1 sp2 – гибридные орбитали
Валентный угол при sp2 – гибридизации равен 120°

C: 1s22s2p2






2p2 h

2s2 sp3
Образуются sp3 – гибридные орбитали. Пример: CH4, валентный угол равен 109˚28//

Донорно-акцепторная связь.
Донорно-акцепторная связь это особый случай ковалентной связи, отличающийся от ковалентной связи только способом образования, т.е. происхождением общей электронной пары. При образовании донорно-акцепторной связи один из атомов – донор, предоставляет свою неподеленную электронную пару для образования общей электронной пары с другим атомом, а другой атом – акцептор, у него свободная электронная орбиталь, на которую и приходит неподелённая электронная пара донора, которая становится общей.
Рассмотрим, например, образование иона аммония (NH4)+:
NH3 + HCl = NH4Cl

По типу донорно-акцепторной связи построены различные комплексные соединения.
Комплексные соединения – это сложные молекулярные системы, имеющие в своем составе сложные комплексные ионы, способные к существованию, как в кристаллическом виде, так и в растворе.
Структура комплексных соединений по Вернеру.
Комплексные соединения состоят из внешней и внутренней сферы, внутреннюю сферу комплексного соединения составляют ион-комплексообразователь и лиганды. Комплексообразователем являются, чаще всего, d-элементы или амфотерные металлы. Лигандами являются нейтральные молекулы или отрицательно заряженные ионы. Количество лигандов определяется координационным числом комплексообразователя, которое, как правило, равно удвоенной валентности иона-комплексообразователя. Лиганды бывают монодентантными и полидентантными. Дентантность лиганда определяется числом координационных мест, которые лиганд занимает в координационной сфере комплексообразователя. Например, F- - монодентантный лиганд, S2O32- - бидентантный лиганд. Заряд внутренней сферы равен алгебраической сумме зарядов составляющих ее ионов. Если внутренняя сфера имеет отрицательный заряд – это анионный комплекс, если положительный – катионный. Катионные комплексы называют по имени иона-комплексообразователя по-русски, в анионных комплексах комплексообразователь называется по-латыни с добавлением суффикса –ат. Связь между внешней и внутренней сферами в комплексном соединении – ионная, во внутренней сфере связь между комплексообразователем и лигандами донорно-акцепторная, при этом комплексообразователь является акцептором, а лиганд – донором электронной пары.
Пример: Na2[Zn(OH)4] – тетрагидроксоцинкат натрия, анионный комплекс.
-
[Zn(OH)4]2- - внутренняя сфера
-
2Na+ - внешняя сфера
-
Zn2+ - комплексообразователь
-
OH- - лиганды
-
координационное число – 4
-
связь между внешней и внутренней сферами ионная:

-
связь между ионом Zn2+ и гидроксильными группами – донорно-акцепторная, OH- - доноры, Zn2+ - акцептор.
Zn0: … 3d10 4s2
Zn2+: … 3d10 4s0 p0 d0
ОН d0
4p0
sp3
-гибридизация 4s0
ОН ОН














Типы комплексных соединений:
-
Аммино – комплексы (аммиакаты).
Лиганд: NH30 (аммино-)
Пример:
[ Cu2+(NH3)4]SO4 – сульфат тетраамминмеди (II).
Амминокомплексы получаются действием избытка аммиака на соединение, содержащее комплексообразователь.
-
Гидроксо – комплексы
Лиганд: OH- ( гидроксо – )
Na2[Zn(OH)4] - тетрагидроксоцинкат натрия
Получают гидроксо – комплексы действием избытка щелочи на соли амфотерных металлов.
-
Аква – комплексы.
Лиганд: H2O (аква -)
[Co(H2O)6]3+Cl3 – хлорид гексааквакобальта (III).
Получают аква-комплексы кристаллизацией или высаждением из водных растворов.
-
Ацидо – комплексы
Лиганд: анионы кислот – Cl-, F-, CN-, SO32-
K3[Fe3+(CN)6] - гексацианоферрат (III) калия.
Получают действием избытка соли, содержащей лиганд, на соль, содержащую комплексообразователь.
Метод молекулярных орбиталей.
Метод молекулярных орбиталей (ММО) позволяет объяснить ряд противоречий, которые нельзя объяснить, используя метод валентных связей.
Например, образование молекулы кислорода О2 описывается методом валентных связей как результат создания двух общих электронных пар:

Согласно такому описанию, молекула О2 не содержит неспаренных электронов. Однако магнитные свойства кислорода указывают на то, что в молекуле О2 имеются два неспаренных электрона.
Согласно
методу валентных связей, все ковалентные
связи осуществляются общей парой
электронов. Между тем, ещё в конце
прошлого века было установлено
существование довольно прочного
молекулярного иона водорода
![]() :
энергия разрыва связи составляет здесь
2,65эВ. Однако никакой электронной пары
в этом случае образовываться не может,
поскольку в состав иона
:
энергия разрыва связи составляет здесь
2,65эВ. Однако никакой электронной пары
в этом случае образовываться не может,
поскольку в состав иона
![]() входит всего один электрон. Таким
образом, метод валентных связей не даёт
удовлетворительного объяснения
существованию иона
входит всего один электрон. Таким
образом, метод валентных связей не даёт
удовлетворительного объяснения
существованию иона
![]() .
.
Основные положения ММО.
-
При взаимодействии двух атомных орбиталей, образуются две молекулярные орбитали. Соответственно, при взаимодействии n-атомных орбиталей, образуется n-молекулярных орбиталей.
-
Электроны в молекуле в равной степени принадлежат всем ядрам молекулы.
-
Из двух образовавшихся молекулярных орбиталей, одна обладает более низкой энергией, чем исходная, это связывающая молекулярная орбиталь, другая обладает более высокой энергией чем исходная, это разрыхляющая молекулярная орбиталь.
-
В ММО используют энергетические диаграммы без масштаба.
-
При заполнении энергетических подуровней электронами, используют те же правила, что и для атомных орбиталей:
-
принцип минимальной энергии, т.е. в первую очередь заполняются подуровни, обладающие меньшей энергией;
-
принцип Паули: на каждом энергетическом подуровне не может быть больше двух электронов с антипараллельными спинами;
-
правило Хунда: заполнение энергетических подуровней идёт таким образом, чтобы суммарный спин был максимальным.
-
Кратность связи. Кратность связи в ММО определяется по формуле:
![]() когда
p
= 0, связь не образуется.
когда
p
= 0, связь не образуется.
Пример 1. Рассмотрим образование Н2 по ММО:

p
=
![]() ,
т. е. частица Н2
может существовать.
,
т. е. частица Н2
может существовать.
Пример 2 Образование иона Н2+

![]() т. е.
частица
т. е.
частица
![]() может
существовать.
может
существовать.
Пример 3. Почему не существует молекул инертных газов (на примере Не2 ).

![]() ,
т. е. такая молекула не может существовать.
,
т. е. такая молекула не может существовать.
Пример 4. Рассмотрим молекулу азота N2.

Пример 5. Рассмотрим молекулу кислорода О2

За счёт этих двух неспаренных валентных электронов, молекула О2 – парамагнитна. p = (6-2)/2 = 2.
Пример 6. Рассмотрим образование молекулы NO.

Межмолекулярные взаимодействия.
Водородная связь.
Атом водорода, связанный с электроотрицательным атомом, способен образовывать водородную связь с электроотрицательным атомом другой молекулы.
Например, Н2О:

Водородная связь характеризуется незначительной энергией связи: Е = 10 40 кДж/моль. Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, т.е. их ассоциацию в димеры или полимеры, которые в ряде случаев существуют не только в жидком состоянии вещества, но сохраняются и при переходе его в пар.
Н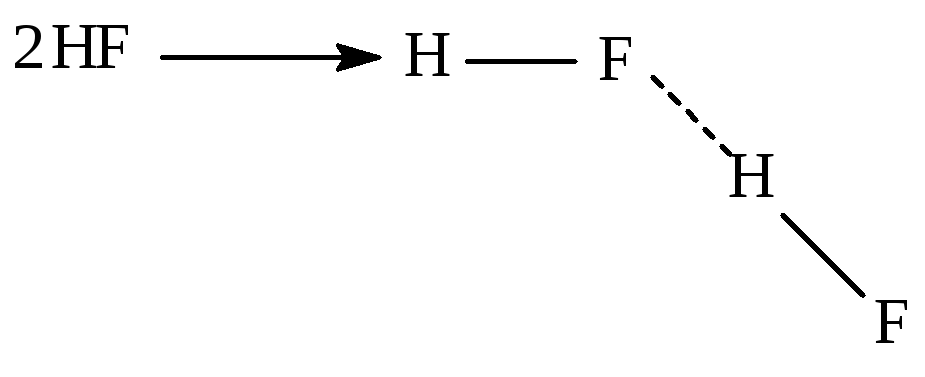 апример,
фтороводород в газовой фазе существует
в виде димера.
апример,
фтороводород в газовой фазе существует
в виде димера.
Образование водородной связи влияет на физические свойства элементов. Вещества с водородной связью обладают более высокой температурой кипения. Например, у воды аномально высокая температура кипения.
H2O – жидкость
H2S – газ
H2Se – газ
H2Te – газ
В сложных органических молекулах существуют внутримолекулярные водородные связи.

орто- гидроксибензальдегид мета- гидроксибензальдегид
внутримолекулярная межмолекулярная
водородная связь водородная связь.
Кроме водородных связей к основным видам взаимодействия относятся силы взаимодействия Ван-дер-Ваальса.
Вандерваальсовы силы – взаимодействие между молекулами. Природа этих сил электростатическая.
Основные силы взаимодействия:
1). Диполь – дипольное (ориентационное) взаимодействие существует между полярными молекулами.
![]()
2). Индукционное взаимодействие осуществляется, если в веществе имеется контакт полярных и неполярных молекул. В неполярной молекуле индуцируется диполь в результате взаимодействия с полярной молекулой.
Cl+ - Cl- … Al+Cl-3
3). Дисперсионное взаимодействие – это взаимодействие неполярных молекул за счет мгновенных диполей, возникающих за счет флуктуации электронной плотности в атомах.
Кристаллическое состояние вещества.
В газообразном состоянии молекулы вещества находятся на достаточно большом расстоянии друг от друга и занимают небольшой объем вещества. В газообразном состоянии молекулы или атомы, составляющие газ, практически не взаимодействуют между собой. Структура газообразных веществ не упорядочена.
При конденсации газообразных веществ образуются жидкие вещества. В жидком состоянии расстояние между молекулами значительно меньше, и основную часть объема вещества занимают молекулы, соприкасаясь друг с другом и притягиваясь друг к другу. Т.е. в жидком состоянии наблюдается некоторая упорядоченность частиц, соблюдается ближний порядок.
В твердом состоянии частицы настолько сближены друг с другом, что между ними возникают прочные связи, практически отсутствует движение частиц относительно друг друга. Существует высокая упорядоченность структуры. Твердые вещества могут находиться в аморфном и кристаллическом состоянии.
Аморфные вещества не имеют упорядоченной структуры, подобно жидкостям у них наблюдается только близкий порядок (стеклообразное состояние). Аморфные вещества обладают текучестью. Полимеры, смолы, аморфный кремний, аморфный селен, мелкодисперсное серебро, аморфный оксид кремния, германия, некоторые сульфаты, карбонаты находятся в аморфном состоянии. Аморфные вещества изотропны, т.е. физические свойства вещества распространяются одинаково в разные стороны, и они не имеют строго определенной точки плавления, они плавятся в каком-то интервале температур. Но подавляющее число твердых тел - кристаллические вещества.
Кристаллические вещества характеризуются дальним порядком, т.е. трехмерной периодичностью структуры по всему объему. Регулярное расположение частиц изображается в виде кристаллических решеток, в узлах которых расположены частицы, образующие твердое вещество. Соединяются они воображаемыми линиями.
Идеальные монокристаллы обладают:
- анизотропностью – т.е. в различных направлениях по объему кристалла физические свойства различны.
- определенной температурой плавления.
- кристаллические вещества характеризуются энергией кристаллической решетки, это та энергия, которую нужно затратить на то, чтобы разрушить кристаллическую решетку и удалить частицы за пределы взаимодействия.
- постоянная кристаллической решетки характеризует расстояние между частицами в кристаллической решетке, а также узлы между гранями кристаллической решетки.
- координационное число кристаллической решетки – это число частиц, непосредственно примыкающих к данной частице.
Наименьшей структурной единицей является элементарная ячейка. Имеется семь типов кристаллических решеток: кубическая, тетраэдрическая, гексагональная, ромбоэдрическая, орторомбоэдрическая, моноклинная и триклинная.
О ни
отличаются между собой углами между
осями (,
,
)
и постоянными кристаллической решетки
(a,b,c).
ни
отличаются между собой углами между
осями (,
,
)
и постоянными кристаллической решетки
(a,b,c).
Существуют различные вещества, которые кристаллизуются в одинаковых кристаллических решетках – изоморфные вещества.
Пример: KAl(SO4)2 12H2O и KCr(SO4)2 12H2O
По типу частиц в узлах кристаллической решетки кристаллы бывают: молекулярные, атомно – ковалентные, ионные, металлические и смешанные.
1). Молекулярные кристаллы: в узлах находятся молекулы, между которыми существуют вандерваальсовы взаимодействия или водородная связь. Веществ с молекулярной решеткой очень мало. К ним принадлежат неметаллы, за исключением углерода и кремния, все органические соединения с неионной связью и многие неорганические вещества. Например, структура льда:

Молекулярные кристаллы обладают небольшими координационными числами. и невысокой плотностью.
2). Атомно – ковалентные кристаллы: в узлах находятся атомы, которые связаны между собой ковалентными связями.
Пример: Атомно – ковалентный кристалл – алмаз, где атомы углерода (sp3 – гибридизация) находятся в кристаллической решетке. Координационное число тоже небольшое (к.ч. = 4).

3). Ионные кристаллы: в узлах находятся ионы, которые удерживаются друг около друга за счет электростатического взаимодействия. К соединениям с ионной связью относится большинство солей и небольшое число оксидов. Ионные соединения имеют сравнительно высокие температуры плавления. В связи с тем, что ионная связь ненасыщенна и ненаправленна, ионная решетка характеризуется высокими координационными числами (6,8).
4). Существуют металлические кристаллы. Металлические решетки образуют простые вещества большинства элементов периодической системы – металлы. По прочности металлические решетки находятся между атомными и молекулярными кристаллическими решетками.
5). В природе часто встречаются смешанные кристаллы, в которых взаимодействие осуществляется как ковалентными, так и вандерваальсовыми взаимодействиями, например, графит:

В слоях ковалентная связь (sp2-гибридтзация атома углергда), между слоями – вандерваальсово взаимодействие.
Некоторые вещества могут кристаллизоваться в различные кристаллические решетки. Это явление называется полиморфизм (примером являются: углерод, алмаз и графит) или аллотропия.
РАСТВОРЫ
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более компонентов, относительные количества которых могут изменяться в широких пределах.
Наиболее важный вид растворов – жидкие растворы.
Всякий раствор состоит из растворенных веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор. Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (спирт, вода), то растворителем считается компонент, находящийся в большем количестве. Отличие растворов от химических соединений состоит в том, что состав раствора может меняться в широких пределах. Кроме того, в свойствах раствора проявляются многие свойства отдельных компонентов, чего не наблюдается в случае химических соединений. Непостоянство состава приближает растворы к механическим смесям, но от последних растворы отличаются однородностью. Они занимают промежуточное положение.
Растворение кристалла в жидкости происходит следующим образом. Когда вносят кристалл в жидкость, в которой он может раствориться, от поверхности его отрываются отдельные молекулы, которые благодаря диффузии распределяются по всему объему растворителя. Отделение молекул от поверхности твердого тела объясняется их собственным колебательным движением, а также притяжением со стороны растворителя. Этот процесс должен бы продолжаться до полного растворения любого кристалла, если бы одновременно не происходил обратный процесс – кристаллизация. Перешедшие в раствор молекулы, ударяясь о поверхность еще не растворившегося вещества, притягиваются к нему и входят в состав кристаллов. Наконец, наступает момент, когда скорость растворения становится равной скорости кристаллизации, тогда устанавливается динамическое равновесие, при котором в единицу времени столько же молекул растворяется, сколько и выделяется из раствора.
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором.
Способы выражения концентрации растворов.
Концентрацией раствора называется содержание растворенного вещества в определенных массе или объеме раствора или растворителя.
Чаще всего для выражения концентрации растворов используются следующие способы.
Массовая доля – число граммов растворенного вещества в 100 г раствора.
![]()
Молярная концентрация – число моль растворенного вещества на 1 литр раствора
![]()
Эквивалентная (нормальная) концентрация – число моль эквивалентов растворенного вещества на 1 литр раствора.
![]()
Титр раствора – число граммов растворенного вещества, содержащихся в 1 мл раствора.
![]()
Все эти способы выражения концентрации связаны между собой следующим уравнением:
![]() ,
где
,
где
m1 – масса растворенного вещества, г,
m2 – масса раствора, г.
M – молярная масса, г/моль,
V – объем раствора , л.
Э – молярная масса эквивалентов, г/моль,
ρ - плотность раствора, г/см3.
Гидраты и кристаллогидраты.
Большинство веществ, находящихся в кристаллическом состоянии, растворяются в жидкостях с поглощением теплоты. Но при растворении некоторых веществ температура раствора повышается.
Изменение энтальпии при растворнии одного моля вещества называется энтальпией растворения этого вещества (ΔН).
Процесс растворения сопровождается значительным возрастанием энтропии, ∆S>0, т.к. в результате равномерного распределения частиц одного вещества в другом резко возрастает число макросостояний системы. Поэтому, несмотря на то, что для большинства кристаллов ∆Н>0, ΔG<0 из-за большого значения энтропийного фактора – и процесс растворения самопроизвольный.
При растворении кристаллов происходит их разрушение, что требует затраты энергии, поэтому растворение должно сопровождаться поглощением теплоты. Если же наблюдается обратный эффект, то это показывает, что происходит взаимодействие между растворителем и веществом, при котором выделяется энергия.
Установлено, что при растворении многих веществ их молекулы или ионы связываются с молекулами растворителя, образуя сольваты (гидраты). Этот процесс называется сольватация или гидратация. Подтверждением химизма растворения служит тот факт, что многие вещества выделяются из растворов в виде кристаллов, содержащих кристаллизационную воду. Это кристаллогидраты, а вода в них – кристаллизационная.
Процесс образования гидратов протекает с выделением теплоты. При растворении вещества, подвергающегося гидратации, общий тепловой эффект складывается из теплового эффекта разрушения кристаллической решетки твердого растворяемого вещества и теплового эффекта гидратации. Первый процесс – эндотермический, а второй – экзотермический. Общий тепловой эффект процесса, равный алгебраической сумме тепловых эффектов двух стадий, может быть больше нуля или меньше нуля.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях служит содержание его в насыщенном растворе. Чаще всего растворимость – это число граммов вещества, насыщающего при данных условиях 100г растворителя (коэффициент растворимости). При этом, если в 100г воды растворяется более 10г вещества, то такое вещество принято считать хорошо растворимым, если растворяется менее 1г вещества – малорастворимым и, наконец, практически нерастворимым, если в раствор переходит менее 0,01г вещества.
Растворение сопровождается выделением или поглощением тепла, следовательно, повышая или понижая температуру можно менять растворимость, согласно принципу Ле Шателье.
При растворении твердых тел в воде объем системы изменяется незначительно, поэтому растворимость твердых веществ практически не зависит от давления.
Растворимость большинства веществ уменьшается с понижением температуры, поэтому при охлаждении горячих насыщенных растворов избыток растворенного вещества обычно выделяется. Однако, если производить охлаждение осторожно и медленно, то выделения его из раствора может не произойти. В этом случае получится раствор, содержащий значительно больше растворенного вещества, чем его требуется для наыщения при данной температуре. Такие растворы называются пересыщенными. В спокойном состоянии они могут оставаться без изменения длительное время. Но стоит только бросить в такой раствор кристаллик того вещества, которое в нем растворено, как тотчас же вокруг него начинают расти другие кристаллы и через короткое время весь избыток растворенного вещества выкристаллизовывается.Иногда кристаллизация начинается от простого сотрясения раствора. При кристаллизации выделяется значительное количество теплоты.
Следовательно, пересыщенные растворы являются неустойчивыми системами, способными к существованию только при отсутствии в системе твердых частиц растворенного вещества.
Растворение газов в воде представляет собой экзотермический процесс. Поэтому растворимость газов с повышением температуры уменьшается. Если оставить в теплом помещении стакан с холодной водой, то внутренние стенки его покроются пузырьками газа – это воздух, который был растворен в воде, выделяется из нее вследствие нагревания. Кипячением можно удалить из воды весь растворенный в ней воздух ( деаэрация). Однако растворение газов в некоторых органических жидкостях сопровождается поглощением теплоты; в подобных случаях растворимость газов с ростом температуры увеличивается. Поглощение теплоты в данном случае происходит из-за того, что энергия межмолекулярного притяжения между молекулами растворителя оказывается по модулю больше, чем энегрия притяжения между молекулами газа и растоврителя в растворе. Растворение происходит за счет увеличения энтропии системы, а молекулы газа, “внедряясь” между молекулами растворителя, затрачивают энергию на разрыв сил сцепления молекул жидкости между собой. Такие процессы возможны между веществами, резко отличающимися по своей природе: неполярным газом и полярной жидкостью и т.п.
При растворении газа в жидкости устанавливается равновесие:
Газ + Жидкость ↔ Насыщенный раствор газа в жидкости
При этом объем системы существенно уменьшается. Следовательно, повышение давления должно приводить к смещению равновесия вправо, т.е. к увеличению растворимости газа.
К этому же выводу можно прийти, исходя из динамического характера равновесия между газом и его раствором в жидкости. Молекулы газа, находящиеся над жидкостью в закрытом сосуде, бомбардируют поверхность жидкости и растворяются в жидкости со скоростью, пропорциональной концентрации газ. Перешедшие в раствор молекулы в свою очередь время от времени ударяются о поверхность жидкости изнутри и вылетают наружу. По мере того как в результате растворения концентрация растворенных молекул будет увеличиваться, скорость их выделения тоже будет расти, пока, наконец, не сравняется со скоростью растворения. В результате установится состояние равновесия, т.е. жидкость станет насыщенной газом.
Если теперь увеличить давление газа, например, в 2 раза, то востолько же раз увеличится и концентрация его молекул над жидкостью, а следовательно, и скорость растворения газа. Равновесие нарушится. Чтобы при новом давлении снова установилось равновесие, концентрация растворенных молекул тоже должна увеличиться вдвое. Таким образом, приходим к выводу, который известен под названием закона Генри:
масса газа, растворяющегося при постоянной температуре в данном объемежидкости, прямо пропорциональна парциальному давлению газа.
ωВ = k·p,
где ωВ – массовая доля газа в насыщенном растворе; р – парциальное давление газа; k – коэффициент пропорциональности, называемый констаной Генри.
Следствие закона Генри: объем газа, растворяющегося при постоянной температуре в данном объеме жидкости, не зависит от его парциального давления.
Газы подчиняются закону Генри при не очень высоких давлениях и лишь в случае, когда онине вступают в химическое взаимодействие с растворителем. При высоких давлениях отклонения от закона Генри наблюдаются и при растворении химически не взаимодействующих с растворителем газов.
Растворы электролитов.
В предыдущей лекции мы познакомились с законами, которым подчиняются разбавленные растворы. Справедливость этих законов подтверждается результатами многих экспериментов. Однако имеются вещества, растворы которых сильно отклоняются от всех рассмотренных законов. К подобным веществам относятся соли, кислоты и щелочи. Водные растворы этих веществ обладают еще одной особенностью – они проводят электрический ток. С. Аррениус (1887г.) обратил внимание на тесную связь между способностью растворов солей, кислот и оснований проводить электрический ток и отклонениями растворов этих веществ от законов Рауля и Вант-Гоффа. Аррениус предположил, что при взаимодействии растворимого вещества с растворителем происходит ионизация частиц растворяемого вещества.
Распад вещества на сольватированные ионы под действием молекул растворителя называется электролитической диссоциацией.
Вещества, которые при растворении образуют заряженные частицы, называются электролитами (это проводники электрического тока второго рода, а проводники электрического тока первого рода – металлы). Их делят на сильные и слабые электролиты.
К сильным электролитам относят: кислоты -
HCl, HNO3, H2SO4, HСlO4, гидроксиды щелочных и щелочноземельных металлов, все растворимые в воде соли.
К слабым электролитам относятся: органические кислоты, минеральные кислоты: HCN, H2S,H3PO4 и др. плохо растворимые в воде основания и соли.
Способность к электролитической диссоциации зависит не только от самого электролита, но и от растворителя.
По закону Кулона электростатическое притяжение (F) двух разноименных зарядов (e1 и е2), расстояние между которыми r
![]()
 – диэлектрическая
проницаемость среды – показывает во
сколько раз силы взаимодействия между
зарядами в данной среде меньше, чем в
вакууме, т.е. чем больше диэлектрическая
проницаемость среды, тем слабее
взаимодействуют между собой частицы,
тем вероятнее произойдет ионизация
молекул.
– диэлектрическая
проницаемость среды – показывает во
сколько раз силы взаимодействия между
зарядами в данной среде меньше, чем в
вакууме, т.е. чем больше диэлектрическая
проницаемость среды, тем слабее
взаимодействуют между собой частицы,
тем вероятнее произойдет ионизация
молекул.
Самой высокой диэлектрической проницаемостью обладает вода. Именно поэтому в водной среде максимально ослабляется электростатическое притяжение разноименно заряженных ионов. В растворителях с малой диэлектрической проницаемостью ионы продолжают достаточно сильно притягиваться друг к другу, оставаясь в виде ионных пар. Большая диэлектрическая проницаемость воды не является единственной причиной ее высоеого ионизирующего действия. Дипольный характер молекул воды, обладающих неподеленными электронными парами, обусловливает ее значительную спосоьность к образованию гидратированных ионов за счет донорно-акцепторного взаимодействия, а выделяющаяся при этом энергия гидратации ионов компенсирует энергию, необходимую для преодоления сил электростатического притяжения ионов в кристаллической решетке вещества.
Сильные электролиты
Для сильных электролитов характерна полная диссоциация на ионы в растворе:
AB = A++B-.
В растворе образуются гидратированные ионы вещества. Между заряженными частицами существует электростатическое взаимодействие.
Активность иона:
a = fc,
где a – активность иона,
c - молярная концентрация, моль/л
f - коэффициент активности, л/моль
Активность – это доля общего числа ионов, которая влияет на электрическую проводимость раствора, давление пара, температуру кристаллизации, кипения и другие свойства раствора. Активность зависит не только от концентрации одного иона, но и от концентрации других ионов, находящихся рядом. Чтобы учесть влияние других ионов, находящихся рядом, вводят понятие ионная сила растворов ().
![]() ,
,
где Cm – моляльные концентрации ионов (это количество молей растворенного вещества в одном литре растворителя), Z – заряд иона.
Пример: Вычислить ионную силу 0,01М раствора Ca(NO3)2 , к 1л которого добавили 0,05моль NaCl .
Ca(NO3)2 Ca2+ + 2NO3-;
0,01 0,02
NaCl Na+ + Cl-
0,05 0,05
[Ca2+] = 0,01; [NO-3] = 0,02; [Na+] = 0,05; [Cl-] = 0,05
= 1/2(0,0122 + 0,0212 +0,0512 + 0,0512) = 0,08
При одной и той же ионной силе коэффициент активности f зависит от заряда иона. Ионы с высоким зарядом обладают повышенной способностью к образованию ионных ассоциатов, поэтому их коэффициент активности снижается. В разбавленных растворах с одинаковой ионной силой коэффициенты активности ионов, обладающих одинаковыми зарядами, примерно одинаковы.
Пример: Вычислить ионную силу раствора и активность ионов меди в 0,025M растворе CuSO4.
CuSO4 = Cu2+ + SO42-
= 1/2(0,02522 + 0,02522) = 0,1
f = 0,33 – из таблицы
a(Cu2+ )= a(SO42- ) = 0,330,025 = 8,2510-3
Для очень разбавленных растворов зависимость коэффициента активности от ионной силы раствора выражается уравнением Дебая-Гюккеля:

Слабые электролиты
Слабые электролиты не полностью диссоциированы в растворе. Существует равновесие между диссоциированной частью и недиссоциирующими молекулами:
![]()
Так как в растворах слабых электролитов концентрации ионов невелики, для расчетов мы можем пользоваться концентрацией ионов, а не их активностью.
Степень диссоциации слабого электролита - это отношение числа распавшихся на ионы молекул к общему числу молекул:
число
распавшихся молекул =
-------------------------------
общее число
молекул
Степень диссоциации зависит от природы электролита и растворителя, от концентрации и от температуры.
Как для всякой обратимой реакции, для уравнения электролитической диссоциации слабого электролита мы можем написать выражение для константы равновесия:
![]() ,
которая является константой
электролитической диссоциации.
,
которая является константой
электролитической диссоциации.
Константа электролитической диссоциации не зависит от концентрации вещества, а зависит только от температуры и природы веществ.
Если концентрация [HA] = C, то [H+] = [A-] = Cα
![]()
Для
растворов с небольшой концентрацией
< 0,1 и К
С2,
тогда
![]() - это выражение - закон
разбавления Оствальда или
закон действующих масс для растворов
слабых электролитов. Согласно этому
закону при разбавлении раствора
(уменьшении концентрации) степень
диссоциации увеличивается. Степень
диссоциации увеличивается также и при
увеличении температуры раствора.
- это выражение - закон
разбавления Оствальда или
закон действующих масс для растворов
слабых электролитов. Согласно этому
закону при разбавлении раствора
(уменьшении концентрации) степень
диссоциации увеличивается. Степень
диссоциации увеличивается также и при
увеличении температуры раствора.
Расчет концентрации ионов водорода в растворе слабой кислоты.
![]()
![]()
![]()
![]()
В
растворе слабого основании аналогично
![]()
Вода. Водородный показатель.
Вода является весьма слабым электролитом, ее диссоциация выражается уравнением
H2O H+ + OH-
H+ + H2O H3O+
Свободных ионов водорода в воде нет.
[H2O] = C исх
С исх = 1000г/18г = 55,55 моль/л. – концентрация воды.
Кравн. [H2O] = const = [H+][OH-] = 1,810-1655,55 = 110-14
![]()
т.е. [H+][OH-] = 110-14 = K - ионное произведение воды.
В любом растворе присутствуют как ионы водорода, так и ионы гидроксила, но в разных количествах.
Нейтральная среда:
![]()
Кислая среда:
[H+] > 10-7 , т.е. [H+] = 10-6; 10-5
[OH-] = 10-8; 10-9
Щелочная среда:
[H+] < 10-7 , т.е. [H+] = 10-8; 10-9;10-10
[OH-] = 10-6; 10-5; 10-4
Водородный показатель среды:
pH = - lg[H+]; pOH = - lg[OH-]
В нейтральной среде: pH = 7 = pOH.
В кислой среде: pH < 7; pOH > 7.
В щелочной среде: pH > 7; pOH < 7.
pOH = 14 – pH
Ионное произведение воды зависит от температуры, так как степень диссоциации воды зависит от температуры.
При t = 0; K = 0,11410-14
![]()
pH = - lg[H+] = 7,47; т.е. при 0 - pH нейтральной среды > 7.
При t = 50
![]()
pH = 6,63
Пример 1:
Расчет водородного показателя:
См = 0,1 М
Ккисл = 1,810-4

Вычислить pH в водном растворе муравьиной кислоты:
![]()
pH = - lg 4,210-3 = 2,38 – кислая среда.
Для слабых электролитов можно использовать концентрацию ионов, а не понятие активности.
Пример 2:
Вычислить рН в 0,25М растворе хлорной кислоты.
Хлорная кислота – сильный электролит, следовательно для расчетов нужно использовать активность ионов , а не концентрацию.
HClO4 = H+ + ClO4-
![]()
![]()
f = 0,681.
аH+ = f[H+] = 0,250,681 = 0,17
pH = - lg0,17 = 0,77 – очень кислая среда.
Гидролиз солей.
Гидролиз – это взаимодействие веществ с водой.
Гидролиз можно охарактеризовать степенью гидролиза: h
гидролизованные
ионы h
= ---------------------------------
общая
концентрация соли
Степень гидролиза зависит
-
от природы соли и выражается константой гидролиза,
-
от концентрации,
-
от температуры (чем выше температура, тем больше степень гидролиза).
Соли полнлстью, необратимо диссоциируют в растворе на ионы. При этом, если соль образована сильным основанием и сильной кислотой, то образованные в растворе ионы не вступают во взаимодействие с водой и не образуют с ней сложных веществ. Концентрация ионов гидроксила и ионов водорода не меняется, т.е. pH 7 (среда нейтральная).
Пример: NaCl = Na+ + Cl- - это не гидролизующиеся соли.
1). Рассмотрим соли, образованные слабой кислотой и сильным основанием:
NaNO2, CH3COONa, HCOOK (формиат калия), Na3PO4
CH3COONa = CH3COO- + Na+
С водой будет взаимодействовать анион слабой кислоты
CH3COO- + H2O CH3COOH + OH- (накапливаются ионы гидроксила).
В растворах этих солей pH > 7 (среда щелочная).

 -
константа
гидролиза.
-
константа
гидролиза.
Равновесие
гидролиза характеризуется константой
гидролиза. Подставим в это выражение
концентрацию ионов гидроксила, выраженную
через ионное произведение воды:![]()
В
этом уравнении
![]() ,
отсюда получаем
,
отсюда получаем
![]() -
константа
гидролиза соли, образованной слабой
кислотой и сильным основанием
-
константа
гидролиза соли, образованной слабой
кислотой и сильным основанием
Расчет степени гидролиза:
c - ch ch ch
CH3COO - + H2O CH3COOH + OH -
c – исходная концентрация соли;
h – степень гидролиза;
ch – концентрация прогидролизовавшихся молекул.
![]()
![]()
Расчет рН среды:
A - +H2O HA + OH - ; (A – анионы кислоты)
![]()
[HA] = [OH-] (h<<1)
![]()
[OH-][H+] = 10-14 pOH = - lg[OH-] (pH = 14 – pOH).
2). Рассмотрим соли, образованные сильной кислотой и слабым основанием:
NH4OH, NH4Cl, NH4NO3, CuSO4
NH4Cl = NH4+ + Cl-
NH4+ +H2O NH4OH + H+
В растворах этих солей pH < 7 (среда кислая).
Напишем выражение для константы равновесия этой реакции:
 ,
,

Подставив в это уравнение выражение для [H+] через ионное произведение воды, получаем

![]()
Степень гидролиза:
Расчет рН раствора:
c - ch ch ch
NH4+ + H2O NH4OH + H+
![]()
Пример:
рассчитать степень гидролиза нитрата
аммония и pH
раствора, где См=0,1моль/л,![]()
Кг. = Кω/Косн. = 10-14/1,7610-5 = 5,710-10 (константа гидролиза)
![]()
(степень
гидролиза)
![]() моль/л
моль/л
pH = - lg 7,55 10 –6 = 5,1
3). Соли, образованные слабым основанием и слабой кислотой:
CH3COONH4 (ацетат аммония), NH4CN (цианид аммония), NH4HCOO (формиат аммония).
CH3COONH4 = CH3COO - + NH4+
c – ch c – ch ch ch
CH3COO -+ NH4+ + H2O CH3COOH + NH4OH
В растворах этих солей pH 7 (среда нейтральная).
Если же константы диссоциации кислоты и основания сильно различаются, среда не будет нейтральной, например:
NH4CN + H2O NH4OH + HCN
К(NH4OH) = 10-5; K(HCN) = 6,210-10
Гидролиз будет идти сильнее по аниону:
N H4+
+ H2O
NH4OH
+ H+ [OH-]
> [H+]
H4+
+ H2O
NH4OH
+ H+ [OH-]
> [H+]
CN- + H2O HCN + OH-
Напишем выражение для константы равновесия гидролиза ацетата аммония:
![]() ,
здесь
,
здесь
![]() ,
тогда, умножив и разделив константу
гидролиза на ионное произведение воды,
получаем:
,
тогда, умножив и разделив константу
гидролиза на ионное произведение воды,
получаем:
![]() или
или
![]() ,
откуда
,
откуда
![]()
Расчет степени гидролиза:
![]()
![]()
Расчет рН:
![]()
Kк. [H+]; Kосн. [OH-]
![]()
![]()
Смещение равновесия гидролиза
1.
![]()
По принципу Ле-Шателье уменьшение концентрации ионов водорода сместит равновесие вправо, т.е. усилит гидролиз. Чтобы усилить гидролиз, нужно добавить сильную щелочь, связывающую ионы водорода.
Добавление ионов водорода (кислоты) – подавляет гидролиз, смещая равновесие гидролиза влево.
2.
![]()
Добавление сильной кислоты (Н+) сместит равновесие гидролиза вправо, так как при этом будут связываться ионы гидроксила. Добавление щелочи подавляет гидролиз.
3. Гидролиз проходит до конца, если в результате получаются не растворимые в воде соединения и газы.
Например:
![]()
Соли, образованные многозарядными катионами (Cr3+, Fe3+, Al3+) и очень слабыми кислотами (угольной, сернистой, сероводородной, кремниевой) – в водном растворе не существуют, так как подвергаются необратимому гидролизу.
Окислительно-восстановительные реакции
Все реакции можно разделить на две группы. В одних реакциях не меняется степень окисления атомов – это реакции обмена, некоторые реакции синтеза и распада веществ.
В других реакциях степень окисления атомов меняется. Это окислительно-восстановительные реакции. В них происходит переход электронов от одних атомов к другим, при этом изменяется степень окисления. Степень окисления - это число электронов, смещённых от одного атома к другому.
Если общие электронные пары не смещены ни к одному из атомов, то степень окисления равна нулю. Если же общая электронная пара смещена к одному из атомов, обладающему большей электроотрицательностью, то этот атом приобретает отрицательную степень окисления. Атом, от которого смещены электроны, приобретает положительную степень окисления.
Постоянную степень окисления +1 имеют щелочные металлы, постоянную степень окисления проявляют Zn2+, Ca2+, Al3+,O2-, H+(в соединениях с неметаллами), F-.
В окислительно-восстановительных реакциях происходят одновременно два процесса: окисление и восстановление.
Окислением называют процесс отдачи электронов, сопровождающийся повышением степени окисления.
Например, Zn0 + Cu2+SO4 = Cu0 + Zn2+SO4,
Zn0 - 2e = Zn2+ - процесс окисления
Zn0 - восстановитель.
Присоединение или взятие электронов, сопровождающееся понижением степени окисления, называют восстановлением.
Cu2+ + 2e = Cu0 – восстановление,
Сu2+- окислитель.
Восстановителями называют атомы или ионы, отдающие электроны и повышающие свою степень окисления.
Восстановителями могут быть атомы металлов, атомы неметаллов, имеющие низкие степени окисления в различных соединениях.
Пример:
Na2S4+O32-, S4+ – восстановитель.
NaN3+O2 , N3+ – восстановитель.
Fe2+Cl2, Fe2+ – восстаноситель.
H2S2-, S2- – восстановитель.
Окислителями называют атомы или ионы, принимающие электроны, и понижающие свою степень окисления.
Окислителями могут быть неметаллы с высокой электроотрицательностью. Например, галогены, кислород, а так же различные соединения, в которых атомы неметаллов и металлов находятся в высшей положительной степени окисления.
Пример:
H2S6+O4, S6+ – окислитель.
HN5+O3, N5+ – окислитель.
K2Cr26+O7, Cr6+ – окислитель.
KMn7+O4, Mn 7+– окислитель.
Типы окислительно-восстановительных реакций.
-
межмолекулярные реакции. Связаны с изменением степени окисления атомов в разных молекулах.
2Mg0 + O20 = 2Mg2+O2-
Al0 + Fe3+ 2O3 = Fe0 + Al23+O3
-
внутримолекулярные окислительно-восстановительные реакции. Происходит изменение степени окисления разных атомов в одной молекуле.
(N3-H4)2Cr27+O7 = N20 + Cr23+O3 + H2O
-
реакции диспропорционирования. Реакции самоокисления, сомовосстановления. В этих реакциях одновременно происходит понижение и повышение степени окисления одного и того же элемента.
N4+O2 + H2O = HN3+O2 + HN5+O3
-
реакции контрдиспропорционирования. Это внутримолекулярные реакции, в которых происходит выравнивание степеней окисления элементов.
(N3-H4)2N3+O2 = N20 + H2O
Влияние среды на характер реакции:
а) Нередко от среды зависят продукты взаимодействия:
 Mn2+
- в кислой среде
Mn2+
- в кислой среде
M nO
MnO2
– в нейтральной среде
nO
MnO2
– в нейтральной среде
 MnO
– в щелочной среде
MnO
– в щелочной среде
Для создания кислой среды используют разбавленную серную кислоту. Для создания щелочной среды берут сильные щёлочи.
б) Часто влияние среды проявляется в том, что некоторые элементы в одной и той же степени окисления могут существовать в разных формах в зависимости от среды:
K2Cr6+O4 – хромат (щелочная среда)
K2Cr26+O7 - дихромат (кислая среда).
Cr3+ - в кислой среде,
[Сr(OH)6]3- - в щелочной среде.
Составление уравнений окислительно-восстановительных реакций.
Любая окислительно-восстановительная реакция состоит из двух полуреакций: окисления и восстановления.
Условием для окислительно-восстановительной реакции является равенство числа отданных и принятых электронов.
Рассмотрим общие правила составления уравнений окислительно-восстановительных реакций методом электронно-ионного баланса на примере взаимодействия иодоводорода с концентрированной серной кислотой:
2HI + H2S6+O4 (к) = I20 + H2S4+O3 + H2O
1) Выявить роль участников процесса:
HI – восстановитель, H2SO 4 (к) – окислитель.
2) Составить электронно-ионные уравнения полуреакций:

 1
2HI
- 2e
= I20
+ 2H+
окисление
1
2HI
- 2e
= I20
+ 2H+
окисление
HI - восстановитель
1 SO42- + 2e +2H + = SO32- + H2O восстановление
SО42- - окислитель.
2НI+ SO42- + 2H+ = I20 + SO32- + H2O + 2Н+– суммарное ионное уравнение. Подобные члены в левой и правой частях уравнения сокращаем (2Н+) и переносим коэффициенты в молекулярное уравнение.
Основы электрохимии
При окислительно-восстановительных реакциях происходит переход электронов от восстановителя к окислителю, при этом один элемент окисляется, а другой восстанавливается. Можно проводить эту реакцию таким образом, чтобы процессы окисления и восстановления были пространственно разделены, а электроны перемещались от восстановителя к окислителю по внешней цепи. Такой направленный поток электронов называется электрическим током.
Устройства, при помощи которых химическая энергия превращается в электрическую, называются гальваническими элементами, или химическими источниками электрической энергии (ХИЭЭ).
Рассмотрим, например гальванический элемент Якоби – Даниэля:

1. Рассмотрим процессы, происходящие на пластинах, когда цепь разомкнута:
Zn – 2e = Zn2+, на цинковой пластинке накапливаются электроны;
Cu – 2e = Cu2+, на медной пластинке тоже накапливаются электроны, но т.к. медь менее активный металл, то на медной пластинке электронов меньше. В системе устанавливается равновесие, т.е. скорость растворения металла равна скорости осаждения
2. При замыкании цепи электроны с цинковой пластинки перетекают на медную, т. к. на цинковой пластинке их больше, при этом равновесие нарушается и для его достижения новые порции цинка будут растворяться. На медной пластине, куда пришли дополнительные электроны с цинка, для установления равновесия начнется процесс осаждения меди.
Z n
– 2e
Zn2+,
равновесие смещается в сторону растворения
цинка;
n
– 2e
Zn2+,
равновесие смещается в сторону растворения
цинка;
C u
– 2e
Cu2+,
равновесие смещается в сторону осаждения
меди.
u
– 2e
Cu2+,
равновесие смещается в сторону осаждения
меди.
Т.о., цинковая пластина начинает растворяться, а на медной пластине начинает осаждаться медь, пока равновесие не восстановится.
Схематично такой гальванический элемент обозначают:
А


 Zn
ZnSO4
CuSO4
Cu K
Zn
ZnSO4
CuSO4
Cu K
Электрод, на котором происходит окисление, называется анодом (здесь анод – Zn), электрод, на котором происходит восстановление, называется катодом (Cu).
Электрический ток, протекающий по внешней цепи, может совершать полезную работу: Amax = nFE. Полезная работа равна произведению количества прошедшего электричества на напряжение, здесь n – число электронов, участвующих в окислительно-восстановительном процессе, F – число Фарадея (F = 96500 Кл/моль), E – электродвижущая сила гальванического элемента (ЭДС).
ЭДС гальванического элемента - это максимальное значение напряжения гальванического элемента.
E = Ек – Еа, где Ек – электродный потенциал катода;
Еа – электродный потенциал анода.
Электродные потенциалы возникают на границе раздела фаз – металл – электролит.
Абсолютное значение электродных потенциалов измерить невозможно, поэтому измеряют ЭДС цепи, состоящей из исследуемого электрода и электрода сравнения, потенциал которого условно равен 0. Обычно электродами сравнения служат водородный, каломельный (Hg2Cl2 – Hg) или хлорсеребряный (AgCl –Ag) электрод.
Устройство водородного электрода и электрохимической цепи для измерения ЭДС:

Исследуемый металл может оказаться анодом или катодом.
Рассмотрим два случая:
1). Активные металлы: Zn, Al, Mg.
анодный процесс: Zn – 2e = Zn2+;
к
 атодный
процесс: 2H+
+ 2e
= H2
.
атодный
процесс: 2H+
+ 2e
= H2
.
А Zn|ZnSO4 ||H2SO4|Pt(H2) K
E = EK – EA > 0, если EK = 0 EA < 0, т. е. потенциалы активных металлов имеют отрицательные значения.
2 ).
Предположим, что исследуемый металл
неактивен, например медь. Тогда происходит
процесс окисления водорода – анодный
процесс. Водородный электрод в этом
случае будет являться анодом.
).
Предположим, что исследуемый металл
неактивен, например медь. Тогда происходит
процесс окисления водорода – анодный
процесс. Водородный электрод в этом
случае будет являться анодом.
А Pt(H2)|H2SO4
||CuSO4
|Cu K
Pt(H2)|H2SO4
||CuSO4
|Cu K
анодный процесс: H2 – 2e = 2H+;
катодный процесс: Cu2+ + 2e = Cu0.
E = EK – EА > 0, если EA = 0 EК > 0, т. е. потенциалы неактивных металлов имеют положительные значения.
Таким образом, составляется ряд напряжения металлов. Значения электродных потенциалов относительно водородного потенциала выводятся в таблицу.
Стандартные электродные потенциалы измеряют при стандартных условиях, т.е. концентрации ионов, участвующих в реакции составляет 1 моль/л, давление газов – 101325Па, Т = 2980 К
Стандартные электродные потенциалы обозначаются так: E[B]. Значения электродных потенциалов зависят от природы металла, от концентрации веществ, участвующих в процессе и от температуры системы. Эта зависимость выражается уравнением Нернста:
![]()
где: Е – стандартный электродный потенциал;
R
– универсальная газовая постоянная ≈
8,314![]() ;
;
Т – абсолютная температура;
n – число электронов, участвующих в окислительно-восстановительном процессе.
[Ox] – концентрация ионов в окисленной форме;
[Red] – концентрация ионов в восстановленной форме.
При
подстановке постоянных уравнение
принимает вид:
![]() .
.
Для полуреакции окисления металла:
Me° – ne = Men+
Red Ox
![]() .
.
Н



 асколько
же концентрация влияет на потенциал?
Например, в медно-цинковом электроде,
где анодом является цинк:
асколько
же концентрация влияет на потенциал?
Например, в медно-цинковом электроде,
где анодом является цинк:
А Zn ZnSO4 CuSO4Cu К E0 = 0,34 – (–0,76) = 1,1B.
![]() =
+ 0,34B;
=
+ 0,34B;
![]() = – 0,76B;
= – 0,76B;
Пусть [ZnSO4] = 0,1 М; [CuSO4] = 0,01 M, тогда
ЭДС
= ЕK
– EA=![]() 0,34
+0,3∙2 + 0,76 +0,03 =1,07 В.
0,34
+0,3∙2 + 0,76 +0,03 =1,07 В.
Электродный потенциал водородного электрода.
2H+ + 2e = H2
Ox Red
 Если
мы имеем дело с газами, то заменяем
концентрацию парциальным давлением
(P(H2)
= 1атм.).
Если
мы имеем дело с газами, то заменяем
концентрацию парциальным давлением
(P(H2)
= 1атм.).
E = E° + 0,059 lg[H+]; Е° = 0; Е = 0,059 lg[H+] или Е = -0,059рН
В нейтральной среде:
[H+] = 10–7; Е = – 0,41В.
Стандартный электродный потенциал - это потенциал данного электродного процесса при Т = 298 К, р = 101325Па и концентрации всех участвующих веществ 1моль/л.
Понятие об электролизе.
Электролиз – электрохимический процесс, протекающий на электродах при наложении внешней разности потенциалов от сети, т. е. электролиз это не самопроизвольный процесс, он осуществляется за счёт подвода энергии извне (G > 0).
Электрод, который подключён к отрицательному полюсу источника тока, называется катодом, электрод, который подключён к положительному полюсу – анодом.
Существуют различные виды электролиза, в том числе с растворимым и нерастворимым анодом.
-
Рассмотрим электролиз с нерастворимым анодом.
Нерастворимый анод выполняют из графита или платины. Рассмотрим электролиз раствора CuCl2, если электроды графитовые.
CuCl2 = Cu2+ + 2Cl–
При подключении источника тока, ионы приобретают направленное движение и протекают два процесса:
анодный процесс: 2Cl– – 2e = Cl2
катодный процесс: Cu2+ + 2e = Cu0
_______________________________
![]()
Роль источника тока заключается в перекачивании электронов с анода на катод. Таким образом, происходит электролиз раствора меди с нерастворимым электродом.
2. Рассмотрим электролиз с растворимым анодом. В качестве растворимого анода используют хром, никель, железо, серебро, медь и др.
Пример: CuCl2 = Cu2+ + 2Cl-, оба электрода выполнены из меди. Рассмотрим процессы, происходящие при электролизе:
анодный
процесс:
а) 2Cl–
–2e
= Cl2,
при этом:
![]() =
+ 1,358 В.
=
+ 1,358 В.
б)
Cu
– 2e
= Cu2+,
![]() =
+ 0,34 В.
=
+ 0,34 В.
Электродный потенциал полуреакции б) ниже и, следовательно, будет преобладать этот процесс.
катодный процесс: Cu2+ + 2e = Cu0.
Электролиз с растворимым анодом часто используется для нанесения металлических покрытий на изделия из металла (хромирования, цинкования или никелирования металлов).
Рассмотрим никелирование металлического изделия. Для этого в качестве электролита используем NiSO4.

анодный процесс: Ni – 2e = Ni2+
катодный процесс: Ni2+ + 2e = Ni0
Электролиз с растворимым анодом используют для очистки металлов, в частности, черновую медь очищают, используя её в качестве анода (рафинирование металлов).

анодный процесс: Cu – 2e = Cu2+
катодный процесс: Cu2+ + 2e = Cu0
При электролизе водных растворов анодный и катодный процессы могут быть осложнены окислением или восстановлением молекул воды или ее ионов.
Например:
анодный процесс: 2H2O – 4e = 4H+ + O2
4OH– – 4e = 2H2O + O2
катодный процесс: 2H2O + 2e = H2↑ + 2OH–
2H+ + 2e = H2↑
Рассмотрим случай электролиза с участием воды:
MgCl2
![]() =
– 2,37 В.
=
– 2,37 В.
![]() =
– 0,41 В.
=
– 0,41 В.
анодный процесс: 2Cl– –2e = Cl2
катодный процесс: Mg2+ + 2e = Mg0
2H2O + 2e = H2 + 2OH–
Сравнив электродные потенциалы полуреакций, выясняем, что будет преобладать процесс восстановления воды. Следовательно, катионы активных металлов не восстанавливаются при электролизе водных растворов. Катион аммония (NH4+) ведет себя как ионы щелочных металлов.
При электролизе водных растворов электролитов следует помнить, что в обычных условиях не происходит анодного окисления анионов кислородсодержащих кислот (NO3-, SO42- и др.). В этом случае происходит окисление воды.
Зависимость количества вещества, образовавшегося при электролизе, от времени и силы тока описывается обобщенным законом Фарадея:
![]() ,
где
,
где
m - масса образовавшегося при электролизе вещества (г)
Э – эквивалентная масса вещества (г/моль)
М – молярная масса вещества (г/моль)
n – количество отдаваемых или принимаемых электронов
I – сила тока (А)
t – продолжительность процесса (с)
F – константа Фарадея, характеризующая количество электричества, необходимое для выделения 1 эквивалентной массы вещества (F = 96500 Кл/моль)
Электрохимия и окислительно-восстановительные реакции
В гальваническом элементе можно измерить электродные потенциалы полуреакций относительно стандартного электрода.
Например: MnO4– + e = MnO42– ;
В
таблицах приведены стандартные
электродные потенциалы для полуреакций
восстановления:
![]() =
+0,56В. Значение электродного потенциала
при восстановлении равно его значению
при окислении.
=
+0,56В. Значение электродного потенциала
при восстановлении равно его значению
при окислении.
Пример:
2KMnO4 + 2NaOH + Na2SO3 = K2MnO4 + Na2MnO4 + NaSO4 + H2O
2
 MnO4–
+ e
= MnO42–
восстановление
MnO4–
+ e
= MnO42–
восстановление
MnO4– – окислитель
1 SO32– + 2OH– – 2e = SO42– + H2O окисление
 SO32–
– восстановитель
SO32–
– восстановитель
2MnO4– + SO32– + 2OH– = 2MnO42– + SO42– + H2O
![]() =
=
![]() = + 0,56B,
= + 0,56B, ![]() = – 0,93В.
= – 0,93В.
Вещества, обладающие более положительным или менее отрицательным электродным потенциалом, являются окислителями, вещества с менее положительным или более отрицательным потенциалом являются восстановителями.
Если эту реакцию проводить в гальваническом элементе, то работа гальванического элемента определяется так: Amax = nFE, где E = EK – EA . На катоде происходит восстановление окислителя, значит, Ек = Еокисл., соответственно, Еа= Евосстан.
E = Eокисл. – Eвосстан. = 0,56 + 0,93 =1,49В.
Работа происходит за счёт убыли свободной энергии, следовательно:
Amax = – G; G = - nFE .
Если при этом E > 0, то G < 0 – условие самопроизвольности окислительно-восстановительного процесса. E > 0 если Eокисл. > Eвосстан., т.о. самопроизвольность протекания процесса можно определить без проведения реакции.
Рассмотрим влияние среды на значение электродного потенциала.
Напишем уравнение Нернста для данной реакции:
![]() =
E° +
=
E° +
![]() =
=
![]() +
0,059(lg[MnO4–]
– lg[MnO42–])
+
0,059(lg[MnO4–]
– lg[MnO42–])
![]() =
E°
+
=
E°
+
 E°
+
E°
+![]() .
.
Вывод: чем больше концентрация гидроксила, тем легче пойдёт окисление SO32– в SO42– , т.к. потенциал восстановителя понижается при увеличении концентрации ионов гидроксила, при этом увеличивается Е.
Рассмотрим влияние кислой среды:
KMnO4 + KNO2 + H2SO4 = 2MnSO4 + 5KNO3 + 3H2O + K2SO4

 2
MnO4–
+ 8H+
+ 5e
= Mn2+
+ 4H2O
восстановление
2
MnO4–
+ 8H+
+ 5e
= Mn2+
+ 4H2O
восстановление
MnO4– – окислитель
5 NO2– + H2O – 2e = NO3– + 2H+ окисление
NO2– – восстановитель

2MnO4– + 16H+ + 5NO2– + 5H2O = 2Mn2+ + 8H2O + 5NO3– + 10H+
![]() =
1,23 B
= Eокисл.
=
1,23 B
= Eокисл.
![]() =
0,8 В = Евосст.
E
= 0,43 В > 0, G
< 0.
=
0,8 В = Евосст.
E
= 0,43 В > 0, G
< 0.
![]() =
E°
+
=
E°
+
 E°
+
E°
+![]()
Вывод: чем больше концентрация ионов водорода, тем большими окислительными свойствами обладает перманганат - ион
![]() =
E°
+
=
E°
+ = E°
+
= E°
+
![]()
Таким образом, при определённых условиях (в присутствии более сильного окислителя) нитрит-анион может быть восстановителем, а может выступать и в качестве окислителя в кислой среде, т.к. повышение кислотности среды повышает электродный потенциал нитрит-аниона.
Химические свойства металлов.
Металлы занимают в Периодической таблице левый нижний угол. Металлы относятся к семействам s – элементов, d – элементов, f-элементов и частично – р-элементов.
Самым типичным свойством металлов является их способность отдавать электроны и переходить в положительно заряженные ионы. Причём металлы могут проявлять только положительную степень окисления.
Ме – ne = Men+
1. Взаимодействие металлов с неметаллами.
а). Взаимодействие металлов с водородом.
С водородом непосредственно реагируют щелочные и щелочноземельные металлы, образуя гидриды. Например:
2Na + H2 = NaH
Ca + H2 = CaH2
Образуются нестехиометрические соединения с ионной кристаллической структурой.
б). Взаимодействие металлов с кислородом.
Все металлы за исключением Au, Ag, Pt окисляются кислородом воздуха. Пример:
2Na + O2 = Na2O2 (пероксид)
4K + O2 = 2K2O
2Mg + O2 = 2MgO
2Cu + O2 = 2CuO
в). Взаимодействие металлов с галогенами.
Все металлы реагируют с галогенами с образованием галогенидов. Пример:
2Al + 3Br2 = 2AlBr3
В основном это ионные соединения: MeHaln
г). Взаимодействие металлов с азотом.
С азотом взаимодействуют щелочные и щелочноземельные металлы. Пример:
3Ca + N2 = Ca3N2
Mg + N2 = Mg3N2 – нитрид.
д). Взаимодействие металлов с углеродом.
Соединения металлов и углерода – карбиды. Они образуются при взаимодействии расплавов с углеродом. Активные металлы образуют с углеродом стехиометрические соединения:
4Al + 3C = Al4C3
Металлы – d-элементы образуют соединения нестехиометрического состава типа твердых растворов: WC, ZnC, TiC – используются для получения сверхтвёрдых сталей.
2. Взаимодействие металлов с водой.
С
водой реагируют металлы, имеющие более
отрицательный потенциал, чем
окислительно-восстановительный потенциал
воды.
![]()
Активные металлы более активно реагируют с водой, разлагая воду с выделением водорода.
Na + 2H2O = H2↑ + 2NaOH
Менее активные металлы медленно разлагают воду и процесс тормозится из-за образования нерастворимых веществ.
3. Взаимодействие металлов с растворами солей.
Такая реакция возможна, если реагирующий металл активнее, чем находящийся в соли:
Zn + CuSO4= Cu0↓ + ZnSO4
![]() =
– 0,76 B.,
=
– 0,76 B.,
![]() =
+ 0,34 B.
=
+ 0,34 B.
Металл, обладающий более отрицательным или менее положительным стандартным электродным потенциалом, вытесняет другой металл из раствора его соли.
4. Взаимодействие металлов с растворами щелочей.
Со щелочами могут взаимодействовать металлы, дающие амфотерные гидрооксиды или обладающие высокими степенями окисления в присутствии сильных окислителей. При взаимодействии металлов с растворами щелочей, окислителем является вода.
Пример:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
1
 Zn0
+ 4OH–
– 2e = [Zn(OH)4]2– окисление
Zn0
+ 4OH–
– 2e = [Zn(OH)4]2– окисление
Zn0 – восстановитель
1 2H2O + 2e = H2 + 2OH– восстановление
 H2O
– окислитель
H2O
– окислитель
Zn + 4OH– + 2H2O = [Zn(OH)4]2– + 2OH– + H2↑
Металлы, обладающие высокими степенями окисления, могут взаимодействовать со щелочами при сплавлении:
4Nb +5O2 +12KOH = 4K3NbO4 + 6H2O
5. Взаимодействие металлов с кислотами.
Это сложные реакции, продукты взаимодействия зависят от активности металла, от вида и концентрации кислоты и от температуры.
По активности металлы условно делятся на активные, средней активности и малоактивные.
Кислоты условно делятся на 2 группы:
I группа – кислоты, обладающие невысокой окислительной способностью: HCl, HI, HBr, H2SO4(разб.), H3PO4, H2S, окислитель здесь H+. При взаимодействии с металлами выделяется кислород (H2↑). С кислотами первой группы реагируют металлы, обладающие отрицательным электродным потенциалом.
II
группа – кислоты, обладающие высокой
окислительной способностью: H2SO4(конц.),
HNO3(разб.),
HNO3(конц.).
В этих кислотах окислителями являются
анионы кислоты:
![]() .
Продукты восстановления аниона могут
быть самыми разнообразными и зависят
от активности металла.
.
Продукты восстановления аниона могут
быть самыми разнообразными и зависят
от активности металла.
 H2S↑
– c
активными металлами
H2S↑
– c
активными металлами
6+ +8е
H 2SO4
+6е S0↓
– с металлами средней активности
2SO4
+6е S0↓
– с металлами средней активности
 конц. +2е
конц. +2е
SO2↑ – c малоактивными металлами
 NH3
( NH4NO3
)– c
активными металлами
NH3
( NH4NO3
)– c
активными металлами
5+ +8e
H
 NO3
+4,5e N2O,
N2
– с металлами средней активности
NO3
+4,5e N2O,
N2
– с металлами средней активности
разб.
+3e
NO – c малоактивными металлами
HNO3(конц.) – NO2↑ – c металлами любой активности.
Если металлы обладают переменной валентностью, то с кислотами I группы металлы приобретают низшую положительную степень окисления: Fe → Fe2+, Cr → Cr2+. При взаимодействии с кислотами II группы – степень окисления +3: Fe → Fe3+, Cr → Cr3+, при этом никогда не выделяется водород.
Некоторые металлы (Fe, Cr, Al, Ti, Ni и др.) в растворах сильных кислот, окисляясь, покрываются плотной оксидной плёнкой, которая защищает металл от дальнейшего растворения (пассивация), но при нагревании оксидная плёнка растворяется, и реакция идёт.
Малорастворимые металлы, обладающие положительным электродным потенциалом, могут растворяться в кислотах I группы, в присутствии сильных окислителей.
Коррозия металлов
Коррозия – самопроизвольное разрушение металлов, вследствие физико-химического взаимодействия их с окружающей средой.
По характеру разрушения коррозионные процессы можно разделить на сплошную коррозию и локальную (местную) коррозию. В первом случае поверхность металла окисляется с одинаковой скоростью на всех участках поверхности. Во втором случае на поверхности металла появляются участки с большей скоростью коррозии, там появляются пятна, трещины и другие повреждения.
Один из видов локальной коррозии – селективная, или избирательная, она происходит в сплавах, где разрушаются кристаллы наиболее активного металла.
Другой вид локальной коррозии – межкристаллитная коррозия, она происходит по границам кристаллитов.
По механизму действия коррозия бывает химической и электрохимической:
Химическая коррозия возникает, когда металл эксплуатируется в среде, не проводящей электрический ток: растворы неэлектролитов и сухая атмосфера воздуха (влажность менее 65%, температура менее 100°С или влажность более 65%, температура более 100°С). В сухой атмосфере воздуха происходит взаимодействие металлов с газами, такими как: O2 и Cl2:
4Al + 3O2 = 2Al2O3
2Al + 3Cl2 = 2AlCl3
При химической коррозии окисление металла и восстановление газа происходит одновременно, на одном участке поверхности, т. е. они пространственно не разделены.
Электрохимическая коррозия протекает в электропроводных средах: растворах кислот, щелочей, солей, во влажной атмосфере воздуха (влажность более 65%, температура менее 100°С). В этих условиях возможна конденсация паров воды на поверхности металлов. Электрохимическая коррозия проявляется в следующих случаях:
-
Два металла, взятые в виде кусков, пластин, проволоки контактируют друг с другом и раствором электролита, при этом более активный металл будет анодом, он будет окисляться, а менее активный металл будет катодом, на нём будет происходить восстановление частиц электролита.
-
Если поверхность металла окислена, то тоже возможна электрохимическая коррозия, при этом окисленные участки будут катодом, а не окисленные – анодом.
-
Причиной электрохимической коррозии могут быть и примеси других металлов, более или менее активных, чем основной.
-
Коррозионная гальванопара может возникнуть и за счёт разной концентрации растворов, касающихся металлической поверхности на разных участках.
-
Электрохимическая коррозия может протекать и тогда, когда разные части металлического изделия находятся в разных условиях, неодинаково нагреты, освещены и т. д.
Р
 ассмотрим
образование коррозионной гальванопары
на примере латуни: Zn
– Cu
ассмотрим
образование коррозионной гальванопары
на примере латуни: Zn
– Cu
A Zn | HCl | Cu K
анодный процесс: Zn – 2e = Zn2+ - окисление
катодный процесс: 2H+ + 2e = H2 - восстановление

Перетекание электронов с анодных участков на катодные называется катодной поляризацией. Снятие электронов с катодных участков ионами водорода называется водородной деполяризацией, а ионы водорода – деполяризаторами. В кислых средах, не содержащих растворённого кислорода, коррозия протекает только с водородной деполяризацией.
Данное уравнение будет выглядеть так:
Zn + 2H+ = Zn2+ + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Продукты коррозии: ZnCl2 и H2↑. Хлорид цинка - растворимая в воде соль, значит, поверхность металла она не защищает, и растворение цинка идёт до конца.
Вывод: латунные изделия нельзя эксплуатировать в кислой среде.
Р
 ассмотрим
коррозию латуни во влажной атмосфере
воздуха.
ассмотрим
коррозию латуни во влажной атмосфере
воздуха.
A Zn
| Н2O,
O2
| Cu
K
Zn
| Н2O,
O2
| Cu
K
анодный процесс: 2 Zn – 2e = Zn2+
к атодный
процесс: 1 2H2O
+ O2
+ 4e
= 4OH–
атодный
процесс: 1 2H2O
+ O2
+ 4e
= 4OH–
2Zn + 2H2O + O2 = 2Zn2+ + 4OH–
2Zn + 2H2O + O2 = 2Zn(OH)2↓
Вывод: латунные изделия можно эксплуатировать во влажной атмосфере воздуха, так как образуется нерастворимое соединение, защищающее поверхность от дальнейшей коррозии. Процесс идёт с кислородной деполяризацией.

 Рассмотрим
пример контакта двух металлов Al
– Cu:
Рассмотрим
пример контакта двух металлов Al
– Cu:
 A
Al
| Н2O
| Cu
K
A
Al
| Н2O
| Cu
K
анодный процесс: 2 Al – 3e = Al3+
катодный процесс: 3 2H2O + 2e = H2 + 2OH–
 2Al
+ 6H2O
= 2Al3+
+ 3H2
+ 6OH–
2Al
+ 6H2O
= 2Al3+
+ 3H2
+ 6OH–
2Al + 6H2O = 2Al(OH)3↓ + 3H2
Процесс идёт с водородной деполяризацией.
Термодинамическая вероятность электрохимической коррозии.
Основной причиной электрохимической коррозии является термодинамическая неустойчивость металла в данной среде. Т. к. коррозия – процесс самопроизвольный, то ΔG < 0, ΔG = – Amax, Amax = nFΔE, где ΔE = EK – EA если ΔE > 0, то EK > EA. Т. е., чтобы процесс не шёл самопроизвольно, мы должны выбрать такой металл, для которого EK EA.
Классификация металлов по их термодинамической неустойчивости в наиболее распространённых коррозионных средах.
-
Кислая среда (без кислорода).
Катодный процесс: 2H+ + 2e = H2, EK = 0, ΔE > 0, EA < 0, т. е. в кислой среде по ряду напряженияй металлов будут подвергаться коррозии Li – W.
-
Нейтральная среда (без кислорода).
Катодный
процесс: H2O
+ 2e
= H2
+ 2OH–,
![]() =
– 0,41 B.
Т. е. во влажной атмосфере подвергаются
коррозии металлы от Li
– Fe
по ряду напряжений металлов.
=
– 0,41 B.
Т. е. во влажной атмосфере подвергаются
коррозии металлы от Li
– Fe
по ряду напряжений металлов.
-
Нейтральная среда (с растворённым кислородом).
Катодный
процесс: 2H2O
+ O2
+ 4e
= 4OH–,
![]() =
0,815 B.
Т. е. в нейтральной среде будут корродировать
металлы: Li
– Ag
по ряду напряжений металлов.
=
0,815 B.
Т. е. в нейтральной среде будут корродировать
металлы: Li
– Ag
по ряду напряжений металлов.
-
Кислая среда (с растворенным кислородом).
Катодный
процесс: 4H+
+ O2
+ 4e
= 2H2O,
![]() =
1,23 B.
Металлы, имеющие меньший электродный
потенциал Li
– Hg
будут корродировать в кислой среде в
присутствии кислорода.
=
1,23 B.
Металлы, имеющие меньший электродный
потенциал Li
– Hg
будут корродировать в кислой среде в
присутствии кислорода.
Методы защиты от коррозии
Существует 4 основных метода защиты от коррозии:
-
Легирование
-
Защитные покрытия (металлические и неметаллические)
-
Антикоррозионная обработка среды (деаэрация, ингибиторы)
-
Электрохимическая защита.
-
Легирование.
Легирование – создание коррозионно-стойких сплавов. Если в состав углеродной стали ввести легирующие добавки (Cr, Ni, Ti, Al, и т. д.), которые образуют прочные оксидные плёнки на поверхности металла, то, несмотря на небольшое количество добавок, на поверхности металла образуется прочная защитная пленка оксидов. Но недостатком легирования является то, что основной металл устойчив только во влажной атмосфере воздуха и в воде.
2. Защитные покрытия.
Защитные покрытия бывают металлические и неметаллические. Металлические – лужение, покрытие оловом, никелирование, хромирование, цинкование и др.
Покрытие наносят погружением детали в расплавленный металл, а так же напылением и электролизом. Метод электролиза с растворимым анодом называется гольваностегия.
Рассмотрим пример хромирования:
В электролизёр заливают электролит Cr2(SO4)3, хром делают анодом, он будет окисляться, посылая в раствор ионы хрома, а катодом делают деталь, на которую нужно нанести металлическое покрытие, на ней будут восстанавливаться ионы хрома, покрывая деталь ровным слоем хрома:
анодный процесс: Cr0 – 3e = Cr3+
катодный процесс: Cr3+ + 3e = Cr0
Механизм защитного действия металлического покрытия.
Пока металлическое покрытие не повреждено, оно защищает металл от коррозии. Существует 2 вида покрытия: анодное и катодное. Анодным называется покрытие более активным металлом, чем основной, катодным называют покрытие менее активным металлом, чем основной.
Пример: железная пластина покрыта цинковым покрытием. При повреждении покрытия возникает коррозионная гальванопара:
A
 Zn
| H2SO4
| Fe
К
Zn
| H2SO4
| Fe
К
а нодный
процесс: Zn
– 2e
= Zn2+
нодный
процесс: Zn
– 2e
= Zn2+
катодный процесс: 2H+ + 2e = H2↑

Zn + 2H+ = Zn2+ + H2↑
Вывод: анодное покрытие защищает металл как механически, так и электрохимически, так как при повреждении покрытия разрушается металл покрытия, а не основной металл.
Рассмотрим пример с лужёным железом:


A Fe | H2SO4 | Sn K
а нодный
процесс: Fe
– 2e
= Fe2+
нодный
процесс: Fe
– 2e
= Fe2+
катодный процесс: 2H+ + 2e = H2↑
 Fe
+ 2H+
= Fe2+
+ H2↑
Fe
+ 2H+
= Fe2+
+ H2↑
Вывод: катодное покрытие только механически защищает основной металл, так как при повреждении покрытия разрушается основной металл.
Неметаллические покрытия.
Химические покрытия.
Оксидирование - покрытие изделия оксидной плёнкой. Например: железо можно поместить в раствор NaOH – 40%,нагретый до 140°С, KNO3 или K2CrO4.
 3 Fe
+ 2OH–
– 2e = FeO + H2O
3 Fe
+ 2OH–
– 2e = FeO + H2O
1 2Fe + 6OH– –6e = Fe2O3 + H2O

3Fe + 2Fe + 8OH- = 3FeO + Fe2O3 + 4H2O
FeO + Fe2O3 Fe3O4(чёрн.)
Фосфатирование. Создание на поверхности изделия защитной плёнки из трудно растворимых фосфатов и гидрофосфатов марганца железа.
Лакокрасочное покрытие. Краска, содержащая олифу и красящий пигмент, препятствует процессу коррозии.
3. Антикоррозионная обработка среды.
Антикоррозионная обработка среды применяется для замкнутых объёмов. Например деаэрация – удаление кислорода из раствора, используется для паровых котлов.
Ингибиторы – замедлители коррозии, это поверхностноактивные вещества, которые адсорбируются на поверхности металлов, т. е. они покрывают изделие адсорбционной плёнкой и таким образом защищают его от коррозии. Ингибиторы бывают летучие и контактные.
4. Электрохимические методы защиты от коррозии.
Протекторная защита. К основному металлу присоединяется кусок из более активного металла и при образовании гальванопары, этот кусок будет растворяться, а основной металл останется неповреждённым.
Катодная защита. К защищаемому изделию присоединяют кусок металла и подают небольшое напряжение, так, чтобы основной металл являлся катодом, а вспомогательный – анодом, тогда будет происходить электролиз с растворимым анодом и основной металл будет защищён.
