
- •Любая система стремится перейти в состояние равновесия, которое является наиболее устойчивым состоянием системы.
- •Любая система стремится к уменьшению свободной энергии и устойчивому состоянию, которому соответствует состояние с наименьшим значением свободной энергии.
- •А b с - последовательные реакции
- •А параллельне реакции
- •Основные положения теории катализа.
ВВОДНАЯ ЛЕКЦИЯ
Химия - это наука, изучающая вещества, их состав, строение, свойства и взаимные превращения.
Основные положения атомно-молекулярной теории:
1. Все вещества состоят из молекул.
Молекула - это наименьшая частица вещества, обладающая его химическими свойствами.
2. Молекулы состоят из атомов.
Атом - это наименьшая частица элемента, обладающая его химическими свойствами.
Атом состоит из плотного, положительно заряженного ядра и отрицательно заряженных электронов. В целом атом электронейтрален.
Вид атомов с одинаковым зарядом ядра называется химическим элементом.
Атомы, обладающие одинаковым зарядом ядра, но разной массой, называются изотопами.
Так, природный хлор состоит из двух изотопов: 35Cl и 37Cl.
3. Молекулы и атомы находятся в непрерывном движении.
4. При химических реакциях молекулы одних веществ превращаются в молекулы других веществ. Атомы при химических реакциях не изменяются.
Вещества, молекулы которых состоят из атомов одного элемента - называются простыми веществами. Простые вещества могут иметь несколько аллотропных модификаций, т.е. вещества состоят из атомов одного и того же элемента, но обладают разными свойствами.
Сложными веществами называются вещества, молекулы которых состоят из разных элементов и в разных соотношениях.
Раздел химии, изучающий количественный состав и количественное соотношение между реагирующими веществами, называется стехиометрией.
Единицей измерения количества вещества в химии является моль.
Моль вещества - это количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов) сколько содержится атомов в 12 г изотопа углерода 12С.
NA = 6,021023
Молярная (мольная) масса - это масса одного моль вещества (М).
[М] = [г / моль]
М
Н![]() О = 18 г /
моль, М NaOH
= 40 г / моль
О = 18 г /
моль, М NaOH
= 40 г / моль
Молярный (мольный) объём- это объём одного моля газообразного вещества (Vм).
При нормальных условиях Vм = 22,4 л
Нормальные условия: p= 101325 Па, Т = 273К
Основные стехиометрические законы .
ЗАКОН СОХРАНЕНИЯ МАССЫ.
Массы веществ, вступающих в реакцию, равны массе веществ, получающихся в результате реакции.
ЗАКОН ПОСТОЯНСТВА СОСТАВА.
Каждое сложное вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав. Следовательно, химические вещества взаимодействуют друг с другом в строго определенных (эквивалентных) соотношениях.
Эквивалент - это реальная или условная частица вещества, которая может присоединять, замещать, высвобождать один ион водорода в кислотно-основных и ионообменных реакциях или один электрон в окислительно-восстановительных реакциях.
Молярная масса эквивалентов - это масса одного моль эквивалентов, содержащая 6,021023 эквивалентов (Э).
[Э] = [г / мольэкв]
Эквивалент зависит от условий протекания реакций, а молярная масса - постоянна.
Формулы для расчета эквивалентов.
Э оксида = М оксида / число атомов элемента валентность элемента
Э кислоты = М кислоты / основность кислоты
Основность кислоты определяется числом атомов водорода, которое кислота отдает, реагируя с основанием.
Э основания = М основания / кислотность основанияКислотность основания - количество ионов гидроксила, которые замещаются при взаимодействии с кислотой.
Э соли = М соли / число атомов Ме валентность Ме, где (Ме - металл)
ЗАКОН ЭКВИВАЛЕНТОВ
Вещества взаимодействуют друг с другом в количествах, прямо пропорциональных их эквивалентам.
Массы (объемы) реагирующих веществ, прямо пропорциональны молярным массам (объемам) их эквивалентов.
![]()
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Первый закон термодинамики
Химическая термодинамика представляет собой научную дисциплину, которая изучает:
-
переход энергии из одной формы в другую, от одной части системы к другой;
-
тепловые эффекты, сопровождающие химические и физические процессы;
-
возможность и направление самопроизвольного протекания процессов.
Основные понятия и определения химической термодинамики.
Система – это вещество или смесь веществ, мысленно или фактически выделенных из окружающей среды.
Системы бывают:
-
открытыми – могут обмениваться с окружающей средой и веществом и энергией;
-
закрытыми – могут обмениваться с окружающей средой только энергией;
-
изолированными – не могут обмениваться с окружающей средой ни веществом, ни энергией.
С другой стороны, системы бывают гомогенными и гетерогенными. В гомогенных системах вещества находятся в одной фазе, в гетерогенных – в разных фазах, т.е. в гетерогенных системах существуют поверхности раздела.
Фаза – часть системы, отделённая от других её частей поверхностью раздела, при переходе через которую свойства меняются скачком.
Свойства системы называются параметрами состояния системы.
Параметры интенсивности не зависят от количества вещества (температура, давление, плотность), параметры экстенсивности зависят от количества вещества (масса, объём, площадь поверхности раздела).
Любое изменение одного или нескольких параметров называется переходом системы из одного состояния в другое или процессом.
Процессы бывают:
-
изотермические, при постоянной температуре (T = const.);
-
изохорные, при постоянном объёме (V = const.);
-
изобарные, при постоянном давлении (Р = const.).
Состояние системы бывает равновесным и стационарным. При равновесном состоянии соблюдается постоянство всех параметров при отсутствии обмена с окружающей средой веществом или энергией, при стационарном - все параметры остаются постоянными, но при этом наблюдается обмен веществом или энергией с окружающей средой.
Цикл – цепь последовательных превращений, при которых все параметры системы возвращаются к исходным значениям.
Первый закон химической термодинамики.
Первый закон химической термодинамики представляет собой в наиболее общем виде закон сохранения энергии для систем, в которых изменение энергии происходит в виде теплоты и работы.
Для любого процесса соблюдается равенство: Q = ΔU + A
Формулировка 1-ого закона химической термодинамики:
Если к системе подводится теплота, то она расходуется на изменение внутренней энергии системы и совершение системой работы.
U – внутренняя энергия. Под внутренней энергией подразумевается общий запас энергии, включая энергию межмолекулярного взаимодействия в среде, энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов и других частиц, за исключением кинетической и потенциальной энергии системы в целом.
Внутренняя энергия системы это функция состояния вещества, её изменение не зависит от пути перехода из одного состояния в другое.
Абсолютное значение внутренней энергии определить невозможно, можно определить только её изменение(U).
В термодинамике обычно исследуют две формы передачи энергии от одной системы к другой – теплоту и работу.
Теплота (Q) – микроскопическая форма передачи энергии при столкновении хаотически движущихся молекул и атомов соприкасающихся тел.
Под работой (А) подразумевается работа системы против внешних сил (давления, электрических и магнитных полей и др.)
В отличие от внутренней энергии, работа и теплота не являются функциями состояния системы, они зависят от вида процесса.
Если система переходит из одного состояния характеризуемого объёма V1 в другое, с объёмом V2 то:
![]() ,
где А - работа против
всех сил, действующих на систему, кроме
внешнего давления. рV
– работа расширения системы.
,
где А - работа против
всех сил, действующих на систему, кроме
внешнего давления. рV
– работа расширения системы.
Если
изучаемая система находится только под
действием давления, то A
= рV,
тогда 1-ый закон термодинамики имеет
вид:
![]() .
.
1) Для изохорных процессов (V=const, ΔV=0):
![]() ,
т. е. теплота расходуется только на
изменение внутренней энергии.
,
т. е. теплота расходуется только на
изменение внутренней энергии.
2) При постоянном давлении (изобарные процессы):
![]()
![]() ,
где Н – энтальпия (теплосодержание
системы), т. е.
,
где Н – энтальпия (теплосодержание
системы), т. е.
![]()
Энтальпия – функция состояния системы, она не зависит от пути перехода системы из одного состояния в другое. Абсолютное значение энтальпии определить невозможно, можно определить только её изменение. В термохимии изменение энтальпии называют тепловым эффектом реакции.
Энтальпия
процесса
![]()
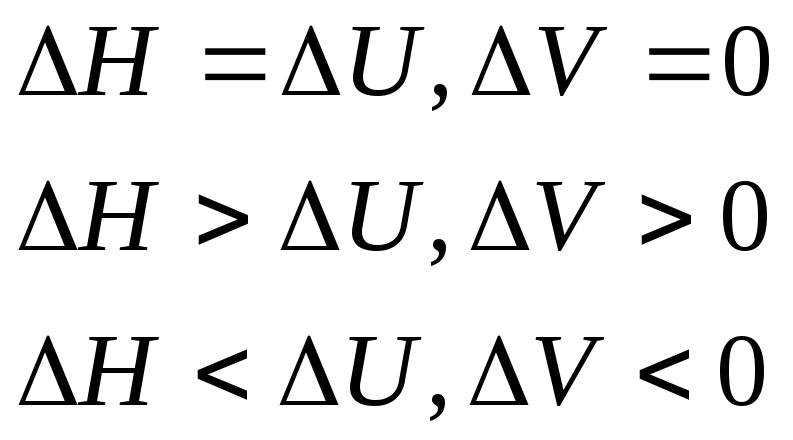
Термохимия
Все химические процессы протекают либо с выделением, либо с поглощением тепла. Экзотермическими называют процессы, идущие с выделением тепла и эндотермическими – идущие с поглощением тепла. Количество выделяемой или поглощаемой теплоты называется тепловым эффектом реакции.
Для
изохорных процессов тепловой эффект
равен изменению внутренней энергии:
![]() ,
для изобарных – изменению энтальпии:
,
для изобарных – изменению энтальпии:![]() ,
т. е. тепловой эффект не является функцией
состояния системы, т.к. зависит от
условий проведения реакции.
,
т. е. тепловой эффект не является функцией
состояния системы, т.к. зависит от
условий проведения реакции.
Химические уравнения, в которых указан тепловой эффект реакции при постоянном давлении и температуре, называются термохимическими уравнениями. Причём, в термодинамике все процессы рассматриваются со стороны самой системы: тепловой эффект считается положительным (Н > 0) для эндотермических процессов и отрицательным (Н < 0) для экзотермических процессов.
Тепловой эффект реакции при постоянном давлении (Н) измеряется в кДж, и относится к числу молей веществ, участвующих в реакции. Кроме того, в термохимических уравнениях указывают агрегатное состояние веществ, участвующих в реакции.
Энтальпия реакции приводится для стандартных условий: температуры 298К и давления в 1 атм. = 101325 Па.
Изменение энтальпии может быть найдено не только для химических реакций, но и для других процессов – например, фазовых переходов. Фазовым переходом называют переход одной фазы в другую: твёрдое – жидкое (испарение), твёрдое – газ (сублимация или возгонка) и т. д.
Стандартная энтальпия образования сложного вещества - это тепловой эффект реакции образования 1-го моля сложного вещества из простых веществ.
Стандартная энтальпия разложения сложного вещества - это тепловой эффект реакции разложения 1-го моля сложного вещества на простые вещества.
Стандартная энтальпия образования 1-го моля сложного вещества равна стандартной энтальпии разложения 1-го моля вещества, взятого с обратным знаком – закон Лавуазье-Лапласа.
![]() ,
где
,
где
![]() ,
,
![]() -
энтальпии образования (разложения)
сложного вещества при стандартных
условиях.
-
энтальпии образования (разложения)
сложного вещества при стандартных
условиях.
Энтальпия
образования 1-го моля вещества приводится
в таблицах и измеряется в
![]() .
Энтальпии образования простых
веществ равны нулю.
.
Энтальпии образования простых
веществ равны нулю.
Основной закон термохимии (закон Гесса).
Тепловой эффект химической реакции не зависит от пути проведения процесса, числа и вида промежуточных стадий, а зависит только от начального и конечного состояния реагирующих веществ, при условии постоянства давления или постоянства объёма.
1-ое следствие закона Гесса. Тепловой эффект процесса равен сумме тепловых эффектов промежуточных стадий.

2-ое следствие закона Гесса. Тепловой эффект процесса равен алгебраической разности между суммой теплот образований продуктов реакции и суммой теплот образования исходных веществ, причём коэффициенты в уравнении учитываются как сомножители теплот образований.
сС + dD = аА + bВ;
![]() ;
;
![]()
Пример расчёта теплового эффекта химической реакции:
![]() ;
Н = ?
;
Н = ?
-
Вещество
ΔН0298, кДж/моль
NH3(г)
-46,2
О2(г)
0
Н2О(ж)
-285,8
NO(г)
90,3
![]() =
=
=
![]() кДж.
кДж.
Второй закон термодинамики.
План:
-
возможность самопроизвольного протекания реакции;
-
энтропия;
-
изобарно - изотермический потенциал или свободная энергия Гиббса.
Самопроизвольными
называются процессы, в результате
которых может быть получена полезная
работа![]() ,
несамопроизвольными называются
процессы, на которые нужно затратить
работу.
,
несамопроизвольными называются
процессы, на которые нужно затратить
работу.
Рассмотрим два самопроизвольных процесса – растворение гидроксида натрия и растворение нитрата аммония:
![]() ;
;
![]() .
.
Это самопроизвольные процессы, но один из них сопровождается выделением тепла, а другой – поглощением тепла. Как видим, знак теплового эффекта процесса (энтальпийный фактор) не определяет однозначно возможность самопроизвольного протекания процесса. Существует 2-ой фактор самопроизвольности процесса - энтропийный фактор.
Что же такое энтропия?
Состояние любой системы может быть описано, с одной стороны, по значению измеряемых параметров системы (макросостояний системы), с другой стороны, состояние системы можно описать множеством мгновенных микросостояний, которым соответствуют разные энергетические уровни микрочастиц, составляющих нашу систему.
Число микросостояний, которое соответствует данному макросостоянию вещества, называется термодинамической вероятностью его состояния (W), т. е. W – это число способов, которыми молекулы можно распределить по разным энергетическим уровням.
С
термодинамической вероятностью состояния
связана функция состояния системы,
называемая энтропией (S)
![]() .
.
S = k ln W, где k – постоянная Больцмана, k ≈ 1,38∙10-23 Дж/K ,
W – термодинамическая вероятность состояния системы.
Для 1 моль вещества:
S
= R ln W,
где R – универсальная
газовая постоянная, здесь S
измеряется в
![]() .
.
Вероятность состояния максимальна при максимальной разупорядоченности системы, т. е. энтропия максимальна тогда, когда система находится в наиболее разупорядоченном состоянии. Именно к этому система стремится самопроизвольно.
Любая система стремится перейти в состояние наибольшего беспорядка, т. е. самопроизвольно, любая система стремится к увеличению энтропии. И энтропия является мерой беспорядка в системе. Она увеличивается в таких физических процессах, как плавление, кипение, расширение газов. В химических процессах энтропия увеличивается, если из исходных веществ, взятых в твёрдом или жидком состояниях, получается газообразные продукты реакции, или - если число молекул в ходе реакции увеличивается.
Пример:
![]() ,
т. е. энтропия растёт, т. к. увеличивается
количество движущихся частиц.
,
т. е. энтропия растёт, т. к. увеличивается
количество движущихся частиц.
![]() ,
S <
0 , - энтропия уменьшается т. к. уменьшается
количество частиц (из 3-х в 2) и система
переходит из газообразного состояния
в жидкое.
,
S <
0 , - энтропия уменьшается т. к. уменьшается
количество частиц (из 3-х в 2) и система
переходит из газообразного состояния
в жидкое.
Рассмотрим изменение энтропии в системе при переходе из одного, состояния, характеризуемого объёмом V1 в другое – с объёмом V2:
![]()
![]() ,
,
![]()
![]()
![]() ;
;
Если V2 > V1, то S > 0, если V2 < V1, то S < 0, т.е. при увеличении объема энтропия увеличивается.
Энтропия
идеального кристалла при абсолютном
нуле равна нулю, поэтому можно рассчитать
абсолютное значение энтропии для каждого
вещества. В таблицах приводится
стандартное значение энтропии (S)
![]() при стандартных условиях.
при стандартных условиях.
Энтропия – функция состояния вещества, значит, не зависит от пути перехода системы из одного состояния в другое. Для обратимых изотермических процессов (фазовых переходов), изменение энтропии равно изменению энтальпии, деленному на температуру:
![]() .
.
Энтропия зависит от температуры:
![]() ,
где СР – молярная теплоёмкость
при постоянном давлении.
,
где СР – молярная теплоёмкость
при постоянном давлении.
Функция, которая связывает и энтальпийный и энтропийный фактор, G – свободная энергия Гиббса, или изобарно – изотермический потенциал.
G = H - TS, где Н – энтальпия, Т – абсолютная температура, S – энтропия.
Для изобарно-изотермических процессов:
G = H - TS, т. е. в изменении свободной энергии Гиббса учитывается и энтальпийный и энтропийный факторы.
Если система совершает полезную работу, то её энергия убывает.
![]() ,
где
,
где
![]() -
полезная работа.
-
полезная работа.
G < 0, (1) – для самопроизвольных процессов.
G = 0, (2) – в состоянии равновесия.
Уравнения (1) и (2) – математическая запись 2-го закона термодинамики.
Формулировка 2-го закона термодинамики.
-
Любая система стремится перейти в состояние равновесия, которое является наиболее устойчивым состоянием системы.
-
Любая система стремится к уменьшению свободной энергии и устойчивому состоянию, которому соответствует состояние с наименьшим значением свободной энергии.
Изобарно – изотермический потенциал химической реакции зависит не только от абсолютного количества вещества, но и от концентрации веществ, участвующих в реакции. Эта зависимость выражается в уравнении изотермы Вант – Гоффа.
аА + bВ = сС + dD
 ,
,
![]() -
изменение свободной энергии Гиббса
при постоянном давлении и температуре.
-
изменение свободной энергии Гиббса
при постоянном давлении и температуре.
[C], [D], [А], [В] – концентрации веществ, участвующих в реакции.
R – универсальная газовая постоянная.
Т – абсолютная температура.
Кравн. – константа равновесия.
Изменяя концентрации веществ в исходном состоянии, можно изменить и G реакции, т. е. добиться таким путём желаемого направления и глубины процесса.
Стандартное
состояние: [C] = [D]
= [А] = [В] =
![]() ,
температура = 298К,
давление = 101,325кПа.
,
температура = 298К,
давление = 101,325кПа.
Стандартная изотерма Вант – Гоффа.
![]()
Пример термодинамического расчёта химической реакции:
![]()
Возможно ли при стандартных условиях самопроизвольное протекание процесса?
G = H - TS
|
Вещества |
|
|
|
CaCO3(к) |
-1207 |
88,7 |
|
CaO(к) |
-635 |
39,7 |
|
СО2(г) |
-393,5 |
213,7 |
По 2-ому следствию закона Гесса:
![]() =
+ 178,5 (кДж).
=
+ 178,5 (кДж).
H > 0.
![]() =
164,7
=
164,7![]() .
.
S > 0.
G = H - TS = 178,5 – 298164,710-3 = 129,6 (кДж).
G > 0.
Выводы:
-
H>0, процесс эндотермический, энтальпийный фактор против самопроизвольности процесса.
-
S>0, система стремится к беспорядку, энтропийный фактор за самопроизвольность процесса.
-
G>0, при стандартных условиях невозможно самопроизвольное протекание процесса.
Вопрос: при каких условиях возможно протекание процесса?
Вычислим температуру равновесного состояния:
G = 0 Н - TравнS = 0 Н = ТравнS,
![]() ,
при Т > 10840K, G<0,
следовательно, данный процесс может
протекать при температурах выше 10840К
,
при Т > 10840K, G<0,
следовательно, данный процесс может
протекать при температурах выше 10840К
Резюме.
-
Н < 0, S > 0, G < 0 – возможно самопроизвольное протекание процесса при любых условиях.
-
Н > 0, S < 0, G > 0, невозможно самопроизвольное протекание процесса при любых условиях.
-
Н < 0, S < 0 или H > 0, S > 0, невозможно однозначно сказать о значении G, но можно сказать, что при низких температурах на значение G больше влияет энтальпийный фактор, а при высоких – энтропийный фактор.
ХИМИЧЕСКАЯ КИНЕТИКА
Химическая кинетика изучает скорости химических реакций и их зависимость от различных факторов.
По механизму протекания различают простые и сложные реакции.
Простые реакции протекают в одну стадию. Уравнение простой реакции отражает ее механизм.
Сложные реакции протекают в несколько последовательных или параллельных стадий:
А b с - последовательные реакции

 В
В
А параллельне реакции
 С
С
Уравнение сложной реакции не отражает ее механизм, а является лишь алгебраической суммой отдельных стадий, например:
А + В C + D
-
A X + C
-
X + B D
По признаку молекулярности реакции делятся на моно-,би- и тримолекулярные.
Молекулярность - это число частиц, участвующих в элементарном акте химического взаимодействия.
Мономолекулярные реакции:
I2 2I
NH4SCN (NH2)2CS
Бимолекулярные реакции:
CO + Cl2 COCl2
2HI H2 + I2
Тримолекулярные реакции:
2NO + Cl2 2 NOCl
Понятие молекулярность применимо только к простым реакциям или к элементарным стадиям сложных реакций. Реакции с молекулярностью выше трех маловероятны и не известны.
По фазовому состоянию реагирующих веществ различают гомогенные и гетерогенные реакции.
Гомогенные реакции протекают в пределах одной фазы, например, в смеси газов или в растворе.
Гетерогенные реакции протекают на границе раздела фаз, например, твердой и жидкой, твердой и газообразной.
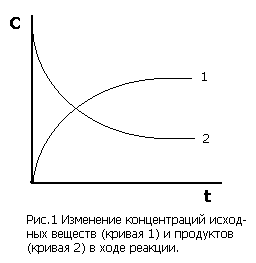
В ходе гомогенной реакции химические взаимодействия происходят по всему объему системы. Скорость гомогенной реакции определяется числом взаимодействий в единицу времени в единице объема и измеряется изменением концентрации одного из реагирующих веществ в единицу времени. Так как концентрация исходных веществ уменьшается (dC<0), а продуктов реакции - растет (dC>0), перед дробью ставят знак + или - так, чтобы скорость всегда была положительной (рис.1):
![]()
 (1)
(1)
Единица измерения скорости реакции -моль/лс.
Скорость реакции зависит от многих факторов. Основные факторы, влиящие на скорость реакции:
-
природа реагирующих веществ
-
концентрация
-
температура
-
катализатор.
Зависимость скорости от концентрации исходных веществ выражается законом действующих масс. Закон открыт опытным путём К. Гульдбергом и П. Вааге в 1867г.
аА + bВ = сС + dD
υ = k[A]p[B]q, где k – константа скорости химической реакции;
[A], [B] – концентрации исходных веществ;
а, b, - стехиометрические коэффициенты.
Скорость химической реакции прямо пропорциональна произведению концентраций исходных веществ, взятых в некоторых степенях.
Зависимость скорости от концентрации реагирующих веществ, называется кинетическим уравнением химической реакции.
Константа скорости химической реакции – одна из основных кинетических характеристик данной реакции.
Константа скорости равна скорости реакции при концентрациях реагентов, равных 1 моль/л, т.е. удельной скороcти реакции. Константа скорости реакции зависит от природы реагентов, температуры, катализатора и не зависит от концентрации реагентов.
Порядок реакции показывает характер зависимости скорости реакции от концентрации. Известны реакции нулевого, первого, второго, третьего и дробных порядков
Для простых реакций частные порядки по отдельным реагентам совпадают с их стехиометрическими коэффициентами: p=a и q=b, а общий порядок с молекулярностью реакции, например:
I2
2 I
![]()
H2
+ I2
2 HI
![]()
2
NO + Cl2
2 NOCl
![]()
Для сложных реакций - pa и qb, например:
2
N2O5
4 NO2
+ O2
![]()
2HI
+ H2O2
2 H2O
+ I2
![]()
2
NO2
+ 4 H2
4 H2O
+ N2
![]()
N2
+ O2
2 NO
![]()
Порядок реакции устанавливается экспериментально и зависит от механизма реакции. Если процесс включает несколько последовательных стадий, то порядок реакции будет определяться молекулярностью медленной стадии, которая лимитирует скорость всего процесса, например:
2
N2O5
4 NO2
+ O2
![]()

стадия 1: N2O5 N2O3 + O2 медленно
стадия 2: N2O5 + N2O3 4 NO2 быстро
Зависимость скорости от концентрации реагирующих веществ, называется кинетическим уравнением химической реакции.
Гетерогенные реакции – это химические реакции с участием веществ, находящихся в разных фазах и образующих гетерогенную систему. Гетерогенные реакции протекают на поверхности раздела фаз.
Примерами гетерогенных реакций могут служить процессы
горения твердых веществ:
C(к) + O2(г) CO2(г) ;
восстановления оксидов металлов углеродом:
Fe3O4(к) + 2C(к) 3Fe(к) + 2CO2(г) ;
растворения металлов в кислотах:
Zn(к) + 2HCl(р) ZnCl2(к) + H2(г) .
Гетерогенные реакции – это сложные процессы, которые включают несколько последовательных стадий:
-
подвод реагентов к поверхности раздела фаз путем диффузии;
-
адсорбция реагентов на поверхности раздела фаз;
-
химическое взаимодействие;
-
десорбция продуктов реакции с поверхности раздела;
-
отвод продуктов от поверхности раздела путем диффузии.
Каждая из перечисленных стадий имеет свою скорость. Скорость процесса в целом определяется скоростью самой медленной (лимитирующей) стадии и описывается ее законами. Поэтому не существует единой формы кинетического уравнения для гетерогенных процессов. Если лимитирующей стадией процесса является химическое взаимодействие, то скорость химической реакции определяется законом действия масс. Если же сама химическая реакция протекает быстро, то скорость гетерогенного процесса будет определяться скоростью подвода реагирующих веществ к поверхности раздела и описываться уравнениями диффузионной кинетики.
Зависимость скорости от концентрации реагирующих веществ, называется кинетическим уравнением химической реакции.
Кинетические уравнения реакций 0-го, 1-ого и 2-ого порядков.
1. Реакции нулевого порядка.
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Графическое определение константы скорости нулевого порядка.
 c
Здесь
c
Здесь
![]()
α
с0
τ
2. Реакции первого порядка.
υ
=
![]() = kc1,
= kc1,
![]() , ln
c =
k
+ const,
, ln
c =
k
+ const,
когда
= 0,
ln c0
= const, c = c0,
ln c – ln c0
=
k,
ln c0
– ln c = k, ![]() ,
,
![]() ,
,
где с0 – исходная концентрация;
с – концентрация в данный момент времени;
![]() константа
скорости химической реакции 1-ого
порядка.
константа
скорости химической реакции 1-ого
порядка.
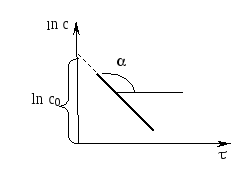
Графическое определение константы скорости химической реакции 1-ого порядка.
ln c0 – ln c = k, ln c = ln c0 - k, - соответствует уравнению прямой: y = b + ax.
Здесь tg = kI.
3. Константа скорости реакции 2ого порядка.
![]() ;
; ![]() ;
; ![]() ;
;
![]() ;
= 0; c = c0; const
= 1/c0;
;
= 0; c = c0; const
= 1/c0;
![]()
![]()
![]() ;
; ![]() ;
;
Графическое определение константы скорости химической реакции 2ого порядка.
![]() соответствует
уравнению прямой: y = ax
+ b.
соответствует
уравнению прямой: y = ax
+ b.

Здесь tg = kII.
Определение константы скорости реакции и порядка реакции по методу Вант-Гоффа.
Определение константы скорости реакции и порядка реакции по методу Вант-Гоффа возможно для тех реакций, в которых скорость реакции зависит от концентрации одного вещества.
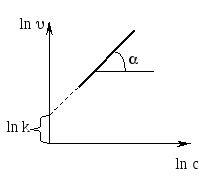
= kcn ; ln = ln k + n ln c;
Для определения порядка реакциистроят график зависимости lnυ от lnc, в котором tgα равен порядку реакции, и график зависимости скорости от концентрации в степени n, в котором tgα равен константе скорости реакции:
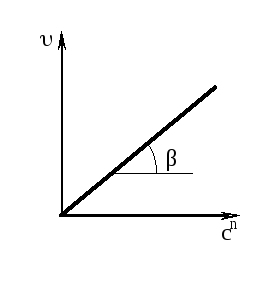
Здесь tg = n. Здесь tg β = k.
Влияние температуры на скорость химической реакции.
Энергия активации (Еакт) это избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества. Молекулы, обладающие избыточным запасом энергии, называются активными молекулами.
Э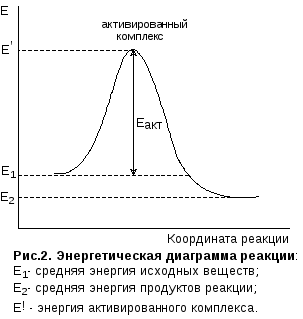 нергия
активации – это фундаментальная
характеристика реакции. Энергия активации
зависит от природы реагентов и механизма
реакции и не зависит от температуры.
нергия
активации – это фундаментальная
характеристика реакции. Энергия активации
зависит от природы реагентов и механизма
реакции и не зависит от температуры.
Энергию активации можно представить как энергетический барьер, который необходимо преодолеть молекулам исходных веществ на пути превращения их в продукты реакции (см. рис.2). Чем больше энергия активации, тем меньше при прочих равных условиях скорость реакции и тем в большей степени она зависит от температуры. При комнатной температуре с наблюдаемой скоростью протекают реакции с Еакт от 60 до 120 кДж/моль. Реакции с Еакт>120 кДж в этих условиях практически не идут, реакции с Еакт<60 КДж/моль при обычных условиях протекают практически мгновенно.
С повышением температуры, скорость химической реакции возрастает, потому что увеличивается число активных молекул. Зависимость скорости химической реакции от температуры, при невысоких значениях температуры выражается уравнением Вант-Гоффа:
![]()
где
![]()
скорости химической реакции при
температурах t1 и
t2.
скорости химической реакции при
температурах t1 и
t2.
температурный коэффициент Вант-Гоффа.
Формулировка. Скорость химической реакции с увеличением температуры на каждые 10 возрастает в 2-4 раза.
Точнее зависимость скорости химической реакции от температуры выражается уравнением Аррениуса.
![]()
где А фактор эффективности соударений;
е основание натурального логарифма;
Еакт энергия активации;
R универсальная газовая постоянная;
Т температура по Кельвину.
Уравнение Аррениуса – это зависимость, полученная опытным путем. Для его теоретического обоснования были предложены теория активных столкновений и теория активированного комплекса.
Согласно теории активных столкновений предэкспонециальный множитель А равен ZP , а выражение для расчета константы скорости имеет вид:
![]()
где Z – общее число столкновений молекул в единицу времени в единице объема;
![]() -
доля активных молекул в системе;
-
доля активных молекул в системе;
Р – стерический множитель.
Общее число столкновений молекул газа Z может быть рассчитано на основе молекулярно-кинетической теории газов.
Зная
энергию активации, можно определить
долю активных молекул при данной
температуре. Так, если Еакт=100
кДж/моль , то доля активных молекул при
Т=300К составит
![]() ,
т.е. только одно из 2,61017
соударений заканчивается химическим
взаимодействием.
,
т.е. только одно из 2,61017
соударений заканчивается химическим
взаимодействием.
Константа скорости, вычисленная как произведение общего числа столкновения Z на долю активных молекул, как правило, превышает действительную величину. Это объясняется тем, что для химического взаимодействия молекулам кроме избыточной энергии требуется определенная взаимная ориентация в момент столкновения. Влияние пространственной ориентации молекул учитывают с помощью стерического множителя Р, значения которого лежат в пределах от 10-9 до 1. Малые значения Р отвечают реакциям между сложными по структуре органическими молекулами.
Согласно теории активированного комплекса химическая реакция протекает через образование молекулами реагирующих веществ неустойчивого переходного состояния или активированного комплекса, энергия которого (Е’) соответствует максимуму на энергетической диаграмме процесса (см рис.2). Активированный комплекс - это такое состояние реагирующей системы, при котором старые связи до конца не разорваны, а новые еще не образовались, например:
AB + C [ABC] A + BC
исходные активированный продукты
вещества комплекс реакции
Таким образом, энергия активации есть разность между энергией активированного комплекса Е’ и средней энергией молекул исходных веществ E1.
Теория активированного комплекса позволяет рассчитать с помощью методов статистической термодинамики энергию активированного комплекса и связать константу скорости химической реакции с его термодинамическими характеристиками – энтропией активации (S) и энтальпией активации (H):
![]() ,
,
Сравнение полученного выражения с уравнением Аррениуса показывает, что предэкспоненциальный множитель
A=![]() ,
,
а энергия активации
Еакт=H .
Методы определения энергии активации.
-
Аналитический метод определения энергии активации применим, если есть возможность определить две константы скорости при двух температурах.
![]() ;
; ![]() ;
;
![]() ;
; ![]() ;
;
![]() .
.
-
Графический метод определения энергии активации. Необходимо иметь несколько значений k при разных T, чтобы построить график ln k = f(T).
![]()
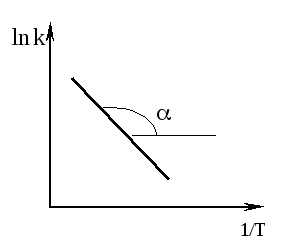
Здесь
tg
=
![]() .
.
Катализ.
Катализаторы – это вещества, которые изменяют скорость химической реакции, но не входят в состав продуктов реакции. Явление изменения скорости химической реакции под действием катализатора называют катализом.
Катализатор, как правило, ускоряет реакцию (положительный катализ). Вещества, в присутствии которых реакция замедляется (отрицательный катализ), называют ингибиторами.
Действие катализатора основано на том, что он образует с реагентами промежуточные соединения и направляет процесс по иному реакционному пути.
