
Методы исследования в медицинской бактериологии
.pdf
181
+сыворотка крови больного
+меченая сыворотка против Ig человека (конъюгат)
+сыворотка больного
+диагностическая сыворотка против антигена
+меченые антитела против диагностической сыворотки
+ субстрат |
|
|
+ субстрат |
а |
б |
Рисунок 187 – Схема ИФА: а - определение антител; б – определение антигенов. Заимствовано из Интернет-ресурсов.
Результаты ИФА регистрируются фотометрическим, флуориметрическим, биолюминесцентным и хемилюминесцентным методами.
ИФА отличается высокой чувствительностью (достаточно присутствия антигена в концентрации 1 нг/мл). К настоящему времени созданы многочисленные модификации базовой методики. Наибольшее распространение получил гетерогенный ИФА на твёрдой фазе (твердофазный ИФА). Для этого коммерческие моноклональные антитела или антиген фиксируют в лунках пластиковых панелей, куда затем вносят исследуемый материал (содержащий соответственно антигены или антитела). В крупных диагностических лабораториях применяют полностью автоматизированные установки (ридеры) для проведения твердофазного ИФА, позволяющие анализировать от 1000 до 4000 проб ежедневно.
На практике ИФА широко применяют для выявления антигенов Chlamydia trachomatis в мазках из мочеиспускательного канала и влагалища, стрептококков группы А в мазках из зева и токсина Clostridium difficile в фекалиях. Метод позволяет не только выявлять антитела, но и определять их принадлежность к различным классам иммуноглобулинов, например, выявлять IgM к антигенам
Mycoplasma pneumoniae.
Буферные растворы для проведения ИФА.
Буфер сенсибилизации - 0,05 М натриево-карбонатно-бикарбонатный буфер (рН 9,5-9,7) для сорбции антигенов или антител на твердом носителе. Состав буфера: 1,18 г Na2CO3; 3,47 г NaНСО3; 200 мг NaNO3. Объем буфера доводят до 1 л дистиллированной водой. Возможно использование фосфатного буфера (буфера инкубации).
Буфер инкубации - фосфатно-солевой раствор (рН 7,3-7,5), который используют для разведения компонентов, вводимых в реакцию после сорбции
182
первого компонента на носителе. Состав буфера: 17,9 г Na2НРО4·12Н2О; 0,8 г NaН2РО4·2Н2О; 42,5 г NaCl; 2,5 мл твина-20. Объем буфера доводят до 5 л дистиллированной водой, хранят при 20-25°С.
Буфер для отмывания компонентов реакции – изотонический раствор хлорида натрия, содержащий 0,05% твина-20. В качестве отмывочного буфера можно также использовать фосфатно-солевой раствор с 0,05% твина-20.
Ортофенилендиамин готовят ex tempore следующим образом: 10 мг ортофенилендиамина, 6,1 мл 0,1 М лимонной кислоты, 6,4 мл 0,2 М Na2НРО4·12Н2О (для полного растворения подогреть на водяной бане), 12,5 мл дистиллированной воды, 0,35 мл 3% Н2О2. Растворяют 80 мг 5-аминосалициловой кислоты в 100 мл дистиллированной воды, доводят рН раствора до 6,0 ex tempore с помощью 1 М NaОН. Перед использованием на каждые 9 мл раствора добавляют 1 мл 0,05% перекиси водорода.
Методика проведения ИФА в лунках планшета. Первый этап ИФА -
сорбция соответствующего разведения антител или антигенов (в концентрации 1020 мкг/мл) в карбонатно-бикарбонатном буфере (в объеме 0,1 мл) на твердую фазу в течение 1-2 часов при температуре 37°С и 10-12 часов при 4°С (сенсибилизация). Затем отмывают лунки (для удаления несорбированных на носителе антител или антигенов) водопроводной водой, отмывочным буфером с 0,05% твина-20 в течение 5 минут (два раза) при комнатной температуре. После этого вносят в каждую лунку (твердую фазу) по 0,1 мл 1% раствора бычьего сывороточного альбумина на карбонатно-бикарбонатном буфере и инкубируют в течение 1 часа при температуре 37°С для закрытия участков поверхности лунок, оставшихся свободными после сенсибилизации. Лунку отмывают от несвязанного бычьего сывороточного альбумина и вносят исследуемый материал (антигены или антитела) по 0,1 мл в разведениях на фосфатно-солевом растворе (рН 7,2) с 0,05% твина-20. Каждое разведение материала вводят в две лунки, и планшеты помещают в термостат на 1-3 часа при температуре 37°С. Непрореагировавшие в иммунной реакции антигены или антитела отмывают и в лунки вносят по 0,1 мл конъюгированных антител против исследуемого антигена или антитела в рабочем разведении на фосфатно-солевом растворе с 0,05% твина-20. Затем планшеты инкубируют в течение 2 часов при 37OС. Несвязавшийся конъюгат трижды отмывают буфером.
В лунку вносят 0,1 мл смеси растворов субстрата и хромогена и выдерживают 30 минут в темноте при комнатной температуре. В процессе инкубации пероксидаза разрушает субстрат (Н2О2) с образованием активного кислорода, который окисляет хромоген. В результате хромоген меняет цвет: ортофенилендиамин окрашивается в желтый цвет, а аминосалициловая кислота - в коричневый.
Для остановки реакции расщепления субстрата в лунку добавляют по 0,1 мл
1N H2SO4 (или 1М NaОН).
Контроль реакции - исследуемые антигены или антитела заменяют гомологичным компонентом реакции.
Контроль конъюгата - 0,1 мл 1% бычьего сывороточного альбумина на карбонатно-бикарбонатном буфере + 0,1 мл конъюгированных антител в рабочем разведении.
При визуальном учете выявляют то наибольшее разведение исследуемого материала, в котором окраска интенсивнее, чем в контроле (с бычьим
183
сывороточным альбумином). При учете результатов реакции с помощью фотоэлектроколориметра положительным считается то наибольшее разведение исследуемого материала, где уровень экстинкции не менее чем в 2 раза превышает уровень экстинкции соответствующего разведения гетерологичного компонента реакции.
Для получения антител, конъюгированных ферментом, необходимы высокоактивные преципитирующие сыворотки против антигенов или против глобулинов животных или человека, из которых выделяют гамма-глобулиновую фракцию. Иммуноглобулины конъюгируют с ферментом при помощи глютаральдегида. Несвязанный фермент удаляют диализом или хроматографией на сефадексе. Для предупреждения микробной деградации в конъюгаты вносят мертиолят до 0,01% и хранят при 4°С в замороженном или лиофильно высушенном состоянии.
Принципы иммуноферментного анализа используются для дифференциации инфицированности организма микобактериями и инфекционного туберкулезного процесса, начиная со стадии латентной туберкулезной инфекции. Указанная технология иммунодиагностики туберкулеза была разработана в начале 2000-х годов. Эта технология получила название “тест высвобождения гамма-
интерферона” – Interferon-gamma release assays (IGRA). Суть этого теста заключается в том, что в организме, в котором идет инфекционный процесс, вызванный Mycobacterium tuberculosis, Т-лимфоциты под воздействием микобактериальных антигенов, специфичных именно для этого возбудителя, начинают выделять гамма-интерферон (INF-γ). В организме, где туберкулезного процесса нет, такой реакции не будет. Следовательно, “тест высвобождения гаммаинтерферона” не позволяет установить факт инфицированности, а выявляет только наличие активной инфекции, начиная со стадии латентной туберкулезной инфекции, не затрагивая стадию инфицирования.
Для проведения IGRA-теста берут кровь пациента, выделяют лимфоциты, добавляют к ним микобактериальные антигены и определяют выделение Т- лимфоцитами гамма-интерферона. Для активации Т-лимфоцитов используют смесь 2 или 3 выборочных антигенов микобактерий, не встречающихся в вакцинном штамме БЦЖ и отсутствующих у нетуберкулезных микобактерий. Эти антигены присутствуют только у возбудителя туберкулеза человека (Mycobacterium tuberculosis) и у микобактерий “туберкулезного комплекса” (M. bovis, M. africanum,
M.microti, M. canetti).
ВРоссии доступны 2 вида IGRA-тестов: QuantiFERON и T-SPOT.TB. Эти тесты различаются методикой учета результатов. QuantiFERON-тест определяет количество (концентрацию) гамма-интерферона в исследуемом образце. T- SPOT.ТВ-тест проводит подсчет количества клеток, выделяющих гаммаинтерферон. Подсчет ведут по окрасившимся “отпечаткам” лимфоцитов на дне лунки, где проводилась инкубация.
QuantiFERON-TB Gold Plus (QFT-Plus-тест) зарегистрирован в РФ в 2010
г. QFT-Plus-тест выявляет клеточный иммунный ответ на пептидные антигены, симулирующие микобактериальные протеины. Антигены, используемые в QFT- Plus-тесте, представляют собой пептидную смесь протеинов ESAT-6 и CFP-10. Эти
184
антигены стимулируют образование гамма-интерферона в Т-клетках лиц, инфицированных M. tuberculosis и микобактериями “туберкулезного комплекса”.
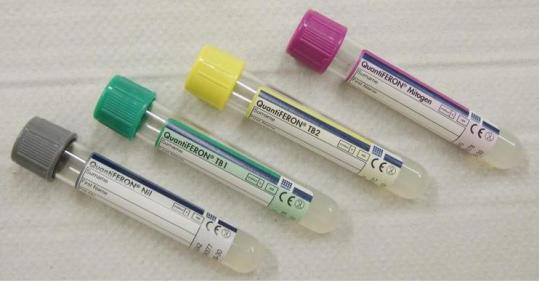
В состав QFT-Plus-теста входят 2 пробирки ТВ1 и ТВ2. Пробирка ТВ1 содержит пептиды ESAT-6 и CFP-10, стимулирующие CD4-лимфоциты. Пробирка ТВ2 содержит дополнительные пептиды, стимулирующие CD8-лимфоциты (ЦТЛ).
Забор крови производят в четыре специальные пробирки: две пробирки содержат микобактериальные антигены, одна пробирка является нулевым контролем и одна пробирка включает митоген – положительный контроль (рисунок
188).
Рисунок 188 – Тест-система QuantiFERON. Заимствовано из Интернет-ресурсов.
После забора крови (по 1 мл в каждую пробирку) пробирки тщательно перемешивают и инкубируют при температуре 37ОС в течение 16-24 часов. Затем пробирки центрифугируют в течение 15 минут при 2000-3000 q, осторожно отбирают плазму крови и исследуют ее на наличие гамма-интерферона. Обнаружение гамма-интерферона (в МЕ/мл) в квантифероновом тесте проводится по методике твердофазного гетерогенного иммуноферментного анализа в 96луночном планшете. Для этого в лунки вносят образцы исследуемой плазмы и конъюгат, тщательно перемешивают на шейкере в течение 1 минуты и инкубируют при комнатной температуре в течение 120 минут. После этого каждую лунку промывают не менее 6 раз буферным раствором с использованием автоматической мойки для планшетов. Затем в каждую лунку вносят раствор ферментного субстрата, перемешивают на шейкере и инкубируют при комнатной температуре в течение 30 минут. После инкубации в лунки добавляют стоп-реагент, перемешивают и измеряют оптическую плотность в каждой лунке планшета с помощью считывающего устройства для микропланшетов (рисунок 189).

185
Рисунок 189 – Квантиферроновый тест, ИФА. Заимствовано из Интернет-ресурсов.
Положительный результат – INF-γ-ответ в пробирке с микобактериальным антигеном значительно превышает ответ в нулевой контрольной пробирке. Сомнительный результат – слабый ответ на митоген (<0,5 МЕ/мл) при отрицательном ответе на антиген. Интерпретация результатов проводится с помощью рекомендуемого программного обеспечения.
T-SPOT.TB (Т-спот, иммунологический тест на туберкулез) зарегистрирован в РФ в 2012 г. Иммунологический тест на туберкулез представляет собой исследование иммунного Т-клеточно-опосредованного ответа, то есть количественное определение в крови эффекторных Т-клеток (CD4 и CD8), вырабатывающих гамма-интерферон, который продуцируется в ответ на стимуляцию микобактериальными антигенами ESAT-6 и CFP-10. Этот тест является упрощенным вариантом иммуноферментного метода, в котором продуцируемый гамма-интерферон связывается с соответствующими антителами рядом с секретирующей его клеткой еще до захвата рецепторами соседних клеток или разрушения. В состав набора входят следующие компоненты:
-микротитровальный планшет (в рамке 12 стрипов по 8 лунок в каждом), на котором сорбированы мышиные поликлональные антитела к гамма-интеферону человека (IFN-y);
-антиген ESAT-6;
-антиген CFP-10;
-положительный контрольный образец (положительный контроль) - фитогемагглютинин (ФГА) для контроля функциональных свойств клеток;
-коньюгат: мышиные моноклональные антитела к гамма-интерферону, конъюгированные со щелочной фосфатазой;
186
- субстрат: раствор 5-бромо-4-хлоро-3-индол-фосфата с нитротетразолиумом синим.
Диагностический набор для T-SPOT.TB – теста представлен на рисунке 190.
Рисунок 190 – Диагностический набор для тест-системы T-SPOT.TB. Заимствовано из Интернет-ресурсов.
Забор крови производят в пробирки для забора крови, рекомендуемые инструкцией. В лаборатории из крови получают мононуклеарные клетки методом, описанным в инструкции к тесту (промывание и центрифугирование в среде для выделения мононуклеаров). Затем подсчитывают в суспензии количество мононуклеарных клеток и готовят клеточную суспензию с концентрацией 2,5х105 клеток/100 мкл. Мононуклеарные клетки инкубируют с микобактериальными антигенами ESAT-6, CFP-10 для стимуляции имеющихся сенсибилизированных Т- клеток. Секретированный этими клетками гамма-интерферон связывается и удерживается специфическими антителами, находящимися на поверхности мембраны, выстилающей лунку, остальные клетки удаляются при промывании. Затем в лунки добавляются специфические антитела, конъюгированные с щелочной фосфатазой (конъюгат). Несвязавшийся конъюгат удаляется при промывании. После этого в каждую лунку добавляется субстрат, который расщепляется связанным ферментом. В месте реакции образуется пятно нерастворимого преципитата, соответствующее одной Т-клетке, секретирующей гамма-интерферон. Количество образующихся пятен является количественной характеристикой содержания сенсибилизированных микобактериями Т-клеток.
Принцип T-SPOT.TB-теста представлен на рисунке 191.
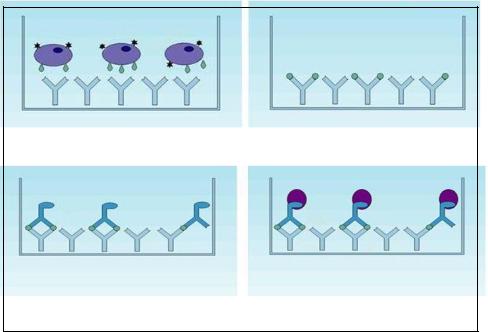
187
Внесение в лунки Т-клеток и антигенов. |
Интерферон захватывается |
Т-клетки высвобождают интерферон. |
антителами |
Добавление конъюгированных с |
Добавление субстрата, оценка |
|
ферментом антител к |
||
результатов по количеству пятен |
||
интерферону |
||
|
Рисунок 191 – Принцип T-SPOT.TB-теста. Заимствовано и адаптировано из Интернет-ресурсов.
Интерпретация результатов: отрицательный результат – менее или равный 4, пограничный – от 5 до 7, положительный – более или равный 8.
Сравнительные характеристики указанных тестов представлены в таблице 22.
Таблица 22 – Сравнительные характеристики тестов T-SPOT.TB и QuantiFERON
Характеристики |
T-SPOT.TB |
QuantiFERON |
Исследуемый образец |
Изолированные и |
2-3 мл цельной крови |
|
очищенные мононуклеары |
|
|
(4 мл крови). Требуется |
|
|
строго определенное |
|
|
количество клеток на |
|
|
лунку |
|
Детекция |
Число Т-клеток, |
Концентрация гамма- |
|
продуцирующих гамма- |
интерферона, |
|
интерферон |
секретируемого Т- |
|
|
клетками |
Обработка крови |
В течение 8 часов после |
В течение 16 часов после |
|
взятия крови |
взятия крови |
Антигены |
ESAT-6, CFP 10 |
ESAT-6, CFP 10, TB 7,7 |
Тип клеток |
CD4, CD8 |
CD4 |
Срок годности вскрытых |
8 недель при 2-8ОС |
12 недель при 2-8ОС |
реактивов |
|
|

188
9.6. Иммуноблоттинг
Иммуноблоттинг (ИБ, вестернблоттинг, англ. blot – пятно) представляет собой высокочувствительный метод выявления белков, основанный на сочетании электрофореза и ИФА. Для осуществления этого метода предварительно готовятся стрипы, представляющие собой полоски нитроцеллюлозной мембраны с нанесенными белками (антигенами). Для получения стрипов антигены возбудителя разделяют с помощью электрофореза в полиакриламидном геле, затем переносят их из геля на нитроцеллюлозную мембрану, которую разрезают на полоски (стрипы). В лаборатории обработку стрипов проводят как в ИФА: на полоски наносят сыворотку больного, затем несвязавшиеся антитела отмывают и наносят антииммуноглобулиновую сыворотку, меченую ферментом (конъюгат). Образовавшийся комплекс (антиген + антитело больного + антитело против иммуноглобулина человека) выявляют с помощью хромогенного субстрата, изменяющего окраску под влиянием фермента. При наличии комплекса антиген- антитело-антисыворотка к иммуноглобулинам на стрипе появляются окрашенные зоны (рисунок 192).
Рисунок 192 – Схема иммуноблоттинга (Воробьев А.А., Быков А.С., 2003 г.).
9.7. Реакция иммунофлюоресценции
Реакция иммунофлюоресценции (РИФ, метод флюоресцирующих антител, МФА) основана на применении антител, меченных флуорохромными красителями (чаще всего флуоресцеина изотиоцианатом). Такие антитела, связываясь с соответствующим антигеном, вызывают свечение иммунных комплексов в УФлучах люминесцентного микроскопа. Имеющиеся в настоящее время автоматизированные технологии позволяют анализировать в одном образце около

189
50 различных антигенов с использованием набора различных флуоресцентных маркеров. Иммунофлуоресцентный анализ позволяет выявлять как антигены, так и антитела.
Существует 3 модификации иммунофлуоресцентного анализа:
-метод прямой иммунофлуоресценции применяют для выявления антигенов, сорбированных на твердой подложке, с помощью меченых антител. Реакция оценивается с помощью флуоресцентного микроскопа;
-метод непрямой иммунофлуоресценции позволяет выявлять немеченые антитела к известному антигену, сорбированному на твердой подложке. Комплексы антигена с антителом в этом случае выявляются с помощью меченых антител к иммуноглобулинам;
-метод конкурентной иммунофлуоресценции основан на связывании антител, сорбированных на твердой подложке, с меченым стандартным антигеном и немеченым антигеном, присутствующим в пробе. Так как меченый и немеченый антигены конкурируют за связывание с антителами, то по количеству связанного меченого антигена можно определить концентрацию антигена в пробе.
Наиболее часто используют методы прямой и непрямой иммунофлуоресценции.
Прямая РИФ предусматривает использование коммерческих диагностических сывороток, содержащих антитела, меченые флюорохромами. На исследуемый препарат или в суспензию клеток вносят раствор меченых флюоресцентным красителем антител. Меченые антитела взаимодействуют с антигенами микроорганизмов с образованием комплексов, которые дают свечение в УФ-лучах люминесцентного микроскопа (рисунок 193).
Бактерия
Флюорохром
Рисунок 193 – Схема прямой РИФ. Заимствовано из Интернет-ресурсов. |
|
Прямая РИФ |
Непрямая |
Р
Прямая РИФ используется в диагностике многих бактериальных инфекций: коклюша, псевдотуберкулеза, чумы и др. (рисунок 194).

190
а б Рисунок 194 – Прямая РИФ в диагностике сифилиса (а) и риккетсиозов (б).
Заимствовано из Интернет-ресурсов.
Непрямая РИФ предусматривает использование 2 видов антител: кроличьи антитела к антигенам бактерий и антиглобулиновые антитела к иммуноглобулинам кролика. Антиглобулиновые антитела мечены флюорохромами. Непрямая РИФ ставится в два этапа. Вначале на препарат к бактериям добавляются кроличьи антитела, а затем – меченые антиглобулиновые антитела. Комплекс антигенантитело дает флюоресцентное окрашивание только после связывания двух антител между собой. Положительная реакция также оценивается по интенсивности свечения (рисунок 195).
Бактерия
•Ме
вст
|
|
вза |
|
|
Флюорохром |
стр |
|
|
|
оп |
|
Рисунок 195 – Схема непрямой РИФ. Заимствовано из Интернет-ресурсов. |
|||
ИФ |
Непрямая РИФ |
ко |
|
Использование |
биоинженерных иммуноглобулинов |
||
и высокая степень |
|||
очистки антител позволили практически свести на нет неспецифические реакции, что сделало возможным дальнейшее технологическое развитие метода иммунофлюоресценции.
