
Лекции_6_Химия
.pdf
МОДУЛЬ 2: Химия элементов и их соединений
Лекция 6. s- , p- , d -, f – элементы. Физические и химические свойства элементов как периодическая функция заряда ядра и электронной конфигурации атомов. Металлы и неметаллы. Химия металлов. Общие физические и химические свойства металлов и их соединений. Основные методы получения металлов из руд. Понятие о сплавах и основных типах диаграмм состояния.
Основой для изучения химии элементов является периодический закон Д.И. Менделеева и периодическая система элементов, являющаяся графическим отображением закона. Периодическая система элементов в учебной литературе представлена в виде короткопериодного (8 столбцов элементов) и длиннопериодного вариантов (18 столбцов) таблиц, нумерация групп в котором сплошная (1, 2, 3, . . ., 18) (см. лекцию 2).
Под химическим элементом понимается совокупность атомов с одинаковым зарядом ядра. Физико-химические свойства элементов и их соединений зависят от положения элемента в периодической системе, которое определяются электронной конфигурацией атома. Из рассмотрения электронных конфигураций атомов наглядно прослеживается периодичность свойств элементов: число электронов, находящихся на внешнем уровне в атомах элементов, располагающихся в порядке возрастания заряда ядра, периодически повторяется. Периодичность свойств атомов элементов можно проиллюстрировать на разных характеристиках: радиусе атома; энергий ионизации и сродства к электрону; электроотрицательности; разнообразии и повторяемости степеней окисления; физических свойствах веществ (плотности, температур плавления и кипения), химических свойствах.
Кнастоящему времени известно 117 химических элементов (с порядковыми номерами
с1 по 116 и 118), из них в земной коре обнаружено 88 элементов, практически отсутствуют
астат 85At и франций 87Fr, а технеций 43Tc и трансурановые элементы, стоящие в периодической системы после урана 92U, получены искусственным путем.
Все элементы подразделяются на семейства s- , p- , d -, f – элементов, у которых заполняется соответственно s- , p- , d - или f – подуровень.
Более 80 элементов относятся к металлам, это все s-элементы (за исключением водорода и гелия), d - , f - и некоторые p - элементы.
Условную границу между металлами и неметаллами можно провести по диагонали: B – Si – As –Te –At, левее которой расположены металлы, правее – неметаллы.
Для элементов, относящихся к одному семейству, характерна близость и закономерное изменение физических и химических свойств.
Под общими химическими свойствами элементов будем понимать такие свойства как металлический или неметаллический характер элемента, его кислотноосно̀вные и окислительно-восстановительные свойства.
Металлический или неметаллический характер элемента можно оценить величиной электроотрицательности χ: чем меньше χ, тем в большей мере проявляются металлическая природа элемента, поскольку для металлов нетипично присоединение электрона, и наоборот, чем больше χ, тем сильнее выражены неметаллические свойства. Характерные свойства металлов и неметаллов приведены в табл. 1.
Таблица 1. Сравнительная характеристика свойств металлов и неметаллов
Свойство |
Металлы |
Неметаллы |
|
Химическая связь |
металлическая |
ковалентная |
|
Агрегатное |
твердое, кристаллическое |
различное: газы (H2, Cl2), |
|
жидкости (Br2), |
|||
состояние |
(за исключением ртути) |
||
твердые вещества (P, S и др.) |
|||
|
|
||
Физические |
металлический блеск; серая окраска |
отсутствие блеска; разная окраска; в |
|
свойства |
(за исключением Au, Cu, Cs); |
твердом состоянии - хрупкость, |

|
пластичность; ковкость; |
отсутствие проводимости |
|
механическая прочность; высокая |
(преимущественно диэлектрики, |
|
электро- и теплопроводность |
полупроводники - B, Si, Ge ), |
|
|
низкая теплопроводность |
Состояние в водном |
катионы (Me Z+); оксокатионы (TiO 2+, |
анионы (F -, S 2 -); катионы (C4+, Si4+); |
VO 3+); оксоанионы (MnO4-, Cr2O72-); |
оксоанионы (ClO4-, SO42-) |
|
растворе |
комплексы {[Cu(NH3)4]2+, [Mo2Cl6]2-} |
|
Характер оксидов |
оснόвный или амфотерный |
кислотный |
Окислительно- |
|
|
восстановительные |
только восстановители |
преимущественно окислители |
свойства |
|
|
Химия металлов
Металлы – это простые вещества, при атмосферных условиях находящиеся в твердом состоянии, кроме ртути 80Hg, обладающие способностью хорошо отражать электромагнитное излучение в видимом диапазоне частот, что обусловливает их блеск и непрозрачность, имеющие высокую электро- и теплопроводность, кристаллизующиеся преимущественно в плотноупакованных кубической и гексагональной решетках.
В технике металлы классифицируют по некоторым физическим свойствам. По величине плотности различают легкие (ρ < 5 г/см3) и тяжелые (ρ > 5 г/см3)
металлы. Самым легким металлом яваляется литий (ρ = 0,53 г/см3), к самым тяжелым относят платиновые металлы, максимальную плотность имеет осмий (ρ = 22,5 г/см 3).
По температуре плавления различают легкоплавкие металлы с температурой плавления ниже 1000 °С и тугоплавкие – выше 1500 °С. Минимальную температуру плавления имеет ртуть (-38,89 °С), максимальную – вольфрам (3395 °С).
По отношению к внешним магнитным полям различают ферромагнитные металлы, способные намагничиваться в слабых магнитных полях (железо, кобальт, никель); парамагнитные металлы, проявляющие слабую способность к намагничиванию (алюминий, хром, титан); диамагнитные металлы, не притягивающиеся к магниту (висмут, олово, медь).
Металлы также делят на черные и цветные. К черным принято относить железо, сплавы на его снове и металлы, которые применяются в этих сплавах (Mn, Cr). Все остальные металлы относят к цветным.
Все металлы в свободном состоянии – восстановители, в химических соединениях их простые ионы всегда положительны. Металлы активно вступают во взаимодействие с элементарными окислителями с большой электроотрицательностью (галогены, кислород, сера и др.).
Химическая активность металлов, т.е. способность отдавать электроны, определяется энергией ионизации I атома в газовой фазе:
Me(г) Mez+(г)+ ze
и стандартным электродным потенциалом φ0 в растворе: Me(тв) + nH2O (Me∙nH2O) z+(р-р)+ ze.
Вводных растворах металлы могут находиться в виде катионов (например, Na+, Al3+),
оксокатионов (TiO2+, UO22+), комплексных ионов ([Zn(H2O)4]2+, [Cu(NH3)]2+, [Fe(CN)6]3-, [CuCl4]2-), оксоанионов (MnO4-, Cr2O7 2-), полиядерных ионов (Mo2Cl62-).
Распространенность металлов в природе различна, наиболее распространены (мас. доли, % ): Al (8,8), Fe (4,65), Ca (3,6), Na (2,64), K (2,5), Mg (2,1), Ti (0,57).
Всвободном виде в земной коре встречаются в виде вкраплений в горные породы или
вроссыпях в результате разрушения горных пород Au, Ag, платиновые металлы, Hg, Cu, остальные элементы находятся в форме химических соединений: оксидов, силикатов, сульфидов и др.
Оксидные руды. В соединениях с кислородом встречаются многие металлы - Al, Fe, Cr,
Mn и ряд других. Оксиды металлов могут образовывать соединения или между собой, если они находятся в различных степенях окисления, или с оксидами неметаллов. Примером
простых оксидных руд и минералов могут служить Fe2О3 - гематит, Fе2О3∙H2О - гетит, А12O3- боксит, TiO2 - рутил, MnO2 - пиролюзит и многие другие.
Сложными оксидными рудами являются соединения двух оксидов, из которых один обладает осно̀вным характером, а другой — амфотерным или кислотным. В общем случае это могут быть оксиды одного и того же металла. Например, осно̀вный оксид железа FеО может образовать соль с амфотерным оксидом Fe2О3:
FeO + Fe2О3 → Fe(FeО2)2 ≡ Fe3О4 (магнетит)
Встречаются довольно часто соединения типа Э1O∙Э2O3 , имеющие кристаллическую структуру шпинели Э12+[ Э23+O4], например, FeO∙Cr2O3 — хромистый железняк; MgO∙А12O3
— магнезиальная шпинель, могут быть и другие сочетания, например, 2MnO∙MnO2 ≡ Mn3O4
– гаусманит, имеющий другую кристаллическую структуру.
Карбонатные руды легко переходят в оксидные, разлагаясь при нагревании. Рудами такого типа являются СаСО3 — мрамор, мел, известняк; МgСО3 - магнезит; СuСО3∙Cu(OH)2
— малахит и др.
Сульфатные и фосфатные руды практически не используют для получения металлов, так как в этом случае очень трудно избавиться от серы и фосфора, являющихся вредными примесями в любом металле. Сульфаты меди и цинка используют для получения вторичных металлов, т. е. при переработке вторичного сырья и отходов цветных металлов.
Силикатные и алюмосиликатные руды очень трудно поддаются переработке ввиду их большой устойчивости. Например, полевой шпат ортоклаз К2О∙Аl2О3∙6SiO2 имеет очень сложное строение. Из алюмосиликатных руд добывают только те металлы, которые в других соединениях не встречаются. Например, бериллий получают из минерала берилла 3ВеО∙А12О3∙6SiО2, алюмосиликат бериллия переводят в галогениды, затем разделяют их и, наконец, выделяют металл.
Сульфидные руды образуют очень многие металлы, так как сера является довольно сильным элементарным окислителем. Сульфидные руды: FеS2 — пирит, или железный колчедан, PbS — свинцовый блеск, Cu2S∙FeS2 — медный колчедан, MoS2 — молибденит, ZnS
— цинковая обманка и др. Обычно сульфидные руды полиметалличны, т.е. содержат несколько металлов одновременно, поэтому получение металлов из них всегда связано с разделением.
Галидные руды: NaCl— каменная, или поваренная, соль, КС1 — сильвин, КС1∙MgCl2∙6Н2О — карналлит. Они используются главным образом для получения активных металлов.
Общие методы получения металлов. Все методы получения металлов сводятся к восстановлению их из ионного состояния: Me z+ + ze → Me.
Их можно разделить на три группы:
1. Вытеснение металла более активным металлом. Этот процесс может происходить как низкотемпературный в водных растворах – гидрометаллургия, так и в расплавах -
металлотермия:
Гидрометаллургия: Zn + Pb(CH3COO)2 (раствор) → Pb + Zn(CH3COO)2 (раствор); Алюмотермия: 3V2O5 + 10А1→ 5А12О3 + 6V
Гидрометаллургические методы используют как для получения металла, так и для его отделения от пустой породы. Например, для отделения золота от породы его сначала растворяют в цианиде натрия в присутствии кислорода, а затем восстанавливают более активным металлом:
4Au + O2 + 8NaCN + 2H2O → 4Na[Au(CN)2] + 4NaOH
2Na[Au(CN)2] + Zn → Na2[Zn(CN)4] + 2Au
Особое место в гидрометаллургии занимает экстракция – извлечение нужного компонента раствора с помощью растворителя, не смешивающегося с раствором.
2. Восстановление металлов неметаллами - Н2 (газ), С(графит), Si, CO
Восстановление оксидов металлов этими восстановителями идет только при высоких температурах и называется пирометаллургия:

SnO2 + Si → Sn + SiO2;
WO3 +3H2 → W+3H2O;
SnO2 + C → Sn + CO2
Сульфидные руды сначала подвергают окислительному обжигу, карбонатные – прокаливанию.
Полученные оксиды затем восстанавливают:
2PbS + 3O2 → 2PbO + 2SO2; PbO +CO → Pb + CO2; ZnCO3 → ZnO + CO2;
2ZnO + C → 2Zn + CO2
Методом пирометаллургии получают большое количество различных металлов. К пирометаллургии относят обычно и хлорную металлургию. Сущность метода
заключается в хлорировании исходной руды часто в присутствии восстановителя и дальнейшем восстановлении хлоридов:
TiO2 + C + 2Cl2 → TiCl4 + CO2 ,
TiCl4 + 2Mg → Ti + 2MgCl2
Преимуществами метода хлорирования являются: высокая скорость процесса, полнота использования сырья, возможность разделения большого числа компонентов за счет различной летучести и термической устойчивости хлоридов.
3. Восстановление металлов при электролизе.
Электролиз можно вести в водных растворах—гидроэлектрометаллургия и в расплавах солей или оксидов при высокой температуре - пироэлектрометаллургия.
Электрометаллургическими процессами можно выделить металл любой активности, но только из соединений ионного типа, растворы или расплавы которых проводят электрический ток. Обычно электрометаллургию применяют для получения металлов высокой химической активности (Na, К, Be, Mg, Ca, A1), которые другими методами получить практически невозможно, или для дополнительной очистки металла —
электрорафинирования.
Металлы высокой чистоты обладают лучшими физико-химическими и механическими свойствами: у них выше пластичность, прочность, коррозионная устойчивость. Степень очистки металлов и сплавов определяется количеством содержащихся в них нежелательных примесей: кислорода, водорода, азота, серы, фосфора, углерода.
Физические свойства металлов. Свойства металлов определяются особым типом химической связи - металлической связью, которая характеризуется наличием в кристаллах металлов «свободных» электронов, является ненасыщенной и ненаправленной (см. лекцию 4). Металлическая связь определяет электро — и теплопроводность, эмиссионные свойства
металлов и некоторые другие.
Связь между теплопроводностью, электрической проводимостью и температурой выражается уравнением Видемана — Франца — Лоренца:
T =const =2,4 10−8
где λ — удельная теплопроводность, Вт∙ м-1∙K-l, σ — удельная электрическая проводимость, См; Т — абсолютная температура, К.
Электрическая проводимость металлов различна. Наиболее высокая она у серебра, если принять ее за 100 %, то относительная электропроводность меди равна 92; алюминия –
50; железа – 12 %.
Электрическая проводимость металлов уменьшается при нагревании и увеличивается при охлаждении, некоторые металлы при очень низких температурах, близких к абсолютному нулю, переходят в состояние сверхпроводимости.
Ряд металлов обладает способностью испускать поток электронов при получении дополнительной энергии. Это явление называется электронной эмиссией, энергия, ее
вызывающая, — работой выхода электронов φэ. В зависимости от способа возбуждения различают термоэлектронную, вызываемую нагреванием, фотоэлектронную, вызываемую облучением, экзоэлектронную, возникающую при разрушении металла в условиях высокого вакуума, и автоэлектронную эмиссию, возникающую при наложении электрического поля.
Работа выхода электронов почти в половину меньше энергии ионизации свободного атома металла (табл. 2).
Таблица 2. Энергия ионизации I и работа выхода электронов φэ для некоторых металлов
Металл |
I, эВ |
φэ, эВ |
Металл |
I, эВ |
φ э , эВ |
Cs |
3,86 |
1,81 |
W |
7,98 |
4,50 |
Ва |
5,21 |
2,4 |
Re |
7,87 |
5,0 |
Та |
7,7 |
4,12 |
Pt |
8,96 |
5,32 |
На границе раздела двух металлов возникает контактная разность потенциалов, что обусловлено различной работой выхода электрона у соприкасающихся металлов. Некоторые пары металлов обладают значительной контактной разностью потенциалов. Величина контактной разности потенциалов зависит от температуры, что используется, например, для измерения температур с помощью термопар. Термопары с почти линейной зависимостью термоэлектродвижущей силы от температуры в широком интервале измеряемых температур изготавливают из платины и сплава ее с родием. Для измерения очень высоких температур используют термопары из вольфрама и рения, вольфрама и графита, но их надо защищать от действия окислительной атмосферы, так как оксиды рения и вольфрама очень летучи, не говоря уже о графите.
Кристаллические структуры металлов отличаются высокими координационными числами (8—12) и относятся к кубической системе (см. лекция 5): объемноцентрированный куб (ОЦК) или гранецентрированный куб (ГЦК), или к гексагональной системе— гексагональная плотно упакованная (ГПУ). Многие металлы обладают полиморфизмом. Например, железо может образовать объемноцентрированную кубическую решетку (ОЦК) (α - и β - Fe) и гранецентрированную кубическую решетку (ГЦК) (γ - Fe).
Температуры плавления металлов различны, наиболее низкие температуры плавления имеют s– металлы (например, Тпл Cs=28,55 0C), наиболее высокие - у d – металлов (например,
Тпл W ~ 3400 0C).
Механические свойства металлов разнообразны, многие из них характеризуются высокой прочностью, другие - высокой пластичностью. Пластичность, упругость, прочность
идругие свойства определяют способность металлов под воздействием внешних сил изменять свою первоначальную форму. Наиболее пластично золото, его можно превратить в тончайший полупрозрачный лист и невидимую невооруженным глазом проволоку или фольгу. На прочность и пластичность металла существенное влияние оказывают температура
идавление. При нагревании прочность металла обычно понижается, а пластичность повышается. Аналогично действует и давление. Сталь, например, под давлением в несколько тысяч атмосфер становится такой же пластичной, как свинец.
На механические и физические свойства металлов влияют несовершенства кристаллической структуры: вакансии, дислокации, фазовая неоднородность, которыми концентрируются на границе между отдельными металлическими зернами.
Хотя в периодической системе элементов Д. И. Менделеева более 80 металлов, их разнообразные свойства не могут удовлетворить запросов техники. Поэтому металлы, как правило, используют в виде сплавов, состоящих из двух, трех и более компонентов.
Химические свойства металлов. Все металлы являются восстановителями и
реагируют как с элементарными окислителями — неметаллами ( кислород, галогены, сера и др.), образуя бинарные соединения, так и со сложными окислителями, к которым прежде всего относятся кислоты.
Все металлы окисляются фтором и могут окисляться хлором. Большинство металлов (кроме золота и платиновых) окисляются бромом и кислородом. Многие металлы взаимодействуют с серой, углеродом, азотом, с водородом непосредственно соединяются щелочные и щелочно-земельные металлы.
Примеры некоторых реакций:
2Mg + O2 → 2MgO
Hg + S → HgS
Ni + Cl2→ Ni + 2Cl2
2B + N2 → 2BN
3Ca + 2P → Ca3P
2Li + H2 → 2LiH
Ca + H2 → CaH2
Среди соединений металлов с неметаллами с небольшой электроотрицательностью особое место занимают соединения внедрения, или металлоподобные соединения, обладающие металлической проводимостью, не подчиняющиеся обычным представлениям о валентности, наиболее характерные для d-металлов, например, TaN, Fe3C, W2C.
Взаимодействие с кислотами, щелочами и водой у металлов различной активности отличается, хотя существуют общие закономерности.
Взаимодействие металлов с кислотами. В химической практике наиболее часто используются соляная, серная и азотная кислоты. Состав продуктов взаимодействия с ними в значительной степени зависит от концентрации кислоты, активности металла и температуры. Однако в большинстве случаев имеют место некоторые общие закономерности.
В соляной кислоте и других бескислородных кислотах роль окислителя играют ионы водорода (Н+), поэтому с ними взаимодействуют металлы, стоящие в ряду активностей до водорода, вытесняя его, например:
Zn + 2H+ → Zn2+ + H2
Металлы, стоящие в ряду активностей после водорода (Cu, Ag, Au), с указанными кислотами не взаимодействуют.
Разбавленная серная кислота, окислителем в которой является ион H+, реагирует с металлами различной активности аналогично соляной с выделением водорода, например:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
В случае образования малорастворимых солей взаимодействие практически не осуществляется из-за образования солевых пленок, например, в случае свинца PbCl2 или
PbSO4.
В концентрированной серной кислоте окислителем является сульфат-ион SO42-, поэтому с ней взаимодействуют и некоторые металлы, стоящие в ряду активностей
после водорода (Cu, Ag и др.). Продуктами окисления металла являются сульфаты, продукты восстановления кислоты зависят от активности металла, концентрации и температуры. В случае активного металла, средней концентрации кислоты и нагревания в реакции выделяется сероводород, менее активный металл восстанавливает кислоту до свободной серы, малоактивный — до SO2 , например:
8K + 5H2SO4 (конц) → 4K2 SO4 + H2S + 4H2O,
2Fe + 4H2SO4 (конц) → Fe2 (SO4)3 + S + 4H2O,
2Bi + 6H2SO4 (конц) → Bi2 (SO4)3 + 3SO2 + 6H2O Некоторые металлы средней активности (Fe, Co, Ni, Cr и др.) пассиви-
руются холодной концентрированной (~ 98%) серной кислотой, образуя нерастворимые оксиды, и без нагревания с ней не взаимодействют.
Взаимодействие металлов с таким сильным окислителем, как азотная кислота, может приводить к образованию продуктов с разными степенями окисления азота в зависимости от концентрации кислоты, активности металла и температуры процесса: активные металлы восстанавливают азот до NН3, который в кислотной среде образует комплексный ион аммония, например:
4Zn + 10HNO3 → [NH4]NO3+ 4Zn(NO3)2+3H2O При нагревании реакция протекает иначе:
4Zn +10НNО3 → 4Zn(NО3)2 + N2O + 5Н2O
Обычно при взаимодействии металлов с азотной кислотой продуктами реакции являются NO или NO2, но чаще всего они выделяются совместно и преобладание одного из оксидов определяется концентрацией азотной кислоты и температурой процесса, например:
3Cu+8HNO3(разб) → 3Cu(NO3)2 +2NO + 4H2O Сu + 4НNО3(конц) → Сu(NО3)2 +2NО2 + 2Н2O.
Концентрированная холодная азотная кислота аналогично серной пассивирует некоторые довольно активные металлы (например, Al, Cr, Fe).
Окислительную способность азотной кислоты можно усилить, добавив к ней соляной кислоты («царская водка») или плавиковой HF. Эти смеси растворяют самые пассивные металлы (Au, Pt):
3Pt + 4HNO3 + 18HCl → 3H2[PtCl6] + 4NO + 8H2O
Сводой реагируют металлы высокой химической активности (щелочные и щелочноземельные металлы) при комнатной температуре с вытеснением водорода и образованием гидроксидов, например:
2Na + 2Н2О → 2NaОН + H2
Менее активные металлы вступают в реакцию с водой при нагревании, образуя оксиды:
Ca + Н2О → CaО + H2
С водными растворами щелочей могут реагировать металлы, оксиды которых проявляют амфотерные свойства, образуя комплексные анионы, в которых лигандами являются ионы гидроксила, например:
2Al + 6Н2О + 2ОН- → 2[Al (ОН)4] - + 3H2
Металлы, образующие соединения с переменными степенями окисления (d–металлы) растворяются в воде или водных растворах щелочей в присутствии сильных окислителей (обычно пероксида щелочного металла):
2W + 7Na2O2 + 6H2О → 2NaWО4 + 12NaOH
Такие реакции характерны для металлов, проявляющих в соединениях высшие степени окисления (V, Nb, W, Мn и др.).
При сплавлении амфотерных металлов с щелочами образуются соли кислородсодержащих кислот металлов
Be + 2NaOH → Na2BeO2 + H2
Пыль и пары̀ некоторых металловиих соединений токсичны, предельно допустимые концентрации (ПДК) таких веществ в рабочей зоне малы.
Наиболее токсичные металлы:
(ПДКвоздух – мг/м3): Be (10-5), Tl (10-4), Hg (10-4), Pb (10-3), Cd (10-3), Ni (10-1).
Понятие о сплавах. Основы физико-химического анализа заложены М.В. Ломоносовым и Д.И. Менделеевым, всесторонне развиты Н.С. Курнаковым (1912-1914 г.г.). Сущность метода заключается в исследовании функциональной зависимости между некоторым физическим свойством системы и концентрациями компонентов, на основании которой строится диаграмма состояния в координатах "состав – свойство". Физикохимический анализ вследствие своей наглядности и объективности широко используется для изучения фазовых равновесий в двух- и трехкомпонентных системах с твердыми фазами, он незаменим в производстве жаропрочных, коррозионноустойчивых сталей, магнитных, полупроводниковых и других сплавов.
Свойства сплавов отличаются от свойств чистых компонентов, используемых для их приготовления (табл. 3).
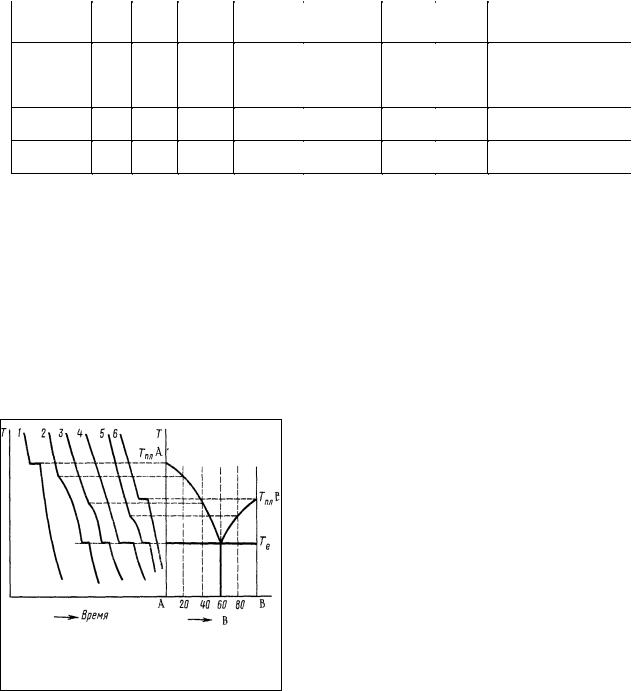
Таблица 3. Физико-механические свойства чистых компонентов и сплавов
Чистые |
σs , |
δ ,% |
НБ |
Сплавы |
σ s , МПа |
δ ,% |
НБ |
Состав |
|
металлы |
МПа |
МПа |
МПа |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3,8—4% Сu |
|
Алюминий |
78,3 |
40 |
196 |
Дюраль |
410 |
18,0 |
980 |
0,4—0,8% Mg |
|
Д-1 |
0,4—0,8% Mn |
||||||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
остальное А1 |
|
Медь |
210,5 |
60 |
344 |
Бронза |
784 |
4,0 |
1960 |
5,0% А1 |
|
А-5 |
остальное Сu |
||||||||
|
|
|
|
|
|
|
|||
Цинк |
127,0 |
5—20 |
344 |
Латунь |
665 |
3—4 |
1375 |
38% Zn |
|
остальное Сu |
|||||||||
|
|
|
|
|
|
|
|
||
Примечание: σ s – предел прочности, δ - относительное удлинение, НБ – твердость по Бринелю |
|||||||||
Сплавы обычно получают в результате кристаллизации расплавленных компонентов, которые в жидком состоянии образуют между собой растворы - расплавы, а в твердом состоянии могут быть полностью взаимно нерастворимы, или обладают неограниченной или ограниченной растворимостью, или образуют химические соединения. Образование различных типов сплавов зависит от соотношения атомных радиусов компонентов, типа кристаллической структуры, химического состава и отражается в разных типах диаграмм состояния.
Диаграммы состояния двухкомпонентных систем с твердами фазами (их также называют диаграммами плавкости) экспериментально получают при постоянном (атмосферном) давлении методом термического анализа.
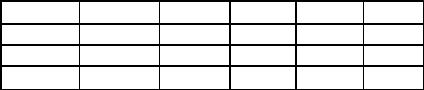
Сущность метода состоит в том, что охлаждают расплавленную смесь известного состава, измеряя через равные промежутки времени температуру. Далее в координатах "температура – время" изображают кривую охлаждения. Процессы, сопровождающиеся выделением теплоты (кристаллизация, химические реакции, полиморфные превращения и др.), отражаются на кривой охлаждения горизонтальными участками или участками с замедленной скоростью охлаждения. Для составления диаграммы снимают кривые охлаждения для ряда смесей с различной концентрацией компонентов, все температурные остановки и точки излома кривых переносят на координатную сетку "температура – состав" и соединяют полученные точки.
Некоторые типы кривых охлаждения и построение диаграммы состояния сплава, компоненты которого в твердом состоянии взаимно нерастворимы, приведены на рис.1.
Рассмотрим некоторые типы двухкомпонентных сплавов и соответствующие им диаграммы состояния.
1. Сплав, компоненты которого нерастворимы в твердом состоянии. Такие сплавы образуют металлы, отличающиеся свойствами и типом кристаллической структуры. В жидком состоянии металлы образуют растворы неограниченной растворимости, а при затвердевании сплава кристаллизуется тот компонент, концентрация которого в жидком растворе больше.
В качестве примера рассмотрим реальную диаграмму состояния системы Bi— Cd, (рис.2). На диаграмме показаны область жидкого раствора (I), области кристаллизующихся из растворов Cd (II) и Bi (IV) и область (III), в которой раствор насыщен относительно обоих компонентов, что приводит к их одновременной кристаллизации.

При этой наинизшей температуре (Т=419К) в равновесии находятся три фазы: жидкий расплав, содержащий 60% Bi и 40% Cd, кристаллы висмута и кадмия, такая система может существовать только при строго определенных температуре и концентрации.
Система, соответствующая одновременной кристаллизации обоих компонентов, называется
эвтектикой, а температура и состав, определяющие условия ее существования, называются эвтектическими.
Сплавы этого типа тоже называются
эвтектическими.
Кривая, разделяющая области существования однофазного жидкого раствора (I) и двухфазных областей (II) и (IV), называется
ликвидус, а изотерма, отвечающая температуре кристаллизации эвтектики (Т=419К), называется солидус, ниже которой весь сплав находится в твердом состоянии. При понижении температуры состав жидкой фазы меняется по линии ликвидуса, пунктирными линиями показаны эти связи T=f1(C) и C=f2(T).
На рис. 2 также схематически изображены структуры образующихся сплавов (а, б, в). Структура эвтектического сплава (а) состоит из мелких кристалликов Bi и Cd, рост которых был задержан в процессе одновременной кристаллизации при эвтектической температуре.
Структуры (б и в) состоят из довольно крупных кристаллов Cd, кристаллизующегося в области (II) (б), и, соответственно, Bi (в), кристаллизующегося в области (IV), спаянных между собой мелкими кристалликами эвтектики, количество которых уменьшается по мере приближения к чистым металлам. Более крупные кристаллы формировались из жидкой фазы при температурах более высоких, чем эвтектическая.
2. Сплав, компоненты которого неограниченно растворимы в твердом состоянии.
Неограниченной растворимостью в твердом состоянии обладают вещества, имеющие близкие значения атомных или ионных радиусов, сходный химический состав и и одинаковый тип кристаллической решетки (так называемые изоморфные вещества). При совместной кристаллизации из раствора они образуют общую кристаллическую решетку (твердый раствор замещения), в которую входят атомы или ионы двух или нескольких компонентов.
Рис. 3. Построениедиаграммы состояния сплава, компоненты которого образуют твердый раствор неограниченной растворимости: 1-чистая медь; 2-сплав с 33% никеля; 3-сплав с 66% никеля; 4-чистый никель
Так, например, медь имеет гранецентрированную кубическую решетку со стороной куба
a = 0,36147 нм и, образуя непрерывные твердые растворы замещения с никелем, постепенно получает структуру ГЦК со стороной куба а = 0,352855 нм, что соответствует уже чистому никелю. Диаграммы плавкости для металлов, образующих непрерывные твердые растворы, строятся по методике, разобранной для эвтектических сплавов.
На кривых охлаждения в этом
случае площадок не наблюдается, а существуют лишь точки перегиба начала и конца кристаллизации. Растущий кристалл твердого раствора в среде жидкого раствора в зависимости от температуры меняет свой состав и постепенно приближается к составу твердого раствора в конце кристаллизации, который соответствует исходному составу сплава.
На рис.3 показан процесс построения диаграммы состояния Cu—Ni по кривым охлаждения, изменение состава в процессе плавления и отвердевания сплавов в соответствующем интервале температуры и фазовое состояние областей диаграммы плавкости. Сплавы такого типа являются гомогенными и отличаются постепенным изменением физических свойств с изменением состава.
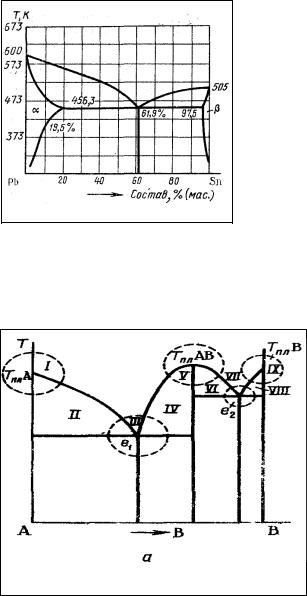
3. Сплав, компоненты которого обладают ограниченной растворимостью в твердом состоянии.
При ограниченной растворимости компонентов образуются твердые растворы внедрения, в которых существует предел растворимости одного металла в другом (например, Сu—Al, Pb—Sn и др.), зависящий от температуры. Растворы образуются за счет проникновения в кристаллическую решетку данного металла других атомов металлического или неметаллического типов, обычно имеющих меньший атомный радиус, чем атомный радиус основного металла (матрицы). Условием для образования твердого раствора этого типа является соотношение радиусов rА ≤ 0,57rВ, где rB — радиус атома металла -
растворителя; rА — радиус атома растворяющегося металла.
На рис. 4 представлена реальная диаграмма состояния Pb—Sn, в которой имеются два твердых раствора (α- и β-) и эвтектика из твердых растворов, отвечающих предельной растворимости компонентов (насыщенных растворов). Если исходный сплав содержит, например, 20% олова и 80% свинца, то при его охлаждении первым кристаллизуется не чистый свинец, что характерно для эвтектических сплавов, а α- твердый раствор олова в свинце, который после насыщения при эвтектической температуре образует эвтектику с другим насыщенным β-раствором свинца в олове. Таким
образом, сплав содержит твердые растворы, которые при охлаждении уже затвердевшего сплава могут распадаться, что позволяет при помощи термической обработки придавать этим сплавам особые свойства.
4. Сплав, компоненты которого образуют химическое соединение.
При взаимодействии компонентов возможно образование химических соединений, устойчивых в твердом состоянии, так называемых интерметаллидов, которые могут рассматриваться как новые компоненты сплава.
Химический состав и свойства соединений, возникающих при образовании сплавов металлов, зависят от расположения компонентов в периодической системе Д. И. Менделеева.
В соединения с металлами могут вступать не только металлы, но и неметаллы с небольшой электроотрицательностью, такие, как углерод, кремний, бор, азот, фосфор, сера.
Типичные интерметаллиды образуются между металлами, расположенными в разных
