
Микробный роман ч
.4.pdf•на матрице минус-нити ДНК при помощи вирусной ДНК-зависимой ДНК-полимеразы образуется 2/3 плюс-нити ДНК (6);
•суперкапсид вирион приобретает на мембранах ЭПС или комплекса Гольджи (7), после чего выходит из клетки экзоцитозом; вместе с ним в кровь выходят HBsAg и HBeAg.
153.2. Вирусный гепатит В: патогенез, иммунитет, профилактика
Источником инфекции являются больные люди и вирусоносители. Заражение чаще происходит парентеральным или вертикальным путем, но из-за наличия вируса в слюне, слезной жидкости, сперме и других биологических жидкостях может происходить половым и даже бытовым (длительное использование одной зубной щетки с носителем) путем.
Инкубационный период составляет около от 30 до 180 дней, чаще около полутора месяцев. При попадании в кровь вирус вследствие гепатотропности фиксируется на гепатоцитах. Сам вирус не обладает цитопатогенным действием, а поражение гепатоцитов обусловлены аутоиммунными реакциями, при которых Т-киллеры и аутоантитела атакуют измененные вирусом клетки.
Острое заболевание может протекать в нескольких формах:
-латентная – наиболее частая, может переходить в хроническую;
-типичная (желтушная) – с полным выздоровлением или переходом в хроническую;
-фульминантная (молниеносная) – с летальным исходом в течение 10 суток.
Примерно в 15% случаев гепатит В переходит в хроническую форму. При этом вирусная ДНК может интегрироваться в ДНК клетки-хозяина. Осложнениями хронической формы являются цирроз и гепатоцеллюлярная карцинома (рак печени), которые могут развиться спустя годы, десятилетия или не развиться вообще.
Иммунная реакция включает и гуморальное звено (основную роль играют анти-HBs, защищающие гепатоциты от циркулирующих в крови вирусов), и клеточное (активированные HBc-антигеном Т-киллеры, уничтожающее пораженные вирусом гепатоциты). Постинфекционный иммунитет напряженный, пожизненный, механизмы аналогичные.
Для лечения тяжелых случаев и хронических форм применяются ингибиторы обрат-
ной транскриптазы вируса (ламивудин), а также интерферон альфа-2а. Как правило,
лечение хронических больных начинают только при наличии признаков прогрессирующего поражения печени. Эффективность лечения составляет около 25%.
Для специфической профилактики применяют рекомбинантную вакцину, содержащую только HBs-антиген. Вакцину вводят новорожденным в первые 12 часов жизни, затем в 1 месяц и 5 месяцев. Такая схема обеспечивает защиту всех привитых на срок около 7 лет, а у 85% привитых – на 25 лет и более. Ранее использовалась плазменная вакцина из плазмы переболевших доноров. Для экстренной постэкспозиционной профилактики кон-
тактных лиц используется специфический иммуноглобулин.
153.3. Вирусный гепатит В: диагностика
Вирусологический и биологический методы в диагностике не применяются.
В серологическом методе исследуют кровь на содержание антигенов и антител при помощи ИФА, реже РНГА, РОНГА и РИА. При этом для диагностики заболевания и определения его фазы необходимо выявление сразу нескольких антител или антигенов.
Антигены:
•HBsAg: маркер наличия вируса в организме в острой и хронической фазах болезни, при выздоровлении исчезает не позднее чем через 6 месяцев после начала болезни;
•HBeAg: маркер активной репликации вируса, определяется в острой фазе и исчезает при выздоровлении не позднее чем через 3 месяца после начала болезни, нарастание титров запаздывает по отношению к HBsAg, а снижение титров – предшествует; наличие его
вхронической фазе является неблагоприятным прогностическим признаком;
•HBcAg: в крови не определяются.
51
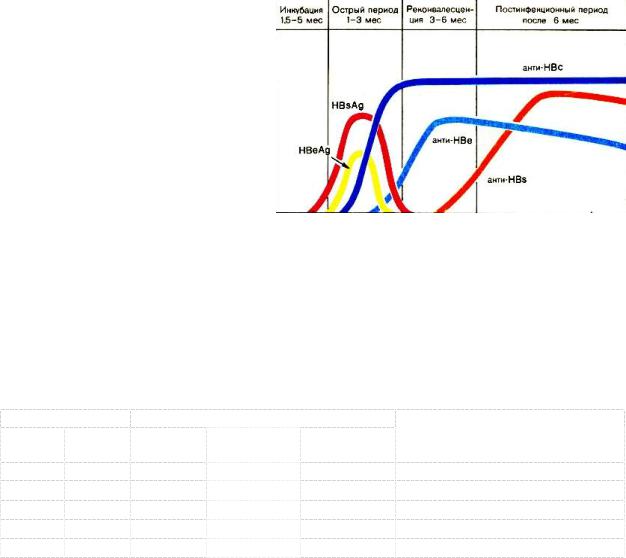
Антитела:
•анти-HBsAg: протективные антитела, образующиеся после полного выздоровления (через 6 месяцев и далее) или эффективной вакцинации; при хронических формах они отсутствуют;
•анти-HBeAg: определяются в острой фазе заболевания, а также могут присутствовать при хронических формах (а могут и отсутствовать); не
могут быть следствием вакцинации (в вакцинах нет HBeAg);
•анти-HBcAg IgM: маркер острой фазы и фазы выздоровления (до 6 месяцев), исчезновение IgM говорит о разрешении острого гепатита (но ничего не говорит о возможном переходе в хроническую форму); при хронической форме их появление говорит в пользу обострения и активной репликации вируса;
•анти-HBcAg IgG: непротективные антитела, появляются несколько позже IgM, но остаются на всю жизнь; их наличие ничего не говорит о возможном переходе в хроническую форму; не могут быть следствием вакцинации.
Надежным методом диагностики острой, хронической инфекции и здорового носительства является ПЦР. Отрицательная реакция означает отсутствие возбудителя в организме.
Антигены |
|
Антитела |
|
|
|
HBs |
HBe |
анти- |
анти-HBcAg |
анти-HBcAg |
Клиническое течение |
HBsAg |
IgM |
IgG |
|
||
|
|
|
|||
+ |
+ |
– |
+ |
+ |
Острая фаза |
+ |
+/– |
– |
–/+ |
+ |
Хроническая форма |
+ |
– |
– |
– |
+ |
Здоровое носительство |
– |
– |
+ |
– |
+ |
Перенесенное заболевание |
– |
– |
+ |
– |
– |
Эффективная вакцинация |
153.4. Вирус гепатита D. Вирусный гепатит D
Вирус гепатита D (дельта) относится к своему обособленному роду Deltavirus и отличается уникальным среди вирусов животных строением, которое приближает его к вироидам растений.
Этот вирус встречается только в паре с вирусом гепатита В (вирус-сателлит) и представляет собой дефектный вирус без собственной оболочки. Вирион состоит всего из двух составляющих: кольцевой однонитевой –РНК и нуклеокапсидного HD-антигена, состоящего из двух белков. В качестве внешней оболочки вирус использует HBs-антиген вируса гепатита В. Выделяют три генотипа вируса, наиболее распространен первый.
Резервуаром вирусного гепатита D являются пораженные им носители гепатита В (около 5%). Заражение происходит аналогичными путями, но инфицирующая доза у вируса гепатита D выше. Инфицирование гепатитами B и D может происходить как одновременно (коинфекция), так и последовательно (суперинфекция). В обоих случаях (но чаще при суперинфекции) течение гепатита B утяжеляется, может развиться острая печеночная недостаточность, быстрее прогрессируют фиброз и цирроз, а риск развития рака пече-
ни увеличивается.
Основной метод диагностики – серологический – заключается в определении антигена (HD) и антител (IgM и IgG) в сыворотке крови или биоптате печени методом ИФА, реже РИА. Надежным методом диагностики является ПЦР (выявление вирусной РНК).
Лечение не разработано. Специфическая профилактика – вакцинирование против вируса гепатита В.
52
154. Вирус гепатита С: классификация, характеристика. Вирусный гепатит C: патогенез, внепеченочные проявления, иммунитет, этиологическая диагностика, профилактика. Диагностическое значение обнаружения РНК ВГС, Ат к ВГС, анти-HBc IgM, Ат к core-Аг, Ат к NS-белкам. Вирус гепатита G: характеристика, роль в патологии, этиологическая диагностика, профилактика
154.1. Вирус гепатита С
Вирус гепатита C относится к роду Hepacivirus семейства Flaviviridae. Другие представители рода медицинского значения не имеют.
▪Общая характеристика:
•тип: сложный, симметрия икосаэдрическая;
•форма: сферическая;
•размеры: 55-65 нм;
•геном: однонитевая линейная +РНК.
▪Структура:
•вирион состоит из структурного белка сердцевины (core), HCc-антигена и неструктурных (ферментативных) белков NS2, NS3, NS4, NS5;
•суперкапсид пронизывают гликопротеиновые шипы gpE1 и gpE2 (NS1).
▪Геном:
•отличается большой изменчивостью, особенно в районе, кодирующем Е1 и Е2;
•выделяют 8 генотипов (не считая рекомбинантных), которые включают множество подтипов; наиболее распространены генотипы 1-3, наиболее вирулентный – 1b;
•репродукция типичная для сложных +РНК вирусов.
▪Антигенная структура:
•HCc-антиген («кόровый») – основной антиген;
•неструктурные белки и гликопротеины также являются антигенами.
154.2. Вирусный гепатит С: патогенез, иммунитет, профилактика
Эпидемиология такая же, как и у гепатита В. Инфицирующая доза у вируса гепатита С выше, поэтому парентеральный путь заражения имеет особое значение.
Инкубационный период составляет 35-70 дней. Клиническое течение более легкое, чем у гепатита В. Желтуха наблюдается редко, зачастую болезнь протекает в бессимптомной форме. Опасность заключается в том, что в 60% случаев процесс переходит в хроническое состояние. Болезнь сопровождается упадком сил, спленомегалией, диспепсическим синдромом. Иногда развиваются васкулиты и анемии. Примерно у трети людей с хронической формой в ближайшие десятилетия разовьется цирроз или карцинома печени.
Постинфекционный иммунитет в случае успешной элиминации вируса отсутствует.
Для лечения используют нуклеозидные ингибиторы, ингибиторы NS3 и NS5, эффек-
тивность лечения препаратами последнего поколения составляет 85-99% в зависимости от генотипа. Лечение длительное, дорогостоящее и сопровождается значительными побочными эффектами. Специфическая профилактика ввиду высокой антигенной изменчивости вируса не разработана.
Основными методами диагностики являются серологический (определение суммарных антител к «кόровому» антигену при помощи ИФА) и молекулярно-генетический (обнаружение РНК вируса в ПЦР). Для подтверждения положительных результатов ИФА используют рекомбинантный иммуноблот, по отдельности определяя IgG к различным антигенам вируса. Ввиду того, что антитела появляются только через 3 месяца после инфицирования, методом выбора является ПЦР.
53
154.3. Вирус гепатита G
Вирус гепатита G (современное название – Pegivirus C) относится к роду Pegivirus семейства Flaviviridae. Вирус является родственным по отношению к вирусу гепатита С, имеет схожее строение (за исключение отсутствия у него «кόрового» белка), однако, как позднее выяснилось, размножается преимущественно в лимфоцитах, а не в гепатоцитах.
Вирус передается парентеральным, половым и, реже, вертикальным путем. По некоторым оценкам, каждый шестой человек имеет в крови вирус или антитела к нему. В настоящее время считается, что вирус гепатита G не приводит к развитию каких-либо заболеваний человека, в том числе гепатитов (поэтому он и был переименован). Заражение заканчивается либо полной элиминацией возбудителя (симптомов при этом не возникает), либо развитием персистенции в форме здорового носительства.
Основные методы диагностики носительства – серологический (определение антител при помощи ИФА) и молекулярно-генетический (ПЦР).
54
155. Ретровирусы. Вирусы иммунодефицита человека (ВИЧ). ВИЧ-инфекция: патогенез, иммунитет, этиологическая диагностика (скрининг-тесты и методы установления диагноза), ВААРТ (критерии назначения, принцип действия), профилактика. СПИД-ассоциированные заболевания. Эпидемиология ВИЧинфекции в мире и в Республике Беларусь. Профилактика профессионального ВИЧ-инфицирования медработников
155.1. Ретровирусы
Ретровирусы (Retroviridae) – семейство сложных вирусов, включающее семь родов, представители которых вызывают заболевания млекопитающих, птиц и рыб. В патологии человека значение имеют представители рода Lentivirus (ВИЧ-1, ВИЧ-2) и Deltaretrovirus (вирусы Т-клеточных лейкозов: HLTV-1, HLTV-2).
Ретровирусы имеют уникальное строение генома и особый механизм репродукции:
•однонитевая нефрагментированная +РНК в виде двух идентичных молекул, соединенных между собой (единственное семейство с диплоидным геномом);
•имеют обратную транскриптазу (ревертазу), которая обладает активностью:
-РНК-зависимой ДНК-полимеразы (РНК→ДНК);
-ДНК-зависимой ДНК-полимеразы (ДНК→ДНК);
-РНКазы Н (в гибриде РНК-ДНК разрушает РНК);
•благодаря ревертазе РНК-геном вируса превращается в ДНК-геном и интегрируется
вклетку-хозяина, в результате чего она погибает или становится опухолевой;
•в связи с отсутствием у обратной транскриптазы систем контроля, частота мутаций при репликации высока, что обуславливает изменчивость вирусных белков и трудности в создании вакцин.
155.2. Вирусы иммунодефицита человека (ВИЧ)
Впервые заболевание, протекающее с глубокими нарушениями иммунной системы и, как считалось, поражающее гомосексуальных мужчин, было описано в 1981 г. в США после анализа ряда случаев, наблюдавшихся с 1978 г. Заболевшие погибали от оппортунистических инфекций (что случается редко среди здоровых молодых людей), а также от экзотической на то время опухоли – саркомы Капоши.
Первоначально новую нозологическую форму называли «болезнью четырех Г» (как полагали, группы риска: гомосексуалы, героинщики, гаитяне и гемофилики) или GRID (gay related immune deficiency – иммунодефицит гомосексуалистов).
В1982 г. заболевание было названо СПИД (синдром приобретенного иммунодефицита), а следом двумя учеными независимо был выделен вирус-возбудитель (Монтанье, Франция – 1983 г.; Галло, США – 1984 г.). В 1986 г. ему было присвоено название ВИЧ (вирус иммунодефицита человека).
Внастоящее время выделяют два вида вируса: ВИЧ-1 и ВИЧ-2 (выделен в 1986 г.). Оба они относятся к роду лентивирусов (Lentivirus) семейства ретровирусов (Retroviridae). Считается, что в человеческую популяцию вирусы проникли от обезьян. Они имеют принципиально общую структуру вирионов и геномов, но отличаются составом белков.
▪Общая характеристика:
•тип: сложный, симметрия икосаэдрическая;
•форма: сферическая;
•размеры: 100-120 нм;
•геном: однонитевая диплоидная нефрагментированная +РНК.
▪Структура (число характеризует массу в килоДальтонах):
•в липидную оболочку встроены гликопротеиновые шипы gp120 (на поверхности вириона) и gp41 (пронизывает липидную оболочку);
55

•сердцевина вируса состоит из нуклеокапсидных (p7, p9), капсидных (p24, p25),
матриксных (p6, p17) белков и белков протеазы (p10, p11).
▪Геном (всего 9 генов):
•структурный ген gag («групповые антигены») кодирует нуклеокапсидные, капсидные, мактриксные белки и белки протеазы;
•структурный ген pol («полимеразный») кодирует обратную транскриптазу и инте-
гразу;
•структурный ген env (envelope – «оболочка») у ВИЧ-1 кодирует гликопротеины gp120 и gp41;
•шесть функциональных генов: tat, rev, nef, vif, vpr, vpu (vpx у ВИЧ-2).
▪Антигенная структура:
•ВИЧ-1 и ВИЧ-2 отличаются геном env, а значит – гликопротеинами липидной оболочки;
•как и для всех ретровирусов, для ВИЧ характерно большое число мутаций, которые ведут к широкому антигенному разнообразию;
•для ВИЧ-1 выделяют 4 группы (M, N, O, P), причем в самой большой группе М различают 11 подтипов (A-K), среди которых наиболее распространены А, B и С;
▪Репродукция:
1)Гликопротеин gp120 связывается с CD4-рецептором (преимущественно Т-хелперов, но также макрофагов, моноцитов, астроглии и др.), оболочка ВИЧ сливается с ЦПМ, геномная РНК и обратная транскриптаза выходят в цитоплазму.
2)На геномной +РНК обратная транскриптаза синтезирует –ДНК, и уже на ней строится комплементарная цепь с образованием двойной кольцевой нити (кДНК).
3)Кольцевая ДНК интегрируется (фермент интеграза) с хромосомной ДНК клетки, образуя рекомбинант-
ную ДНК – провирус.
4)С провирусной ДНК синтезируют-
ся геномная РНК и мРНК, обеспе-
чивающие синтез компонентов вирионов.
5)Вирионы выходят из клетки поч-
кованием.
Результаты взаимодействия различных клеток с ВИЧ:
-Т-хелперы и астроциты – гибель;
-В-лимфоциты – поликлональная активация;
-моноциты, макрофаги, дендритные клетки – не деградируют, служат резервуаром.
155.3.ВИЧ-инфекция: патогенез, иммунитет. СПИД-ассоциированные заболевания
ВИЧ-инфекция – это медленная антропонозная инфекция, передающаяся через биологические жидкости (кровь, сперма, вагинальный секрет, грудное молоко). Наиболее частые пути заражения – половой, парентеральный, вертикальный. Воздушно-капельным, фекальнооральным и контактно-бытовым путем возбудитель не передается.
56
По состоянию на 2016 г. в мире насчитывается около 37 млн человек, зараженных ВИЧ. Примерно 2,5 млн человек заражается и 1 млн человек умирает ежегодно. Две трети случаев заражения и смерти приходятся на Африку, где к югу от Сахары вирусом заражено примерно 5% взрослого населения. В то же время ВИЧ-инфекция считается пандемической, поскольку проявляет себя во всех странах мира.
Воснове патогенеза болезни лежит прогрессирующее уменьшение количества CD4+-клеток (особенно Т-хелперов), которое возникает в результате их апоптоза, образования синцитиев (склеивания), аутоиммуных реакций или нарушения их пролиферации.
Вследствие этого возникает глубокий вторичный иммунодефицит, при котором резко снижена сопротивляемость организма оппортунистическим инфекциям и часто развиваются некоторые опухоли. Также вирус поражает ЦНС, вызывая гибель астроцитов, и как следствие
–нейронов.
Вразвитии болезни выделяют следующие стадии:
•инкубационный период (несколько недель или месяцев);
•стадия первичных проявлений (несколько дней или недель) – диссеминирование вируса, образование антител; клиника банальной острой инфекции – лихорадка, лимфаденопатия;
•субклиническая стадия (от нескольких месяцев до 10 лет) – медленное развитие иммунодефицита, субфебрильная температура, потеря массы тела, усталость, ночная потливость;
•стадия вторичных проявлений (несколько лет) – развитие оппортунистических инфекций, возможно появление признаков деменции из-за поражения ЦНС;
•терминальная стадия (СПИД – синдром приобретенного иммунодефицита) – утяжеление клиники оппортунистических инфекций, истощение, опухоли (саркома Кáпоши, неходжкинская лимфома), психические расстройства; средняя продолжительность жизни после постановки диагноза СПИД – 9 месяцев.
Заболевания, наиболее часто встречающиеся у ВИЧ-инфицированных (особенно у больных СПИД), называют СПИД-ассоциированными заболеваниями. Они могут развиваться и
уиммунокомпетентных лиц, но протекают обычно в скрытой или легкой форме. Болезни, которые у иммунокомпетентных лиц встречаются чрезвычайно редко и почти достоверно указывают на СПИД, называют СПИД-индикаторными.
К СПИД-ассоциированным и СПИД-индикаторным болезням относят:
- рецидивирующий кандидоз полости рта, а также кандидоз легких и пищевода; - лейкоплакия языка («волосатый язык»); - опоясывающий герпес;
- тяжелое течение цитомегаловирусной инфекции (ЦМВ); - пневмоцистная пневмония; - токсоплазмоз (особенно с поражением ЦНС);
- саркома Капоши (кожные бляшки на верхней части туловища, на слизистых рта).
В ответ на внедрение ВИЧ развивается гуморальный и клеточный иммунный ответ, однако парадоксальным образом он только способствует распространению вируса. Образующиеся антитела нейтрализуют лишь часть вирусов, действуя как фактор отбора и оставляя в циркуляции наиболее вирулентные клоны. В составе комплексов антиген-антитело вирус может распространяться. Кроме этого, антитела могут уничтожать и неинфицированные Т- хелперы и другие клетки, на которых окажутся вирусные белки.
Таким образом, разрушение иммунной системы происходит с момента проникновения вируса в организм.
155.4. ВИЧ-инфекция: этиологическая диагностика, профилактика и лечение
Хотя вирусом можно заразить перевиваемую культуру Т-лимфоцитов Н9, вирусологический метод используется не для диагностики, а для получения антигенов вируса.
Основу диагностики ВИЧ-инфекции составляет серологический метод, а именно:
57

•непрямой ИФА: в лунки с сорбированными ангигенами вносят разведенную сыворотку,
азатем отмывают и вносят антитела к иммуноглобулинам (антителам) человека, меченые ферментом; реакцию учитывают по изменению окраски среды; является методом скрининга;
•тест-системы для одновременного проведения прямого и непрямого ИФА;
•иммуноблоттинг: разделение белков ВИЧ электрофорезом, перенос на мембрану, инкубация с сывороткой больного, последующая отмывка и инкубация с антителами к иммуноглобулинам (антителам) человека, мечеными ферментами; результат оценивают по появлению окрашенных полосок на мембране после добавления субстрата (при отрицательном результате полоски отсутствуют); является подтверждающим методом диагностики.
Также применяются молекулярно-генетические методы, в особенности ПЦР с обратной
транскрипцией (ОТ-ПЦР). Важную роль играет определение абсолютного и относительного (CD4+/CD8+) числа CD4+-клеток в крови.
Специфическая профилактика ВИЧ-инфекции не разработана, создание вакцины затрудняется антигенной изменчивостью вируса. Неспецифическая профилактика эффективна и сводится к безопасному сексуальному поведению (постоянные партнеры, механические средства защиты), отказу от употребления наркотиков, тщательному отбору доноров крови, спермы, тканей и органов, соблюдению режимов дезинфекции и стерилизации. Для предупреждения вертикальной передачи все беременные женщины обследуются на ВИЧ.
Современным методом лечения ВИЧ-инфекции является высокоактивная антиретровирусная терапия (ВААРТ), состоящая в одновременном приеме трех или четырех препаратов различного направления действия. В результате лечения снижается вирусная нагрузка, восстанавливается состояние иммунной системы, увеличивается продолжительность (иногда до глубокой старости) и качество жизни больных. В то же время полного излечения добиться невозможно.
ВААРТ обязательно назначается при соблюдении одного из двух критериев: развитие СПИД (наличие СПИД-индикаторных заболеваний) или снижение количества CD4+- лимфоцитов < 200 в мкл.
В зависимости от мишени действия препараты ВААРТ делят на пять групп:
•ингибиторы проникновения;
•нуклеозидные ингибиторы обратной транскриптазы;
•ненуклеозидные ингибиторы обратной транскриптазы;
•ингибиторы интегразы;
•ингибиторы протеазы.
58
155.5. ВИЧ-инфекция в РБ и мире. Профилактика инфицирования медработников
По состоянию на 01.09.2017 в Республике Беларусь ВИЧ-инфекцией болеют 18,4 тыс. чел., а общее число случаев заражения составило 23,7 тыс. Примерно две трети случаев заражения происходят половым путем, почти все оставшиеся – парентеральным, небольшое число случаев – вертикальным. Диагностика и лечение ВИЧ-инфекции в РБ проводится бесплатно.
По состоянию на 2016 г., в мире живет 36,7 млн. человек с ВИЧ-инфекцией, около 29 млн. умерли с начала пандемии. Ежегодно заражается порядка 2,5 млн. человек и умирает около 1,0 млн. заболевших. Более двух третей ВИЧ-инфицированных заселяют Африку к югу от Сахары. Пять стран с наибольшим количеством ВИЧ-инфицированных включают Индию, ЮАР, Эфиопию, Нигерию и Кению. Самые высокие темпы роста заболеваемости, не считая африканского региона, наблюдаются в Российской Федерации.
Для профилактики ВИЧ-инфицирования медработники должны соблюдать следующие
меры предосторожности:
•при проведении процедур с возможным разбрызгиванием крови использовать маски,
защитные очки или пластиковые щитки;
•использование перчаток, а также халатов или фартуков;
•осторожное обращение с острым инструментарием;
•использование только автоматических пипеток;
•упаковка контаминированных материалов в надежную герметичную тару.
Риск заражения ВИЧ-инфекцией в процессе медицинских манипуляций в целом не очень высок (0,3% для глубокой колотой раны и менее 0,05% для поверхностной травмы или попадания крови на слизистые). Тем не менее, в связи с ее тяжестью в обязательном порядке проводится первичная профилактика (обработка раны мылом, 70% раствором этилового спирта, а затем 5% раствором йода), а при глубоких повреждениях и подтвержденном ВИЧположительном статусе источника также постконтактная химиопрофилактика (ВААРТ).
59
156. ДНК-вирусы: классификация. Аденовирусы: классификация, характеристика. Аденовирусные инфекции: патогенез, иммунитет, этиологическая диагностика. Бокавирус: характеристика, роль в патологии. Натуральная оспа: специфическая профилактика, эрадикация
156.1. ДНК-вирусы. Аденовирусы
ДНК-содержащие вирусы – вирусы, геном которых представлен ДНК и репликация, как правило, идёт посредством ДНК-зависимой ДНК-полимеразы без использования РНК как промежуточного звена-посредника.
К ДНК-вирусам относят представителей более 45 семейств, а также нескольких родов и видов, не отнесенных к каким-либо семействам. По классификации Балтимора они относятся к группе I, II или VII. Среди значимых для человека выделяют следующие семейства:
I группа (дцДНК): Herpesviridae (вирусы герпеса), Adenoviridae (аденовирусы), Papillomaviridae (папилломавирусы), Poxviridae (поксвирусы), Polyomaviridae (полиомавирусы);
II группа (оцДНК): Parvoviridae (парвовирус В19), Circoviridae (вирус гепатита ТТ); VII группа (дцДНК с обратной транскриптазой): Hepadnaviridae (вирус гепатита В).
156.2. Аденовирусы. Аденовирусные инфекции
Аденовирусы (Adenoviridae, от лат. adenoides, откуда впервые были выделены) – семейство вирусов, включающее более 5 родов, из которых для медицины имеет значение один – Mastadenovirus, представители которого поражают млекопитающих. Общее количество серотипов аденовирусов млекопитающих превышает 100, более 50 из них патогенны для человека.
▪Общая характеристика:
•тип: простой, симметрия икосаэдрическая;
•форма: икосаэдр, приближена к сферической;
•размеры: 70-90 нм;
•геном: двунитевая линейная ДНК.
▪Структура:
•ДНК вместе с белками формирует 12-петельный дезоксирибонуклеопротеид;
•капсид состоит из 252 капсомеров, из них 240 (гексоны) образуют грани, 12 (пентоны) образуют вершины капсида;
•к пентонам прикреплены фибры – гликопротеиновые нити с головкой; и пентоны, и фибры обладают гемагглютинирующей активностью.
▪Репродукция:
•типичная для простых ДНК-вирусов (транскрипция и репликация – в ядре, трансляция – в цитоплазме);
•цикл репродукции обычно завершается лизисом клетки (как и у всех простых вирусов), но при поражении лимфоидных клеток может развиться латентная инфекция;
▪Антигенная структура:
•нуклеокапсид – комплементсвязывающий антиген, идентичный у всех сероваров;
•А-антиген (гексоны) – группоспецифический антиген;
•В-антиген (пентоны) – антиген подгрупп (всего 3);
•С-антиген (фибры) – типоспецифический (определяет серовар).
▪Диагностика (материал – смывы из носоглотки, отделяемое конъюнктивы, фекалии):
•экспресс-метод: прямая РИФ;
•вирусологический метод: заражение культур эпителиальных клеток; индикация – ЦПД (внутриядерные включения, мелкоклеточная дегенерация, зернистость), идентификация – РИФ, РСК, РН;
•серологический метод: исследование парных сывороток в РСК, РН, РТГА, ИФА;
60
