
3175
.pdf
|
20 |
|
|
|||
M см |
|
|
1 |
|
, |
|
|
|
|
|
|||
n |
|
gi |
|
|||
|
|
|
|
|
||
|
M i |
|
|
|||
|
|
i1 |
|
|
|
|
- кажущаяся молекулярная масса смеси. Названа так, поскольку не существует однородного химического соединения с такой молекулярной массой.
Аналогично для плотности смеси
см n 1gi .
i1 i
Очевидно, что кажущаяся молекулярная масса смеси может быть определена и как отношение универсальной газовой постоянной к газовой постоянной смеси
M |
|
|
8314.3 |
. |
см |
|
|||
|
|
Rсм |
||
|
|
|
||
2. Смесь задана объемными долями.
Иногда удобно задавать смесь по объемному составу. Для каждого газа, входящего в смесь по закону Бойля-Мариотта можем записать
p V |
p |
|
V , откуда |
p p |
|
Vi |
r p |
|
, |
|
см V |
|
|||||||
i см |
|
см |
i |
i |
i |
см |
|
||
|
|
|
|
|
|
см |
|
|
|
- парциальное давление компонента смеси равно произведению объемной доли i - го компонента на давление смеси.
Кажущаяся молекулярная масса смеси может быть определена следующим образом:
n |
|
|
|
|
|
|
n |
mсм mi , но |
m nM , и тогда |
nсм M см |
ni M i , |
||||
i 1 |
|
|
|
|
|
|
i 1 |
откуда: |
|
|
|
|
|
|
|
|
|
|
|
n |
ni |
|
|
|
M см |
M i . |
|||||
|
|
||||||
|
|
|
|
i 1 |
nсм |
|
|
Учитывая, что |
|
|
|
|
|
|
|
|
|
ni |
|
|
|
r , |
|
|
|
|
|
i |
|||
|
|
nсм |
|
|
|
i |
|
|
|
|
|
|
|
|
|
получим |
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
n |
|
M см ri M i |
|
i M i , |
||||
|
|
i 1 |
|
|
|
|
i 1 |
- равна сумме произведений молекулярных масс газов, входящих в смесь, на их объѐмные (мольные) доли.
Аналогично, для плотности смеси
n
см ri i .
i 1
Газовая постоянная смеси находится по соотношению
R |
|
8314.3 |
. |
|
|||
см |
|
n |
|
|
|
ri M i |
|
|
|
i 1 |
|
Связь между массовыми и объѐмными долями:

21
1). Имеет место следующая зависимость:
g |
|
|
mi |
|
Vi i |
r |
i |
, |
||
|
|
V |
|
|
|
|||||
|
i |
|
m |
|
см |
i |
см |
|
||
|
|
|
см |
|
см |
|
|
|
||
или
ri gi см .
i
2). По закону Авогадро
V M const , |
|
или |
|
|
|
|
|
M см |
const , |
||||||||
|
|
|
|
|
|
|
|
|
|||||||||
m |
|
|
|
|
|
|
|
|
|
|
|
|
см |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
поэтому |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M см |
|
|
M i |
|
, |
или |
i |
|
|
M i |
, |
|||||
|
|
|
|
|
|
|
|
|
|||||||||
|
см |
|
i |
|
|
см |
|
|
|
M см |
|||||||
при этом |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
g |
r |
|
M i |
, |
или |
r g |
|
|
M см |
, |
||||||
|
|
|
|
|
|
||||||||||||
|
i |
|
i |
M см |
|
|
i |
|
i M i |
||||||||
3). Газовая постоянная смеси МОЖЕТ быть определена по составу смеси и газовым постоянным отдельных компонентов. Т.к.
Ro M R const , |
то M i Ri |
M R и |
|
|
|
|
|
|
|
|||||||
|
M i |
|
Rсм |
, |
или |
M см |
|
Ri |
. |
|||||||
|
|
|
|
|
|
|
|
|
||||||||
|
M см |
|
|
Ri |
|
M i |
|
|
Rсм |
|||||||
Тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
g |
|
r |
|
Rсм |
, |
или |
r g |
|
|
Ri |
|
||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
i |
|
i |
R |
|
i |
i |
R |
|||||||
|
|
|
|
|
|
i |
|
|
|
|
|
см |
||||
Формулы для расчѐта газовых смесей
Задание состава |
По массовым |
По объёмным |
смеси |
долям |
долям |
|
|
|

22
Пересчёт из одного состава в другой
Плотность и удельный
кг м3
объём, м3 и кг
Кажущаяся молекулярная масса смеси
Газовая постоянная смеси, Дж/кгК
Парциальное давление, Па
ri gi см
i
ri gi M см M i
ri gi Ri
Rсм
см n 1gi i 1 i
см n gi i 1 i
M см n 1gi
i 1 M i
n
Rсм gi Ri
i 1
pi pсм gi Ri
Rсм
gi ri i
см
gi |
ri |
|
M i |
|
M см |
||||
gi |
ri |
Rсм |
||
R |
|
|||
|
|
|
i |
|
n
см ri i
i 1
см n 1
ri i
i 1
n
M см ri M i
|
|
i 1 |
|
|
|
|
|
R |
|
8314.3 |
|
см |
|
n |
|
|
|
ri M i |
|
|
|
i 1 |
|
|
|
|
|
pi ri pсм
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Теплота и работа
Неотъемлемым свойством материи является движение. Энергия - общая мера различных форм движения материи. Теплота и работа являются различными формами передачи энергии. Поэтому не имеет смысла говорить, что тело обладает каким-то запасом тепла или работы. Можно лишь констатировать, что телу сообщена (или от тела отнята) определѐнная теплота или определѐнная работа.
23
Привычное и, казалось бы, столь очевидное понятие, как теплота, оказалось не самом деле непростым. Природу теплоты объясняли бесспорным и очевидным как будто бы фактом: при нагревании системы ее температура повышается - значит, система получает «что-то». И наоборот. Это «что-то» было названо теплотой. Были высказаны две гипотезы.
1.) (Г. Галилей): теплота - это вещество, т.е. теплород, который не порождается и не уничтожается, а только перераспределяется между телами. Отсюда, слово "температура» - смесь (из материи тела и теплорода). Градус температуры выражал крепость этой смеси. (Понятен обычай мерить в градусах крепость вина - смесь воды и спирта).
2.) (Ф. Бэкон): теплота есть внутреннее движение мельчайших частиц тела, и температура тела определяется скоростью движения частиц в нем (механическая теория теплоты) - Ломоносов (1748 г.).
Обе гипотезы позволяют говорить о количестве теплоты, содержащейся в системе. По обеим гипотезам, изменение количества теплоты в системе определяется только начальным и конечный состояниями системы и не зависит от пути перехода.
В XIX века наука пришла к очень важному выводу: теплота не содержатся в системе и не является свойством системы.
Поэтому обе гипотезы неверны, хотя вторая и применима, только не к теплоте, а к тепловой энергии системы.
Количество тепловой энергии в термодинамическом процессе является мерой тепловой энергии, подведенной к системе или отведенной от системы.
Дж. К. Максвелл говорил: «Мы должны тщательно запомнить: мы знаем о теплоте только то, что случается, когда теплота переходит от одного тела к другому. Мы не должны предполагать, что теплота, когда она вошла в систему, существует в вей в виде теплоты».
Можно говорить лишь о том, сколько тело отдаст или получит теплоты в том или ином процессе. Количество теплоты зависит и от пути, по которому происходило изменение его состояния.
Теплота - передача беспорядочного движения посредством ударов молекул (причем контакт двух тех с различными температурами необязателен).
Количество теплоты, полученное телом, принято считать положительным, а отданное телом – отрицательным. Единицей количества теплоты является джоуль.
Работа представляет собой иной механизм передачи энергии и является мерой механической энергии. В случае механической работы обязательно имеет место изменение объѐма тела. Работа - это передача упорядоченного движения от одного участника к другому с преодолением сопротивления. Она производится при перемещении тела в пространстве под действием механической силы. Измерение ее произведет таким образом: (работа [1 Дж]) = (сила, постоянная и действующая вдоль перемещения [1 Н ] ) умноженная на (перемещение [1м] ).
Но очень важно уметь вычислять работу по данным и о термодинамической системе.
В дальнейшем мы получим очень важный для термодинамики вывод: работа также не является функцией состояния, а есть функция процесса, т.е. работа не является свойством системы.
Тетерь мы видим, что по своему существу понятие теплоты близко к понятию работы. Можно оказать, что теплота - определѐнный вид работы, но особого рода работы, совершаемой, так сказать, на молекулярном уровне, т.е. молекулами больших энергий над молекулами меньших энергий.
Принцип эквивалентности
В 1798 г. английский учѐный Румфорд обнаружил, что в результате трения тупого резца о внутреннюю поверхность орудийного ствола температура ствола возрастает вследствие

24
выделения тепла. При этом тепло может выделяться столь долго, сколь долго вращается орудийный ствол. Румфорд делал вывод о том, что «если изолированное тело или система тел способны без ограничения производить теплоту, то она не может быть материальной субстанцией», и что «только движение в состоянии обеспечить непрерывное возбуждение и распространение тепла в наших опытах». Потрясли теорию теплорода и опыты англичанина Дэви, показавшего, что два куска льда или жира, или воска можно расплавить простым трением друг о друга без соприкосновения с каким-либо более нагретым телом.
Врач Ю. Р. Майер в 1840 г, поразился светлой венозной крови у жителей острова Ява. У европейцев она темная. Вследствие высокой температуры тропиков организм должен вырабатывать меньше теплоты для покрытия ее потерь, чем при более низкой температуре в Европе. Поэтому в условиях тропиков артериальная кровь должна меньше раскисляться. «Человеческий организм - тепловая машина" – Лавуазье. У работы и теплоты один и тот же источник - окисленная в организме пища. Майер делает важнейший для термодинамики вывод: «теплота и движение превращаются друг в друга».
Но закон неизменного количественного отношения между движением и теплотой должен быть выражен также числовым образом.
В результате серии превосходно поставленных в I843-I850 г.г. опытов английский физик ДЖ. П. Джоуль установил, что между затраченной работой L и количеством подученного тепла Q существует прямая пропорциональность
Q=AL
где А - коэффициент пропорциональности. Т.е. Джоуль установил, что при затрате одного и того же количества работы выделяется всегда одно и то же количество тепла. Таким образом, было показано, что количество полученного тепла эквивалентно количеству затраченной работы; понятно, что это соотношение справедливо и при совершении работы за счѐт затраты тепла.
Из результатов своих измерений Джоуль вычислил величину А, которая носит
наименование термического или теплового эквивалента работы, и |
J - механического |
||||||||||
эквивалента тепла: |
|
|
|
|
|
|
|
|
|
||
А=0,002345 |
ккал |
, и |
J |
=427 |
кгс м |
. Очевидно, что |
J |
1 |
|
Численные значения |
|
кгс м |
ккал |
|
|||||||||
|
|
|
|
|
|
|
|||||
термического эквивалента работы приведены в таблице:
Q |
L |
A |
Ккал |
кгм |
1 |
|
|
|
|
|
||
|
|
427 ккал/кг•м |
||
|
|
|
||
Ккал |
кВт•ч |
|
860 ккал/кВт•ч |
|
|
|
|
|
|
Дж |
кг•м |
|
9,81 Дж/кгм |
|
|
|
|
||
Ккал |
л.с. •ч |
623,3 ккал/л.с.•ч |
||
|
|
|
||
Дж |
Дж |
1 |
||
|
|
|
|
|

25
Соотношение между единицами работы и тепла:
Единицы |
Дж |
Эрг |
кгс•м |
ккал |
квт•ч |
|
1 Дж |
1 |
7 |
0,101972 |
2,38846• |
2,7778• |
|
|
|
|||||
10 |
10 4 |
10 7 |
||||
|
|
|
||||
1 эрг |
7 |
1 |
9 |
23,8846• |
27,778• |
|
10 12 |
10 15 |
|||||
|
10 |
|
10,1972•10 |
|||
1 кгс•м |
9,80665 |
6 |
1 |
3 |
2,72407• |
|
10 6 |
||||||
|
|
98,0665•10 |
|
2,34228•10 |
||
1ккал |
4186,8 |
9 |
462,935 |
1 |
1,163• |
|
|
||||||
41,868•10 |
10 3 |
|||||
|
|
|
|
|||
1квт•ч |
3,6•106 |
36•1012 |
367098 |
859,845 |
1 |
В дальнейшем для упрощения обозначений в термодинамических уравнениях не будут фигурировать коэффициенты A и J - теплота и работа будут измеряться в одинаковых единицах. В системе СИ, когда теплота в работа выражаются в джоулях,
J = = I .
Обобщая принцип эквивалентности теплоты и механической работы, можно утверждать, что все виды энергии, несмотря на их качественное различие, находятся в определѐнном эквивалентном отношении друг к другу.
ВНУТРЕННЯЯ ЭНЕРГИЯ
В общем случае полная энергия ТРТ складывается из его внутренней и внешней энергии
E = U + Eмех
Внутренняя энергия U тела складывается из энергии поступательного и вращательного движения молекул, составляющих тело, энергии внутримолекулярных колебаний, потенциальной энергии сил сцепления между молекулами, внутримолекулярной энергии, внутриатомной и внутриядерной энергии.
В любом состоянии система, изолированная от внешней среды или находящаяся во взаимодействии с ней, располагает определѐнным количеством внутренней энергии.
Изменение внутренней энергии не зависит от вида процесса изменения состояния тела, а только от начального и конечного состояний, определяемым по его параметрам. При совершении цикла, когда система возвращается в исходное положение, еѐ внутренняя энергия принимает то же значение, что и до свершения цикла
dU 0
Т.е. дифференциал dU представляет собой полный дифференциал, а U является функцией состояния системы и относится к тому же разряду величин, что и давление, удельный объѐм и температура.
В 1843 г. Джоуль сформулировал весьма важный закон: “ Внутренняя энергия идеального газа зависит лишь от его температуры”. Это объясняется тем, что в идеальном

26
газе силы взаимодействия между частицами отсутствуют, вследствие чего внутренняя потенциальная энергия их равна нулю и внутренняя энергия состоит только из внутренней кинетической энергии, которая определяет температуру идеального газа
Uид. (Т)
Это положение можно распространить и на реальные газы небольшой плотности.
Вобщем случае, для реальных газов внутренняя энергия, являясь функцией состояния вещества системы, определяется двумя независимыми термодинамическими параметрами.
Впеременных p, ; p,T; T, – выражение для dU соответственно имеет вид
dU(p, )
dU(p,T)
dU(T, )
|
U |
|
|
U |
|
|
|
d |
|||
|
|
|
dp |
|
|
|
p |
V |
|
P |
|
|
U |
|
|
U |
|
|
|
dT |
|||
|
|
|
dp |
|
|
|
p |
T |
|
T P |
|
U |
|
|
U |
d |
|
|
|
|
dT |
|
|
|
T |
V |
|
T |
|
Внутренняя энергия – величина аддитивная и для сложной системы определяется суммой внутренних энергий еѐ частей U Ui . Она всегда известна с точностью до
некоторой аддитивной постоянной, определение которой теряет смысл, если чаще всего нас интересует изменение внутренней энергии.
Обычно считают, что внутренняя энергия газа равна нулю при нормальных условиях.
Внутренняя энергия 1 кг газа обозначается u и в СИ измеряется в Дж/кг; используется также внесистемная единица ккал/кг, между ними существует соотношение
1 ккалкг 4186,8 Джкг 4,19 кДжкг
Внешняя механическая энергия Е мех рабочего тела складывается из кинетической энергии Ек его поступательного движения и потенциальной энергии Еп, представляющей собой энергию взаимодействия гравитационного поля с ТРТ.
Закон сохранения и превращения энергии
Является фундаментальным законом природы, имеющим всеобщий характер. Он гласит: энергия не исчезает и не возникает вновь, она лишь переходит из одного вида в другой в различных физических и химических процессах. Т.е. количество энергии, заключѐнное в изолированной системе, сохраняется неизменным.
Применительно к механике этот закон впервые был сформулирован М.В. Ломоносовым в 1760 г. в труде “Рассуждения о твѐрдости и жидкости тел”. Но его научные работы были известны узкому кругу специалистов.
После установления принципа эквивалентности теплоты и работы, закон сохранения был распространѐн на другие виды энергии и в соответствии с его содержанием стал называться законом сохранения и превращения энергии.
Р.Э. Клаузиус назвал принцип эквивалентности первым началом термодинамики. “Во всех случаях круговых процессов, когда из теплоты появляется работа, тратится пропорциональное полученной работе количество тепла, и наоборот, при затрате той же работы получается то же количество тепла”.
Формулировки первого начала термодинамики

27
Их можно предложить несколько.
1.Энергия изолированной системы сохраняется. При любых процессах, происходящих внутри такой системы, энергия может переходить из одних форм в другие, но общее еѐ количество не изменяется.
Если система не изолирована, то изменение энергии еѐ при переходе из одного состояния в другое равно энергии, полученной системой в результате всех внешних воздействий на эту систему.
2.Вечный двигатель (perpetuum mobile) первого рода невозможен, т.е. невозможен вечный двигатель, в котором производится работы больше, чем затрачено энергии. (Движения тел на Земле подвержены трению, теряют свою механическую энергию и всегда прекращаются, если не поддерживаются извне. Первый документ с идеей вечного двигателя относится к XIII в. и уже в 1775 г. Французская академия наук отказалась рассматривать машины, дающие вечное движение).
3.Данному количеству переданного тепла эквивалентна вполне определѐнная работа: существует механический эквивалент тепла I = 4,1886 Дж/кал и тепловой эквивалент работы A = 0,24 кал/Дж. В системе СИ все виды энергии измеряются в Дж и поэтому эквиваленты тепла и работы численно равны единице.
Виды работ
Рассмотрим термодинамическую систему, состоящую из цилиндра, внутри которого находится поршень с площадью поверхности F, перемещающийся без трения; рабочего тела – газа, объѐм которого V, давление p; и внешней среды, имеющей
параметры p' , V . Если система находится в равновесном состоянии, то p' p . При
совершении равновесного процесса путѐм, например, подвода элементарного количества тепла dQ к рабочему телу, произойдѐт перемещение поршня на dS, в результате чего будет совершена работа dL против сил внешнего давления p' , называемой работой
расширения или деформации |
|
|
|
|
|
|
где |
dL p FdS P dS |
p dV , |
||
|
|
|
|
P |
p F . |
|
|
Учитывая равновесность процесса можно
записать
dL = pdV - изменение объѐма газа из–за
подведѐнной теплоты сопровождается работой,
равной произведению давления, под которым находится газ, на изменение его объѐма. Эта работа совершается системой над окружающей
средой и производится только тогда, когда изменяется объѐм тела и когда внешнее давление не равно нулю.
Полученное выражение показывает, что эта работа будет тем больше, чем большим объѐмным расширением будет обладать ТРТ. К таковым относятся газы и пары, поэтому они и являются основными ТРТ в существующих тепловых двигателях.
Т.к. абсолютное давление p – величина положительная, то dL и dV по знаку одинаковы. Поэтому, если dV>0, следовательно, работа расширения положительна. Если dV<0, т.е. газ сжимается, то и dL<0, следовательно, работа сжатия отрицательна.
Работа расширения при конечном перемещении поршня от положения 1 до положения 2

28
L VV12 pdV , Дж
Если отнести работу к 1 кг газа, то получим соответствующие выражения для удельной работы l, Дж/кг:
d = pdv
VV12 pdv
Графически удельная работа расширения выражается площадью под кривой процесса 1- 2 в pv – координатах. Очевидно, что работа расширения газа зависит от характера процесса или от пути, которым газ переходит из начального в конечное состояние. Например, при переходе из начального 1 в конечное состояние 2 в процессе 1 – m – 2 работа газа изобразится площадью a 1 m 2 b.
А в процессе 1 – n – 2 площадью a 1 n 2 b. 

 Следовательно, работа расширения не является функцией состояния, а является функцией процесса и работа замкнутого цикла не равна нулю
Следовательно, работа расширения не является функцией состояния, а является функцией процесса и работа замкнутого цикла не равна нулю
d 0
Для того, чтобы получить выражение основного уравнения первого закона термодинамики в развѐрнутом виде необходимо получить явный вид выражения для работы против внешних сил сопротивления dLвн.
В общем случае внешняя работа против сил давления dLвн для движущегося ТРТ может состоять из работы вытеснения dLвыт и технической работы dLтех.
dLвн = dLвыт + dLтех
Работа вытеснения должна производиться в любом сечении потока жидкости, т.к. она и обуславливает собой непрерывное движение ТРТ. Еѐ можно определить как разность работ совершѐнных отбегающим и набегающим столбами жидкости.
Технической работой называется работа силы реакции движущегося ТРТ в подвижном канале. Эта сила на стенки канала возникает лишь при течении по каналу с ускорением (линейным и угловым). Примерами технической работы являются полѐтная (или тяговая) работа по перемещению летательного аппарата, работа газовой турбины, компрессора и др., когда канал с газом (сопло или рабочее колесо турбины или компрессора) перемещается в пространстве. Величина этой работы будет зависеть от закона перемещения стенок канала в пространстве, который может быть задан
29
произвольным образом. Если стенки канала закреплены (неподвижны), то техническая работа равна нулю. Техническая работа может не только отбираться от потока, но и подводиться к потоку: поток может нагнетаться центробежным насосом, перекачиваться электромагнитным насосом и т.д.
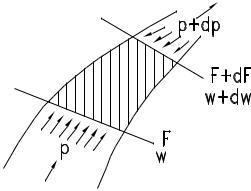
Для получения общего выражения работы вытеснения рассмотрим неподвижный канал произвольного сечения, по которому газ движется с ускорением. Течение одномерное, установившееся. В силу неразрывности течения на установившемся режиме через любое сечение канала будет проходить за
|
|
|
1 с одно и то же количество газа m кг/с |
|
|
|
|
|
(G) |
m Fw |
(*) |
где F – площадь поперечного сечения канала; w
– скорость в данном сечении; – плотность в данном сечении.
Применим метод Эйлера. Выделим двумя
бесконечно близкими сечениями элементарный
объѐм газа. Суммарная работа сил давления,
 действующих на выделенный элемент движущегося газа, равна разности работ сил, действующих на торцы элемента со стороны внешних объѐмов газа. Работа со стороны стенок равна нулю, поскольку в направлении сил давления, действующих на стенки, газ не перемещается.
действующих на выделенный элемент движущегося газа, равна разности работ сил, действующих на торцы элемента со стороны внешних объѐмов газа. Работа со стороны стенок равна нулю, поскольку в направлении сил давления, действующих на стенки, газ не перемещается.
Таким образом, работа внешних сил давления равна работе вытеснения за единицу времени (1 с):
dLвыт = (p + dp)(F + dF)(w + dw) - pFw
Работа на торцах имеет разные знаки, т.к. направление скорости одинаково, а направление сил давления противоположно.
После преобразований, пренебрегая величинами высших порядков малости, получим
