
1318
.pdf81
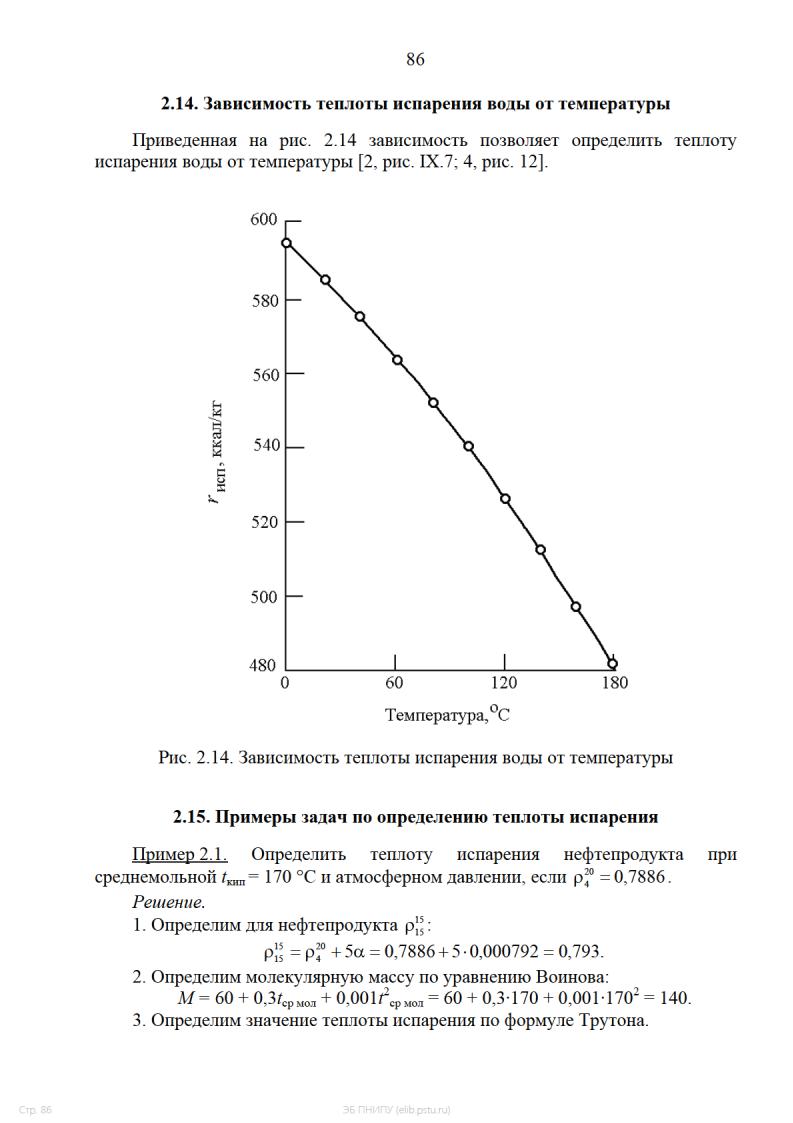
2.10. График для определения теплоты испарения некоторых соединений
Представленный на рис. 2.10 график позволяет определить теплоту
испарения некоторых соединений (углеводородов, спиртов, аммиаки и воды) в
зависимости от температуры [2, рис. IX.5].
2.11. График для определения теплоты испарения нефтяных фракций
Приведенный на рис. 2.11 график позволяет определить теплоту испарения нефтяных фракций по средней температуре кипения и плотности или молекулярной массе [2, рис. IX.6б].
2.12. График для определения теплоты испарения парафиновых углеводородов
По графику, приведенному на рис. 2.12, можно определить теплоту испарения парафиновых углеводородов от C3H8 до C19H40 [2, рис. IX.6в].
2.13. Определение теплоты испарения по эталонному соединению
Теплоты испарения родственных соединений изменяются закономерно.
Это позволяет найти зависимость теплоты испарения от температуры для члена данного гомологического ряда (рис. 2.13), используя, например, принцип
соответственных состояний и подобия свойств. Так, по Карапетьянцу,
|
Lисп1 |
= K = const , |
(2.6) |
|
|
||
|
Lисп2 |
|
|
где Lисп1, Lисп2 – теплоты испарения соединений 1 и 2 при температурах, |
|||
равноудаленных от соответствующих критических |
температур, т.е. |
||
Tкр1 – T1= Tкр2 – T2;
K – постоянная.
Для вычисления постоянной K надо знать Lисп1 какого-либо эталона 1
(обычно воды) для некоторых температур, значения Tкр1 и Tкр2 и одно
значение Lисп2 соединения 2. Тогда можно вычислить любое значение по
зависимости |
Lисп2 = KLисп1. Приведем K для некоторых веществ (Kводы = 1) |
||||
[2, рис. IX.6а]: |
|
|
|
|
|
Cl2 |
0,272 |
СH4 |
0,354 |
С2H5OС2H5 |
0,772 |
CO2 |
0,560 |
С6H6 |
0,827 |
С2H5Сl |
0,725 |
NH3 |
0,678 |
СH3OH |
1,010 |
СH3COOСH 0,679 |
|
SO2 |
0,730 |
СH3COСH3 |
0,856 |
С6H5Сl |
0,917 |
Стр. 81 |
ЭБ ПНИПУ (elib.pstu.ru) |





|
87 |
|
|
|
|
|
Значение функции Гильдербранта f = |
1000P |
= |
|
1000 1 |
= 2,26. |
|
T |
170 +273 |
|||||
|
|
|
||||
По графику (см. рис.2.4) определим значение поправочного коэффициента
K = 22.
Теплота испарения r = K T = 22170 + 273 4,187 = 291 кДж/кг.
M 140
4. Определим теплоту испарения по графику (см. рис. 2.1) в зависимости от среднемольной температуры кипения и молекулярной массы:
r = 283 кДж/кг.
Ответ. Теплота испарения нефтепродукта по формуле Трутона равна
291 кДж/кг, по рис. 2.1 – 283 кДж/кг.
Пример 2.2. Найти теплоту испарения нефтяной фракции при 200 °С молекулярной массы 268,3 и давлении 4,0 кПа.
Решение.
Молекулярной массе 268,3 соответствует углеводород С19H40. Теплоту испарения определим по номограмме, приведенной на рис. 2.2:
r = 256 кДж/кг.
Ответ. Теплота испарения нефтяной фракции при давлении 4,0 кПа равна
256 кДж/кг.
Пример 2.3. Определить мольную теплоту испарения углеводорода, если при температуре t1 = 127 оС давление его насыщенного пара P1 = 24600 Па, а при температуре t2 = 207 оС P2 = 114800 Па.
Решение.
На номограмме (см. рис.2.6) отметим точки с координатами t1 = 127 оС,
P1 = 24600 Па = 185 мм рт.ст. и t2 = 207 оС, P2 = 114800 Па = 863 мм рт.ст.
Соединим точки линией до пересечения со шкалой r и определим мольную теплоту испарения r = 7,4 ккал/моль или 31 кДж/моль.
Ответ. Мольная теплота испарения углеводорода равна 31 кДж/моль.
2.16. Задачи для самостоятельного решения
Задача 2.1. Определить теплоту испарения нефтепродукта при давлении P,
имеющего ρ204 , Pкр, среднюю tкип. Варианты заданий представлены в табл. 2.2.
Задача 2.2. Определить мольную теплоту испарения углеводорода, если
при температуре t1 давление его насыщенного пара равно P1, а при температуре t2 – P2. Варианты заданий представлены в табл. 2.3.
Стр. 87 |
ЭБ ПНИПУ (elib.pstu.ru) |
88
|
|
Варианты заданий к задаче 2.1 |
|
Таблица 2.2 |
|
|
|
|
|
||
|
|
|
|
|
|
Номер |
ρ420 |
|
Средняя температура |
Pкр, МПа |
P, МПа |
варианта |
|
|
кипения, °С |
|
|
|
|
|
|
|
|
1 |
0,706 |
|
80 |
4,500 |
1,3 |
2 |
0,718 |
|
90 |
4,300 |
1,6 |
3 |
0,729 |
|
100 |
4,200 |
1,9 |
4 |
0,739 |
|
110 |
4,150 |
2,3 |
5 |
0,748 |
|
120 |
4,100 |
2,5 |
6 |
0,757 |
|
130 |
4,050 |
1,2 |
7 |
0,765 |
|
140 |
4,000 |
1,4 |
8 |
0,773 |
|
150 |
3,950 |
1,5 |
9 |
0,706 |
|
80 |
3,900 |
1,8 |
10 |
0,718 |
|
90 |
3,850 |
1,7 |
11 |
0,729 |
|
100 |
3,800 |
2,0 |
12 |
0,739 |
|
110 |
3,750 |
1,3 |
13 |
0,748 |
|
120 |
3,700 |
1,6 |
14 |
0,757 |
|
130 |
3,650 |
1,9 |
15 |
0,765 |
|
140 |
3,600 |
2,3 |
16 |
0,773 |
|
150 |
3,550 |
2,5 |
17 |
0,706 |
|
80 |
3,500 |
1,2 |
18 |
0,718 |
|
90 |
3,450 |
1,4 |
19 |
0,729 |
|
100 |
3,400 |
1,5 |
20 |
0,739 |
|
110 |
3,350 |
1,8 |
21 |
0,748 |
|
120 |
3,300 |
1,7 |
22 |
0,757 |
|
130 |
3,250 |
2,0 |
23 |
0,765 |
|
140 |
3,200 |
1,8 |
24 |
0,773 |
|
150 |
3,150 |
1,7 |
25 |
0,706 |
|
80 |
3,100 |
2,2 |
Стр. 88 |
ЭБ ПНИПУ (elib.pstu.ru) |
89
|
Варианты заданий к задаче 2.2 |
Таблица 2.3 |
|||
|
|
||||
|
|
|
|
|
|
Номер |
t1 |
P1, МПа |
t2 |
P2, МПа |
|
варианта |
|||||
|
|
|
|
||
|
|
|
|
|
|
1 |
105 |
20,3 |
157 |
111,4 |
|
2 |
121 |
31,5 |
270 |
129,3 |
|
3 |
127 |
18,5 |
284 |
145,2 |
|
4 |
139 |
20,3 |
274 |
129,3 |
|
5 |
103 |
31,5 |
157 |
145,2 |
|
6 |
105 |
18,5 |
270 |
111,4 |
|
7 |
121 |
20,3 |
284 |
129,3 |
|
8 |
127 |
31,5 |
168 |
92,5 |
|
9 |
139 |
18,5 |
270 |
111,4 |
|
10 |
143 |
20,3 |
284 |
129,3 |
|
11 |
105 |
31,5 |
157 |
145,2 |
|
12 |
121 |
18,5 |
270 |
129,3 |
|
13 |
127 |
20,3 |
284 |
145,2 |
|
14 |
139 |
31,5 |
274 |
111,4 |
|
15 |
103 |
18,5 |
157 |
129,3 |
|
16 |
105 |
20,3 |
270 |
145,2 |
|
17 |
121 |
31,5 |
284 |
111,4 |
|
18 |
127 |
40 |
157 |
129,3 |
|
19 |
139 |
18,5 |
270 |
145,2 |
|
20 |
143 |
20,3 |
284 |
129,3 |
|
21 |
127 |
31,5 |
284 |
145,2 |
|
22 |
101 |
18,5 |
157 |
111,4 |
|
23 |
143 |
20,3 |
270 |
129,3 |
|
24 |
105 |
38,5 |
284 |
145,2 |
|
25 |
121 |
47,2 |
157 |
105,7 |
|
Стр. 89 |
ЭБ ПНИПУ (elib.pstu.ru) |

90
3. ЭНТАЛЬПИЯ
Энтальпия представляет собой функцию состояния, равную сумме внутренней U и объемной энергий PV.
Энтальпия относится к термодинамическим функциям, изменение которых не зависит от направлений протекания процесса, а определяется начальным и конечным состоянием тела.
При термодинамических расчетах важно не абсолютное значение
энтальпии, а ее изменение, поэтому температура начала отсчета энтальпии
может быть произвольной, но одинаковой и постоянной для всех веществ, участвующих в процессе.
За исходную температуру T0 принимается либо 273 К, либо 0 К, т.е. энтальпия условно принимается равной нулю либо при 273 К, либо при 0 К.
Энтальпия жидкости при заданной температуре численно равна количеству тепла, необходимого для нагрева единицы количества вещества от температуры T0 до заданной температуры T.
Энтальпия газов или паров при заданной температуре равна количеству
тепла, необходимого для нагрева единицы количества вещества от температуры T0 до заданной температуры T с учетом теплоты испарения при той же температуре T и перегрева газов или паров.
3.1.Энтальпия жидких нефтепродуктов
Втабл. 3.1 [11, табл. 1.7; 10, табл. П.2] и 3.2 [11, табл. 1.8; 10, табл. П.3]
приведены значения энтальпии жидких нефтепродуктов в зависимости от
температуры и относительной плотности ρ1515 .
3.2. Энтальпия углеводородных жидкостей
Энтальпию жидких углеводородов от С1 до С8 в зависимости от температуры можно определить по графикам, приведенным на рис. 3.1 и 3.2
[7, рис. II.20]. Энтальпия жидкости в состоянии насыщения при t = 0 оС
и P = 0,1 МПа принята равной нулю.
3.3. Энтальпия жидких нефтяных фракций
Для определения энтальпии жидких нефтепродуктов пользуются
уравнением |
= 1 |
|
|
|
|
|
hж |
(0,0017T 2 |
+0,762T −334,25) , |
(3.1) |
|
|
0,t |
ρ15 |
|
|
|
|
|
|
|
|
|
|
|
15 |
|
|
|
где hж |
– энтальпия жидкости при температуре t, кДж/кг; |
|
|||
0,t |
|
|
|
|
|
ρ15 |
– относительная плотность; |
|
|
||
15 |
|
|
|
|
|
T – температура.
Стр. 90 |
ЭБ ПНИПУ (elib.pstu.ru) |
