
Количественный анализ. Метод кислотно-основного титрования
.pdfГосударственное образовательное учреждение высшего профессионального образования
«Тверской государственный университет» Кафедра неорганической и аналитической химии
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
МЕТОД КИСЛОТНО - ОСНОВНОГО ТИТРОВАНИЯ
Учебно-методические материалы по неорганической химии для студентов Ι курса специальностей:
специальность 020101 – Химия направление 020100 – Химия специальность 011600 – Биология специальность 012500 – География специальность 013600 – Геоэкология специальность 071900 – Информационные системы
специальность 351100 – Товароведение и экспертиза товаров
ТВЕРЬ 2011
1
Составители: канд. техн. наук, доцент Г. И. Андреева
канд. хим. наук, доцент Н. В. Баранова
канд. хим. наук, доцент С. С. Рясенский
канд. хим. наук, доцент М. А. Феофанова
Учебно–методические материалы предназначены для студентов химических, биологических и географических специальностей университетов для более глубокого самостоятельного изучения раздела общей и неорганической химии «Количественный анализ. Метод кислотно-основного титрования». Могут быть самостоятельно использованы при подготовке к лабораторным работам, семинарам, коллоквиумам, контрольным работам, зачетам и экзаменам.
Представлены теоретические аспекты раздела «Количественный анализ. Метод кислотно-основного титрования»– примеры решения задач, вопросы и задачи, ряд лабораторных работ по данной теме и список литературы.
Печатается по решению кафедры неорганической и аналитической химии
(протокол № 8 от 21.03. 2011 г.).
2
1. Задачи и методы количественного анализа
Аналитическая химия – наука, развивающая теоретические основы химического анализа веществ и материалов и разрабатывающая методы обнаружения, разделения, определения и идентификации химических элементов и их соединений.
Идентификация компонентов и определение качественного состава вещества или смеси веществ являются предметом качественного анализа. Качественный анализ обычно предшествует количественному. Цель последнего – найти количественные соотношения между компонентами исследуемого материала.
Задача количественного анализа – определение количественного содержания химических элементов (или их групп) в соединениях, количества вещества или его концентрации в растворе. Методы количественного анализа делятся на химические, физические и физико–химические. К химическим методам относятся гравиметрический (весовой), титриметрический (объёмный) и газовые анализы.
По способу измерения определяемого компонента методы количественного анализа можно классифицировать следующим образом:
1.Методы, основанные на измерении массы вещества, – гравиметрические методы.
2.Методы, основанные на измерении объёмов реагирующих веществ, – титриметрические (объёмные) методы.
3.Методы, основанные на измерении какого–либо физического параметра, связанного с концентрацией определяемого компонента,– физико–химические и химические методы.
2.Титриметрический (объёмный) анализ
2.1. Сущность и особенности титриметрического метода
Титриметрический анализ имеет ряд преимуществ перед гравиметрическим, а именно: скорость выполнения определений, относительная простота (несложность) операций, достаточная точность получаемых результатов. Указанные положения ставят титриметрические методы анализа на одно из первых мест в лабораторной практике химических, пищевых, металлургических и других производств.
Область вопросов, которые решаются методами титриметрического анализа, не так и обширна, но реакции, которые могут быть использованы для этой цели, достаточно многочисленны и разнообразны.
3
Их делят на четыре группы:
1.Методы кислотно–основного титрования (нейтрализации). В основе метода положена реакция Н3О+ + ОН- → 2Н2О.
2.Методы окисления–восстановления (редоксиметрия). Данная группа
методов |
основана на |
окислительно-восстановительных реакциях, |
которые |
протекают между рабочим раствором и определяемым |
|
веществом. |
|
|
3.Методы осаждения основаны на реакциях обмена, при которых определяемый элемент (ион) переходит в осадок.
4.Методы комплексообразования.
Втитриметрическом анализе количество химических веществ определяют путём точного измерения объёмов растворов двух веществ, вступающих между собой в определённую реакцию. Реагент берут в количестве, эквивалентном определяемому веществу.
Процесс, в котором количество нужного вещества определяют по количеству израсходованного стандартного реагента, называют титрованием. Стандартный, или титрованный, раствор – это раствор реагента с точно известной концентрацией. Титрующий раствор часто называют рабочим раствором, или титрантом. Например, если кислота титруется щелочью, то раствор щелочи называют титрантом. Различают приготовленные и установленные растворы титрантов. Приготовленные растворы точной концентрации получают растворением точной навески тщательно очищенного исходного вещества в определенном объеме воды. Так готовят, например, титрованный раствор NaCl.
Однако многие растворы, например титрованный раствор HСl, приготовить этим путем нельзя. В таких случаях готовят раствор титранта, концентрация которого известна лишь приблизительно, а затем его стандартизуют, т. е. устанавливают концентрацию точно. Эти растворы называются установленными. Для стандартизации растворов применяют специальные установочные вещества – первичные стандарты, которые должны иметь высокую степень чистоты, быть устойчивыми, не содержать гидратную воду, иметь достаточно высокую эквивалентную массу. Этим условиям отвечает ряд веществ: Na2CO3, КНСН4О4, Н2С2О4 · 2Н2О, Na2C2O4. Нередко для целей стандартизации используют вторичные стандартные растворы – титрованные растворы веществ, способных взаимодействовать с титрантом.
4
2.2. Основные приемы титрования
Различают прямое титрование, обратное титрование, титрование заместителя.
В методах прямого титрования определяемое вещество непосредственно реагирует с титрантом. Титрование щелочи кислотой является типичным примером прямого титрования:
NаOH + HCl = NаCl + H2O
Метод обратного титрования (титрования по остатку) применяют в том случае, если основная реакция протекает недостаточно быстро или невозможно подобрать подходящего индикатора для данной реакции. Например, для определения CaCO3 навеску вещества обрабатывают избытком титрованного раствора HCl:
СаСО3 + 2Н+ ↔ Са2+ + Н2О + СО2 ↑
Оставшуюся после реакции HCl титруют раствором щелочи и тем самым определяют ее количество, не вошедшее в реакцию с CaCO3, а затем рассчитывают содержание CaCO3 в пробе.
Метод титрования заместителя, или титрования по замещению (косвенное титрование), применяют в случае, если по тем или иным причинам трудно определить точку эквивалентности, например, при работе с неустойчивыми веществами и т. п. Так, при определении Cr2+, который легко окисляется кислородом воздуха, поступают следующим образом: к определенному объему соли хрома (II) прибавляют избыток титрованного раствора соли железа (III), происходит реакция
Cr2+ + Fe3+ ↔ Cr3+ + Fe2+
В результате реакции образуется эквивалентное содержанию Cr2+ количество Fe2+, титрование которого окислителями не вызывает затруднений.
3.Метод кислотно-основного титрования
3.1.Сущность метода кислотно-основного титрования
Метод кислотно-основного титрования основан на реакциях кислотно- основного взаимодействия, которое в общем виде можно представить как
НА + В ↔ НВ+ + А-
кислота основаниесопряженная сопряженное кислота основание
В результате взаимодействия растворов сильных кислот и оснований раствор становится нейтральным, поэтому метод кислотно-основного взаимодействия иногда называют методом нейтрализации.
5
3.1.1.Метод нейтрализации
Воснове метода нейтрализации лежат реакции нейтрализации.В зависимости от того, какой рабочий раствор применяется для титрования.
Вметоде кислотно-основного титрования различают алкалиметрию (титрант – стандартный раствор основания) и ацидиметрию (титрант – стандартный раствор кислоты). Различают следующие варианты титрования: а) титрование сильной кислоты сильным основанием; б) титрование сильного основания сильной кислотой; в) титрование слабой кислоты сильным основанием; г)титрование слабого основания сильной кислотой; д) титрование многоосновных кислот или многоосновных оснований; е) титрование смесей кислот или смесей оснований разной силы.
Все эти методы отличаются друг от друга природой использованных равновесий, индикаторами, реагентами, а также способами определения мольной массы эквивалента.
При ацидиметрии (от acidum – кислота) в качестве рабочих растворов применяют 0,1 н. и 0,01 н. стандартные растворы НСl и H2SO4, при алкалиметрии (от alkalis – щелочь) – 0,1 н. и 0,01 н. стандартные растворы NaOH, Ba(OH)2.
Ацидиметрию применяют для определения сильных и слабых оснований, основных солей, солей сильных оснований и слабых кислот, органических соединений. При титровании сильных оснований, например NaOH, проходит реакция нейтрализации сильного основания сильной кислотой:
NaOH + HCl = NaCl + H2O
OH- + H+ = H2O
При этом получается соль сильной кислоты и сильного основания и вода. Раствор имеет нейтральную реакцию. Если титруется слабое основание, проходит реакция нейтрализации слабого основания сильной кислотой:
NH4OH + HCl = NH4Cl + H2O
NH4Cl + H2O = NH4OH + HCl
При этом образуется соль слабого основания и сильной кислоты, которая при взаимодействии с молекулами воды вступает в реакцию гидролиза, образуя малодиссоциированное слабое основание и сильную кислоту. Таким образом, в точке эквивалентности полученный раствор будет иметь кислую реакцию.
При титровании солей сильных оснований и слабых кислот образуются слабая малодиссоциированная кислота и соль сильного основания и сильной кислоты:
6
Na2CO3 + HCl = 2 NaCl + H2CO3
CO32- + 2H+ = H2CO3
В точке эквивалентности реакция среды вследствие присутствия в растворе слабой кислоты будет слабокислой. Если соль сильного основания и слабой кислоты образована многовалентным ионом, то при титровании будет наступать несколько точек эквивалентности:
Na2CO3 + HCl = NaHCO3 + NaCl
NaHCO3 + HCl = NaCl + H2CO3
В первой точке эквивалентности в данном случае образуется кислая соль, во второй – средняя соль. При титровании основных солей образуются средние соли:
Bi(OH)2Cl + 2 HCl = BiCl3 + 2 H2O
В зависимости от силы основания металла средние соли могут подвергаться гидролизу:
BiCl3 + 2 H2O = Bi(OH)2Cl + 2 HCl
В итоге реакция среды в точке эквивалентности может быть кислой. Таким образом, при ацидиметрии в зависимости от титруемого вещества точка эквивалентности наступает в нейтральной, слабощелочной или слабокислой среде.
Аналогичные явления происходят и при титровании по методу алкалиметрии. Метод этот применяют для титрования сильных и слабых кислот, кислых солей, солей сильных кислот и слабых оснований. Определение точки эквивалентности в методе нейтрализации проводят разными способами: с помощью индикаторов и физико-химическими методами по изменению рН среды (потенциометрически) и электропроводности раствора (кондуктометрически).
3.2. Кривые титрования
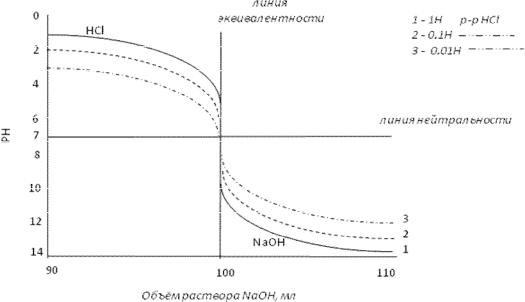
Ход процесса титрования выражают с помощью кривых титрования, представляющих собой зависимость изменения рН среды от количества добавленного рабочего раствора. Для получения кривой титрования строят график в прямолинейных осях координат. На оси абсцисс откладывают количество миллилитров прибавленного раствора титранта, на оси ординат – значение рН среды.
Рассмотрим случай ацидиметрического титрования 100 мл 0,1 н. раствора NаOH рабочим раствором HCl. Полученные данные занесем в таблицу:
7
Количество |
0 |
90,0 |
99,0 |
99,9 |
100,0 |
100,1 |
101,0 |
110,0 |
титранта, мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рН раствора |
13 |
12 |
11 |
10 |
7 |
4 |
3 |
2 |
|
|
|
|
|
|
|
|
|
рОН раствора |
1 |
2 |
3 |
4 |
7 |
10 |
11 |
12 |
|
|
|
|
|
|
|
|
|
Если к 100 мл 0,1н. раствора NaОН не добавлен раствор титранта, то рН этого раствора – 13, рОН = 1. При добавлении 90,0 мл 0,1н. HCl концентрация NaOH уменьшается в 10 раз и рН = 12, рОН = 2 (без учета разбавления). При добавлении еще 9 мл (всего 99,0 мл) 0,1н. HCl концентрация NаОН уменьшится еще в 10 раз и рН = 11, рОН = 3. При дальнейшем добавлении 0,1н. раствора получаем цифры, которые заносим в таблицу. Отложив полученные значения рН и число миллиметров титранта на графике, получим кривую титрования
(рис.1).
Рис.1. Влияние концентрации растворов кислот и оснований на характер кривой титрования
Анализ кривой титрования сильного основания сильной кислотой показывает, что изменение рН среды сначала происходит плавно, среда остается щелочной, затем наступает резкое изменение величины рН и среда из щелочной становится кислой, дальнейшее изменение рН происходит плавно в кислой среде. Зона резкого изменения величины рН называется скачком титрования. На кривой титрования скачок титрования наблюдается от 99,1 мл добавленной
0,1н. HCl до 100,1 мл.
В этом интервале происходит изменение рН среды от 10 до 4. Точка эквивалентности находится посредине скачка титрования при рН = 7. Кривая титрования сильной кислоты сильным основанием (рис.1) имеет обратный вид. Она начинается в кислой среде (титруется кислота). Скачок титрования находится в интервале от рН = 4 до рН = 10. Точка эквивалентности также
8
находится посредине скачка титрования при рН = 7.
При титровании многоосновных кислот и солей многоосновных слабых кислот и сильных оснований число скачков титрования соответствует основности кислоты (рис.1). При титровании многокислотных оснований и солей многокислотных слабых оснований и сильных кислот число скачков титрования соответствует кислотности основания. Таким образом, кривые титрования позволяют проанализировать процесс титрования, установить скачок титрования, точку эквивалентности процесса титрования и подобрать необходимый индикатор.
3.3. Индикаторы метода кислотно-основного титрования
Цель любого титрования – добавление стандартного раствора в количестве, химически эквивалентном количеству реагирующего вещества. Это условие достигается в точке эквивалентности.
Для определения точки эквивалентности при титровании применяют специальные вещества – индикаторы ( от латинского indicare – показывать, обнаруживать), которые меняют свой цвет при изменении рН среды вследствие изменения концентрации ионов водорода Н+. В растворе между диссоциированной и недиссоциированной формой индикатора возникает равновесие:
HInd ↔ H+ + Ind- |
IndOH ↔ Ind+ + OH- |
Диссоциированная и недиссоциированная формы индикатора имеют различную окраску. При изменении концентрация ионов водорода в растворе происходит сдвиг равновесия и наблюдается изменение окраски раствора. Изменение окраски индикатора происходит не скачком, а в некотором интервале изменений рН среды, который называют интервалом перехода индикатора из одной формы в другую. Каждый индикатор имеет свой интервал перехода, который зависит от особенностей структуры индикатора. Величину рН, до которой титруют раствор с данным индикатором, называют показателем титрования рТ.
При методе нейтрализации применяют следующие индикаторы:
Метиловый оранжевый. В кислой среде индикатор изменяет окраску до красной. Интервал перехода окраски от красной до желтой находится в пределах изменений рН среды от 3,1 до 4,4; рТ=4,0. Применяют в виде 0,1% водного раствора.
Метиловый красный. В щелочной среде имеет желтую окраску, в кислой переходит в форму с красной окраской. Интервал перехода от красной окраски к желтой находится в пределах изменений рН среды от 4,2 до 6,2; рТ=5,5. Применяют 0,2% раствор в 60% растворе этанола.
9
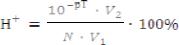
Фенолфталеин. Водные растворы в кислой среде бесцветны, в щелочной – приобретают малиново-красный цвет. Переход окраски происходит в интервале рН 8,0-10,0; рТ= 9,0. Применяют в виде 0,1% раствора в 50% этаноле.
Тимолфталеин. В кислой среде бесцветен, в щелочной – приобретает синюю окраску. Интервал перехода от бесцветной окраски к синей находится при рН от 9,0 до 10,5; рТ= 9,5. Применяют 0,1% раствор в 90% этаноле.
Лакмус. В щелочной среде синий, в кислой – приобретает красную окраску. Интервал перехода от синей окраски к красной находится при рН от 5,0 до 8,0; рТ= 7,0. Применяют в виде индикаторных бумажных полосок.
Для правильного применения индикатора необходимо, чтобы интервал перехода окраски индикатора находился в пределах скачка титрования на кривой титрования.
3.4. Индикаторы погрешности
Причиной возникновения индикаторных погрешностей в кислотно- основном титровании является несовпадение показателя титрования (pТ) индикатора с рН точки эквивалентности.
Типы индикаторных погрешностей:
1)водородная (Н+–погрешность),
2)гидроксильная (ОН- –погрешность),
3)кислотная (НАn –погрешность),
4)основная (МеОH–погрешность).
Погрешности типа 1 и 2 возникают, когда индикатор изменяет свою окраску при избытке в растворе сильной кислоты (1) или щелочи (2). Кислотная и основная погрешности связаны с оставшейся в растворе неоттитрованной слабой кислотой (слабым основанием) в момент изменения окраски индикатора. Важен знак погрешности. Если титруют кислоту и получают Н+–погрешность (НАn–погрешность), то какая-то часть кислоты остается неоттитрованной и погрешность получается со знаком минус (–). Наоборот, если при титровании кислоты получают ОН-–погрешность (МеОН–погрешность), то эта погрешность имеет знак плюс (+), так как вызвана избытком ОН- –ионов. При титровании щелочей или слабых оснований знаки у Н+–погрешности (НАn– погрешности) и ОН-–погрешности (МеОН–погрешности), естественно, меняются на обратный.
Ниже представлены расчетные формулы для каждого вида погрешностей:
,
10
