
Классические методы химического анализа (110
..pdf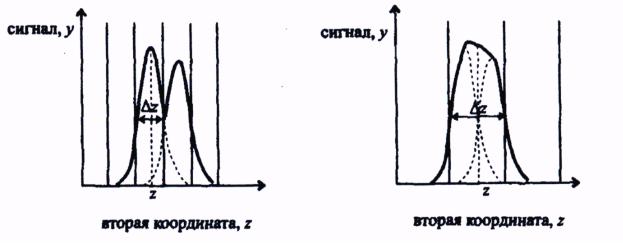
х |
= |
ymin −bo |
. |
(13) |
|
||||
min |
b1 |
|
||
|
|
|
||
Таким образом, предел обнаружения тем ниже, чем выше коэффициент чувствительности b1 и чем меньше случайная погрешность методики.
Селективность: насколько хорошо методика может различать отдельные компоненты
Понятие селективность характеризует, насколько посторонние компоненты пробы мешают определению данного компонента. При помощи полностью селективной методики компонент можно определить в пробе любого состава. Подобные методики называют специфичными по отношению к данному компоненту.
Вслучае не полностью селективных методик имеет место наложение аналитических сигналов отдельных компонентов. Для получения правильных результатов требуется отделять мешающие компоненты или вводить необходимые поправки расчетным путем. Полностью селективные (специфичные по отношению к определенному компоненту) методики встречаются крайне редко. На практике оказывается достаточным, чтобы концентрация мешающего компонента была достаточно мала и не вызывала (в пределах погрешности измерений) искажений аналитического сигнала.
Вкачественной количественной характеристике селективности в разных методах применяют разные величины. К ним относятся коэффициент селективности в потенциометрии или разрешение в хроматографии. Для наиболее общего описания степени разрешения двух аналитических сигналов используют величину, называемую разрешающей способностью. Два пика считаются различимыми, если они отстоят друг от друга на величину,
равную их полуширине (т.е. ширине на половине высоты) ∆z (рис. 3).
Рис. 3. Двумерные методы анализа с различными значениями разрешающей способности N
11
Разрешаюшая способность определяется как отношение положения пика z к его полуширине ∆z:
N = |
z |
. |
(14) |
|
|||
|
z |
|
|
Эта величина может изменяться в зависимости от положения пика z.
Экономические характеристики: затраты, время, стоимость
Процесс анализа необходимо оценивать и с экономической точки зрения. Всемерное сокращение затрат и времени анализа является непременной задачей при разработке методик. Стоимость анализа включает в себя, например, производственные расходы по приобретению, установке и эксплуатации оборудования на покупку стандартных образцов и специальной литературы, оплату труда сотрудников соответствующей квалификации.
СТЕХИОМЕТРИЧЕСКИЕ РАСЧЕТЫ
Моль: основная единица измерения при работе
схимическими уравнениями
Вхимическом анализе приходится иметь дело с измерениями количеств твердых веществ и концентраций растворов. Из этих данных рассчитывают массы веществ. Для градуировки измерительных приборов или для титрования необходимо готовить растворы известной концентрации. Для выполнения всех подобных вычислений необходимо знание стехиометрии, т.е. количественных соотношений, в которых взаимодействуют химические вещества. Из стехиометрических соотношений вычисляют и коэффициенты пересчета, позволяющие выражать результаты анализа в тех или иных величинах.
Для упрощения расчетов в химии было введено понятие моль. Один
моль атомов, молекул, ионов или других частиц содержит количество частиц, равное числу Авогадро (6,022 · 1023). Масса одного моля частиц численно равна их атомной, молекулярной либо формульной массе, выраженной в граммах. Поскольку моль любого вещества содержит столько же атомов или молекул, сколько моль любого другого вещества, то атомы реагируют в таких же мольных соотношениях, каковы их атомные соотношения в соответствии с уравнением реакции.
Пример 1.
Рассчитайте массу (в граммах) одного моля CaSO4 · 7H2O.
Рассчитаем молярную массу вещества. Это и будет масса одного моля
(в г).
12

Сa |
40,08 |
S |
32,06 |
11O |
176,00 |
14H |
14,11 |
262,25 г / моль
Число молей вещества рассчитывают как
Число молей = Масса (г) / Молярная масса (г/моль). |
(15) |
Под молярной массой следует понимать атомную или молекулярную массу вещества. Так,
число молей Na2SO4 = Масса (г) / 124,04 (г /моль), число молей Ag+ = Масса (г) / 107, 870 (г/моль).
В экспериментах часто имеют дело с достаточно малыми количествами вещества, для которых удобнее использовать единицу измерения миллимоль. Для расчета числа миллимолей используют формулу
Число миллимолей = Масса (мг) / Молярная масса (мг/ммоль) |
(16) |
Подобно тому, как число молей вещества рассчитывают из его массы, можно рассчитать массу вещества (в г) из числа его молей:
масса Na2SO4 (г) = Число молей · Молярная масса = Число молей · 142,04 г /моль, масса Ag (г) = Число молей · Молярная масса = Число молей · 107,870 г /моль.
Химики часто имеют дело с количеством вещества, выраженным в миллимолях. В этом случае
Масса (мг) = Число миллимолей · Молярная масса (мг/ммоль). |
(17) |
Т.е., число г/моль = числу мг/ммоль = молярной массе; число г/л = числу мг/мл; число моль/л = числу ммоль/мл = молярности.
Пример 2.
Рассчитайте число молей Na2WO4 (вольфрамат натрия), содержащееся в 500 мг этого вещества.
500 мг / 293,8 мг/ ммоль · 0,001 моль/ ммоль = 0,00170 моль.
Пример 3.
Чему равна масса (мг) 0,250 ммоль Fe2O3 (оксид железа)? 0,250 ммоль · 159,7 мг/моль = 39,9 мг.
13
Молярность – самая распространенная единица измерения концентрации
Понятие моля используют для выражения концентрации растворов, особенно в аналитической химии, где требуется знание соотношений объемов растворов реагирующих веществ. По определению одномолярным раствором называется такой раствор, в одном литре которого содержится один моль вещества. Его можно приготовить, растворив один моль вещества в некотором объеме растворителя и разбавив в мерной колбе до конечного объема, равного одному литру. Можно также растворить меньшее или большее количество вещества, разбавив до соответствующего значения объема – например, 0,01 моль в 10 мл. В более общем случае молярностью раствора называется его концентрация, выраженная в виде количества молей в литре или миллимолей в миллилитре. Молярность сокращенно обозначается М; как правило, в аналитической химии под словом «концентрация» понимается именно молярность. Одномолярный раствор нитрата серебра и одномолярный раствор хлорида натрия взаимодействуют в равных объемах в соотношении (1 : 1) в соответствии с уравнением реакции:
Ag+ + Cl- → AgCl.
В общем случае число молей вещества, содержащееся в произвольном объеме его раствора, рассчитывают как
Число молей = Молярность (моль/ л) · Объем (л). |
(18) |
Применительно к небольшим объемам, используемым в титриметрии, литр – неудобная единица измерения. Удобнее работать с миллилитрами – единицами, в которых отградуирована бюретка. В этом случае
Число миллимолей = Молярность (ммоль / мл) · Объем (мл). |
(19) |
Пример 4.
Раствор приготовлен растворением 1,26 г AgNO3 в мерной колбе объемом 250 мл с последующим разбавлением до метки. Рассчитайте молярность полученного раствора нитрата серебра. Сколько миллимолей AgNO3 содержится в растворе?
Решение
М = |
1,26 г /169 ,9г / моль |
= 0,0297 моль / л(или0,0297 ммоль / мл) . |
|
1,250 л |
|||
|
|
Отсюда Число миллимолей = 0,0297 ммоль/мл · 250 мл = 7,42 ммоль.
В числовых выражениях единицы измерения сокращаются, образуя соответствующую единицу измерения конечного результата. Так, в приведен-
14
ном выше примере граммы сокращаются, остается моль/л (молярность). Выполнение вычислений вместе с единицами измерений с целью проверки правильности единиц измерения результата называется анализом размерностей. Тщательное проведение анализа размерностей важно для правильного проведения вычислительного процесса.
Пример 5.
Сколько граммов NaCl cодержится в 1 мл 0,250 М раствора?
Решение
0,250 моль/л = 0,250 ммоль/мл 0,250 ммоль/мл · 58,4 мг/моль · 0,001 г/мг = 0,0146 г/мл.
Пример 6.
Какую навеску Na2SO4 следует взять для приготовления 500 мл 0,100 М раствора?
Решение
500 мл · 0,100 ммоль/мл = 50,0 ммоль 50,0 ммоль · 142 мг/ ммоль · 0,001 г/мг = 7,10 г.
Пример 7.
Рассчитайте концентрацию ионов калия (г/л) в растворе, полученном смешением 100 мл 0,250 М КСl и 200 мл 0,100 М К2SO4.
Решение
ммоль К+ = ммоль KCl + 2 · ммоль К2SO4 = 100 мл · 0,250 ммоль/мл + 2 × × 200 мл · 0,100 ммоль/мл = 65,0 ммоль в 300 мл
65,0 ммоль 39,1 мг / ммоль 0,001 г / мг 1000 мл/ л = 8,47 г / л. 300 мл
Нормальность
Выражение концентрации в виде молярности широко используется в химии. Тем не менее ряд химиков использует в количественном анализе выражение концентрации посредством нормальности (N). Однонормальным называется раствор, содержащий 1 моль эквивалентов вещества в литре. Эквивалентом называется реальная или воображаемая частица, взаимодействующая с одной «реагирующей единицей» – одним протоном (в ки- слотно-основных реакциях) или электроном (в окислительновосстановительных). Таким образом, моль эквивалентов – это количество вещества, содержащее число «реагирующих единиц», равное числу Авогадро. Число молей эквивалентов равно числу молей вещества, умноженному на число «реагирующих единиц», приходящихся на одну молекулу или атом, а эквивалентная масса – это молярная масса, деленная на число «реагирующих единиц». В табл. 1 приведены «реагирующие единицы» для различных типов реакций. Для кислот и оснований число «реагирующих единиц» равно числу протонов (ионов водорода), которое молекула кислоты
15

отщепляет либо молекула основания присоединяет. Для окислительновосстановительных реакций оно равно числу электронов, которое принимает окислитель либо отдает восстановитель.
|
Таблица 1 |
«Реагирующие единицы» для различных типов реакций |
|
Тип реакции |
«Реагирующие единицы» |
|
|
Кислотно-основные |
Н+ |
Окислительно-восстановительные |
Электрон |
|
|
Например, серная кислота Н2SO4 содержит две «реагирующие единицы» – два протона. Поэтому один моль серной кислоты содержит два моля эквивалентов. Отсюда ее эквивалентная масса равна
Эквивалентная масса = 98,08 г / моль = 49,04 г / моль экв. 2 моль экв / моль
Эквивалентная масса (как и число «реагирующих единиц») зависит от химической реакции. Она может принимать разные значения – чаще всего в окислительно-восстановительных реакциях, для которых возможны разные продукты.
Таким образом, нормальность раствора серной кислоты вдвое выше, чем его молярность. Число молей эквивалентов рассчитывают как
Масса (г)
= Эквивалент. масса (г / моль экв.) ,
число молей эквивалентов = Нормальность (моль экв./ л) · Объем (л), число г/моль экв. = Число мг/ммоль экв. = Эквивалентная масса, (20) число моль экв./ л = Число ммоль экв./мл = Нормальность.
Если использовать количества вещества, выраженные в миллимолях, то, как и для молярности,
число миллимолей эквивалентов = |
Масса (мг) |
|
|
Эквивалент. масса (мг / ммоль экв.) |
|
|
|
число миллимолей эквивалентов = Нормальность (ммоль экв./мл) · объем (мл) |
(21) |
||
Как пересчитать плотность раствора в молярность?
Для многих достаточно концентрированных растворов кислот и щелочей в качестве концентрации указывается массовая доля растворенного вещества (в процентах). Часто возникает необходимость приготовить из таких препаратов растворы заданной приблизительной молярности. Чтобы выполнить соответствующие расчеты, необходимо знать плотность исходного
16

раствора. Плотностью называется масса единицы объема вещества при за-
данной температуре (обычно 20 °С), выражаемая, как правило, в г/мл
(г/cм3).
Иногда для вещества указывают не плотность, а удельный вес. Удельный вес – это отношение массы физического тела (например, раствора), находящегося при 20 °С, к массе равного объема воды, находящегося при 4 °С (иногда 20 °С). Таким образом, удельный вес – это отношение плотностей двух веществ, т. е. величина безразмерная. Поскольку плотность воды при 4 °С составляет 1,00000 г/мл, то плотность вещества равна его удельному весу, отнесенному к воде при 4 °С. Если удельный вес относят к воде при 20 °С, то плотность равна удельному весу, умноженному на 0,99821 (плотность воды при 20 °С равна 0,99821 г/мл).
При 4 °С:
Удельный вес = |
Плотность раствора, г / мл (t °С) = 1,0000 при t = 4 °С (плот- |
|
Плотность Н2О (4 °С) |
ность разбавленных растворов близка к плотности воды, т. е. DH2O = 1,0000 г/мл). |
|
Удельный вес = 0,99820 при t = 20 °С (DH2O = 0,99820 г/мл). |
|
При 20 °С: |
Плотность раствора,г / мл (t оС) = 1,0000 при t = 20 °С (для разбав- |
Удельный вес = |
|
|
Плотность Н2О (20 оС) |
ленных растворов DH2O = 0,99820 г/мл) =1,0018 при t = 4 °С (DH2O = 1,0000 г/мл).
Пример 8.
Сколько миллилитров концентрированной 94 % (г/100 г раствора) серной кислоты с плотностью 1,831 г/cм3 необходимо взять для приготовления 1л 0,100 М раствора?
Решение
Концентрированная кислота содержит 0,940 г Н2SO4 в одном грамме раствора, а один миллилитр раствора весит 1,831 г. Произведение этих двух чисел равно массе Н2SO4 (г) в одном миллилитре раствора. Из этой величины можно рассчитать молярность исходного раствора:
М = (0,940 г H2SO4 / г раствора)(1,831г/ мл)1000 мл/ л=17,5 мольН2SO4 / л раствора
9,81г/ моль
Этот раствор необходимо разбавить так, чтобы получить 1 литр 0,100 М раствора. Следовательно, необходимо взять столько миллимолей Н2SO4, сколько их содержится во всем объеме конечного раствора. Рассчитаем требуемый для этого объем исходного раствора (х):
0,1000 М · 1000 мл = 17,5 М · х мл.
Отсюда х = 5,71 мл. Такой объем концентрированной серной кислоты следует разбавить до 1000 мл.
17
Аналитические и равновесные концентрации
Аналитическая концентрация – это общая концентрация растворенного вещества, т.е. сумма концентраций всех его химических форм, присутствующих в растворе. В растворе с известной аналитической концентрацией вещество может полностью или частично диссоциировать, переходя в различные химические формы. Концентрация каждой такой формы называется равновесной. Например, слабая уксусная кислота в растворе диссоциирует на несколько процентов (степень диссоциации зависит от концентрации и
увеличивается с разбавлением раствора): НОАс = Н+ + ОАс–.
В результате образуется равновесная смесь, содержащая протоны и аце- тат-ионы в определенной концентрации. Равновесные концентрации (обычно также выражаемые в виде молярности) часто бывают необходимы для расчетов с использованием констант равновесий. Аналитическая концентрация вещества Х обозначается с, а равновесная концентрация частицы – [с]. Для раствора хлорида кальция с аналитической концентрацией 1 М равновесные концентрации составляют: для СaCl2 – 0 M, для Ca2+ – 1 M и для Сl– – 2 M. Говорят, что концентрация такого раствора составляет 1 М по Са2+.
Расчет разбавления для приготовлений раствора нужной концентрации
Часто возникает необходимость приготовить разбавленный раствор из более концентрированного исходного раствора. Например, может потребоваться приготовить из концентрированной HCl разбавленный раствор (и затем стандартизировать его) для использования в титровании. Или из одного исходного стандартного раствора может требоваться приготовить серию более разбавленных стандартных растворов. Во всех подобных случаях количество вещества (ммоль) в порции исходного раствора, взятой для разбавления, должно быть равно общему количеству вещества во всем объеме разбавленного раствора, т.е. Сисх · Vисх = Сразб · Vразб.
Пример 9.
Необходимо построить градуировочный график для спектрофотометрического определения перманганат-ионов. Имеется исходный 0,100 М раствор KMnO4 и несколько мерных колб объемом 100 мл. Какие объемы исходного раствора необходимо точно отмерить и перенести в колбы, чтобы
приготовить стандартные растворы KMnO4 c концентрациями 1,00 · 10–3; 2,00 · 10–3; 5,00 · 10–3 и 10,00 · 10–3 М?
Решение
100 мл · 1,00 · 10–3 ммоль/мл = 0,100 ммоль KMnO4
18
Объем х исходного раствора, содержащий такое количество KMnO4, найдем из следующего соотношения:
0,100 ммоль/мл · х мл = 0,100 ммоль
х = 1,00 мл Аналогично, для приготовления остальных растворов потребуется
взять 2,00; 5,00 и 10,00 мл исходного раствора и разбавить до 100 мл.
Количество вещества (ммоль) до и после разбавления должно быть одинаковым! Соотношение концентрация (М) · объем (мл) = количество вещества (ммоль) можно использовать для расчета разбавления, требуемого для приготовления раствора известной концентрации из более концентрированного. Например, если мы хотим приготовить 500 мл 0,100 М раствора путем разбавления более концентрированного, то мы можем рассчитать количество миллимолей вещества, необходимое для этого. Из полученного значения найдем объем концентрированного раствора, который следует разбавить до 500 мл.
Пример 10.
Требуется приготовить 500 мл 0,100 М раствора К2Сr2O7 из 0,250 М раствора. Какой объем этого раствора необходимо разбавить до 500 мл?
Решение
Мразб · Vразб = Mисх · Vисх
0,100 ммоль/мл · 500 мл = 0,250 ммоль/мл · Vисх Vисх = 200 мл
Пример 11.
Какой объем 0,40 М раствора Ba(OH)2 следует добавить к 50 мл 0,30 М NaOH, чтобы получить раствор с концентрацией 0,50 М по ОН-?
Решение
Пусть х – объем раствора Ba(OH)2 (мл). Конечный объем раствора составит (50 + х) мл. Количество миллимолей ОН– (n) составит
n (ОН–) = n (NaOH) + 2n (Ba(OH)2)
Отсюда
0,50 М · (50 + х) (мл) = 0,30 М (NaOH) · 50 (мл) + 2 · 0,40 М (Ba(OH)2) · х (мл) х = 33 мл (Ba(OH)2)
Пример 12.
Определите железо спектрофотометрическим методом по реакции образования оранжевого продукта реакции Fe2+ c 1,10-фенантролином. Необходимо построить градуировочный график, а для этого – приготовить серию стандартных растворов для сравнения интенсивности окраски. Из сульфата железа (II) – аммония приготовлен исходный стандартный раствор с концентрацией железа 1,000 · 10–3 М. Рабочие стандартные растворы А и В приготовлены разбавлением, соответственно, 2,000 и 1,000 мл исходного раствора в мерных колбах объемом 100 мл. Рабочие стандартные растворы
19
С, D и Е приготовлены разбавлением, соответственно, 20,00, 10,00 и 5,000 мл рабочего раствора А в мерных колбах объемом 100 мл. Каковы концентрации приготовленных рабочих растворов?
Решение
Раствор А:
Мисх ·Vисх = MА ·VА
(1,000 · 10–3 М) · (2,000 мл) = MА · 100,0 мл МА = 2,000 · 10–5 М
Раствор В: (1,000 · 10–3 М) · (1,000 мл) = MВ · 100,0 мл МВ = 1,000 · 10–5 М
Раствор С: МА ·VА = MС ·VС
(2,000 · 10–5 М) · (20,00 мл) = MС · 100,0 мл МС = 4,000 · 10–6 М
Раствор D: (2,000 · 10–5 М) · (10,00 мл) = MD· 100,0 мл МD = 2,000 · 10–6 М
Раствор Е: (2,000 · 10–5 М) · (5,000 мл) = MЕ · 100,0 мл МЕ = 1,000 · 10–6 М
Выражение результатов анализа
Результаты анализа можно представить множеством способов. Почти всегда результаты представляют в виде концентрации или других относительных величин на основе массы или объема – например, отношения количества аналита к массе или объему пробы. При этом единицы измерения количества аналита могут быть разными.
Основной единицей массы является грамм (г); она чаще всего используется в макроанализе. Для проб малого размера, а также для малых содержаний аналита используют меньшие единицы – миллиграмм (мг, 10–3 г), микрограмм (мкг, 10–6 г), нанограмм (нг, 10–9 г).
Основной единицей объема является литр (л). Миллилитр (мл, 10–3 л) чаще всего используют в титриметрии. Применяют также еще меньшие единицы – микролитр (мкл, 10–6 л) и нанолитр (нл, 10–9 л).
Y = иотта = 1024 |
М = мега = 106 |
н = нано = 10–9 |
Z = зетта = 1021 |
к = кило = 103 |
п = пико = 10–12 |
Е = экса = 1018 |
д = деци = 10–1 |
ф = фемто = 10–15 |
Р = пета = 1015 |
с = санти = 10–2 |
а = атто = 10–18 |
Т = тера = 1012 |
м = милли = 10–3 |
z = зепто = 10–21 |
Г = гига = 109 |
мк = микро = 10–6 |
y = иотто = 10–24 |
20
