
Мономеры промышленного производства каучуков. Ч. 2 (110
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Г. В. Шаталов, А. С. Шестаков
МОНОМЕРЫ ПРОМЫШЛЕННОГО ПРОИЗВОДСТВА КАУЧУКОВ
Часть 2
Учебно-методическое пособие для вузов
Воронеж Издательский дом ВГУ
2016
Утверждено научно-методическим советом химического факультета 23 июня 2016 г., протокол № 5
Рецензент – д-р хим. наук, проф. М. Ю. Крысин
Подготовлено на кафедре высокомолекулярных соединений и коллоидов химического факультета Воронежского государственного университета.
Рекомендуется для студентов 4-го курса очного отделения и 5-го курса очно-заочного отделения химического факультета.
Для направления 04.03.01 – Химия
2
Содержание
Введение…………………………………………………………………. 5
1.Фторсодержащие мономеры……………………………………............ 6
1.1.Винилиденфторид…………………………………………………… 6
1.2.Трифторхлорэтилен…………………………………………………. 6
1.3.Перфторпропилен…………………………………………………… 7
2.Акриловые мономеры…………………………………………………... 7
2.1.Акрилонитрил……………………………………………………….. 7
2.1.1.Получение из этилена через этиленоксид
и этиленциангидрин…………………………………………… |
7 |
2.1.2. Окислительный аммонолиз пропилена……………………… |
8 |
2.1.3.Получение из ацетилена и синильной кислоты……………... 9
2.1.4.Синтез через ацетальдегид и гидроксинитрил………………. 10
2.1.5.Получение из пропилена и оксида азота…………………….. 10
2.1.6.Синтез прямым взаимодействием этилена,
синильной кислоты и кислорода…………………………….. |
10 |
2.1.7. Получение окислительным аммонолизом пропана………… |
11 |
2.2. Акриловая кислота…………………………………………………. |
11 |
2.2.1. Получение гидролизом акрилонитрила……………………… |
11 |
2.2.2. Получение гидрокарбоксилированием ацетилена …………. |
12 |
2.2.3. Синтез парофазным окислением пропилена………………… |
13 |
2.2.4. Получение гидролизом β-пропиолактона…………………… |
13 |
2.2.5.Синтез окислительным карбонилированием этилена……... 14
2.3.Эфиры акриловой кислоты………………………………………... 14
2.3.1.Получение этерификацией акриловой и метакриловой кислот…………………………………………………………... 15
2.3.2.Получение переэтерификацией акриловой и метакриловой кислот…………………………………………………………... 16
2.3.3.Синтез из этиленциангидрина………………..………………. 17
2.3.4. Получение из ацетилена по Реппе……………….…………… 18
2.3.5.Получение из акрилонитрила……………….………………... 18
2.4.Акриламид………………………………………………………….. 19
3.Мономеры для полиуретанов………………………………………….. 20
4.Мономеры для силоксановых каучуков………………………………. 23
4.1.Промышленные методы гидролиза диорганодихлорсиланов….. 25
4.1.1.Получение мономеров термической перегруппировкой линейных полисилоксанов…………………………………… 26
4.1.2.Каталитическая перегруппировка линейных полисилоксанов……………………………………………….. 26
3
5.Мономеры для модифицированных силоксановых каучуков……….. 28 5.1. Получение гексаорганоциклотрисилоксанов…………………….. 28
6. Мономеры для серосодержащих эластомеров………………………… 29
7.Мономеры для полиорганофосфазенов………………………………... 30
Литература……………………………………………………………….. 31
4
ВВЕДЕНИЕ
К мономерам относят низкомолекулярные соединения, молекулы которых реагируют между собой или же с молекулами других веществ с образованием макромолекул. Комиссией по номенклатуре полимеров Международного союза теоретической и прикладной химии (ИЮПАК) дано следующее определение: мономер – это вещество, состоящее из молекул, каждая из которых может образовывать одно или несколько составных звеньев; составное звено представляет собой атом или группу атомов, входящих в состав цепи молекул полимера или олигомера.
Как известно, синтез полимеров осуществляют путем цепной или ступенчатой полимеризации мономеров. Ступенчатую полимеризацию, сопровождаемую образованием низкомолекулярных соединений, чаще называют поликонденсацией. С учетом классификации полимеров по способу их синтеза мономеры делят на два больших класса: мономеры, получаемые для синтеза полимеров полимеризацией, и мономеры, синтезируемые поликонденсацией.
Возросшая в начале ХХ века потребность в синтетическом каучуке стимулировала исследования, направленные на разработку способов получения многочисленных мономеров. В течение нескольких десятилетий возникла одна из крупнейших отраслей химической промышленности – промышленность синтетических каучуков и связанное с этим производство мономеров. Источником для получения сырья стали продукты переработки нефти, природного и попутного газа, угля и других веществ. Производство мономеров связано с такими химическими процессами переработки, как гидрирование, дегидрирование, окисление, галогенирование и многие другие. Это создает большие возможности для роста промышленного производства многочисленных мономеров, относящихся к разным классам химических соединений.
5

1. ФТОРСОДЕРЖАЩИЕ МОНОМЕРЫ
Мономеры, содержащие атомы фтора, применяют в синтезе каучуков специального назначения. Такие каучуки используют в производстве материалов и изделий, в которых сочетается высокая теплостойкость со стойкостью к действию агрессивных сред, масел, а также микроорганизмов.
1.1. Винилиденфторид
Винилиденфторид (1,1-дифторэтилен) – бесцветный газ без запаха с Ткип = 189 К и Тпл = 129 К, d420 = 0,580 г/см3 при 298 К.
В промышленности этот мономер синтезируют дегидрохлорированием 1,1-дифто-1-хлорэтана при 873–973 К. Последний образуется в процессе фотохимического хлорирования 1,1-дифторэтана при 293–343 К в течение 20–90 секунд. Процесс проводят в присутствии теплопроводящего материала (например, опилокникеля) поддавлением. Получениепротекает посхеме
CHF CH |
+ Cl |
|
hv |
CClF2CH3 + Cl2 |
|
CF2=CH2 |
2 -HCl |
|
|||||
2 3 |
|
|
-HCl |
|||
Выход винилиденфторида на прореагировавший исходный продукт составляет более 98 %.
Используемый в синтезе 1,1-дифторэтан может быть получен гидрофторированием ацетилена без выделения в чистом виде согласно схеме
CH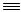 CH + 2HF
CH + 2HF  CHF2CH3
CHF2CH3
В этом случае применяют катализатор, который получают пропиткой γ-Al2O3 раствором соли висмута с добавкой марганца.
1.2. Трифторхлорэтилен
Трифторхлорэтилен (перфторвинилхлорид) CClF=CF2 представляет газ с Ткип = 246,2 К, Тпл = 115,8 К, nD20 = 1,3960, d420 = 0,934 г/см3. Синтез осуществляют жидкофазным дехлорированием в среде метанола при 323–
423 К, 2 МПа в присутствии цинка в качестве катализатора по схеме
Zn
CCl2F-CClF2  CClF=CF2
CClF=CF2
-ZnCl2
Газофазное дехлорирование протекает в среде водорода при 763– 823 К и 0,1 МПа.
6

1.3. Перфторпропилен
Перфторпропилен (гексафторпропилен) CF3–CF=CF2 – бесцветный газ без запаха с Ткип = 243,6 К и Тпл = 156,2 К, нерастворим в воде. Благодаря наличию группы –CF3, проявляющей большое электроакцепторное действие и эффект сопряжения, мономер является одним из реакционноспособных по отношению к нуклеофильным реагентам фторолефинов.
Мономер получают гидролизом фторуглеродов. Для этого используют дифторхлорметан (фреон-22), тетрафторэтилен и др. Процесс проводят при 873–973 К.
Перфторпропилен может быть синтезирован совместно с перфторэтиленом при пиролизе фтороформа:
CHF3 |
t |
CF2=CF-CF3 |
+ CF2=CF2 |
|
Продукт выделяют экстракцией.
2. АКРИЛОВЫЕ МОНОМЕРЫ
Акриловые мономеры широко используют в синтезе акрилатных каучуков, характеризующихся тепло-, озоно- и кислородостойкостью, устойчивостью к действию УФ-излучения, а также низкой газопроницаемостью.
2.1. Акрилонитрил
Акрилонитрил (нитрил акриловой кислоты, цианистый винил) – бес-
цветная жидкость с характерным запахом; Тпл – 190 К; Ткип – 350,3 К; d420 –
0,8064 г/см3; nD20 – 1,3914.
Смеси с воздухом от 3,05 до 17,0 об. % взрывчаты, токсичны. Со многими органическими растворителями смешивается в любых соотношениях.
В промышленности применяют в основном шесть методов получения акрилонитрила.
2.1.1.Получение из этилена через этиленоксид
иэтиленциангидрин
Этот метод является одним из первых, применяемых в промышленности. Вначале синтезируют этиленциангидрин из этиленоксида и синильной кислоты:
H2C CH2 + HCN  HO-CH2CH2-CN O
HO-CH2CH2-CN O
7
Процесс проводят при 323–343 К в присутствии основных катализаторов (например, триэтаноламина) и давлении 0,20–0,25 МПа. Продуктсырец содержит до 91 % основного вещества.
Используемую при синтезе синильную кислоту можно получать взаимодействием H2SO4 (90 %) c 25%-м раствором цианида натрия. Дешевле и проще получать синильную кислоту дегидратацией формамида:
HCONH2  HCN + H2O
HCN + H2O
Наряду с основной реакцией синтеза акрилонитрила из этиленоксида и синильной кислоты, протекают побочные превращения, связанные с гидролизом, взаимодействием этиленциангидрина с акрилонитрилом. Возможно образование высокомолекулярных соединений.
С целью очистки от побочных продуктов основного характера сырец промывают 13–17%-м раствором H2SO4. Избыток кислоты далее нейтрализуют водным раствором соды Na2CO3.
Процесс дегидратации этиленциангидрина осуществляют в жидкой фазе при 443–483 К по схеме
HO-CH2CH2-CN  CH2=CH-CN + H2O
CH2=CH-CN + H2O
на оксиде магния или в газовой фазе на активном оксиде алюминия в качестве катализаторов.
2.1.2. Окислительный аммонолиз пропилена
Процесс основан на превращении пропилена, аммиака и кислорода:
CH2=CH-CH3 + NH3 + 1,5O2  CH2=CH-CN + H2O
CH2=CH-CN + H2O
Эта реакция лежит в основном промышленном методе получения акрилонитрила. Смесь исходных веществ пропускают через твердый висмутфосформолибденовый катализатор при 673–773 К и давлении не выше 0,4 МПа. Катализаторная смесь может быть нанесена на различные инертные сорбенты. Это так называемые триггерные катализаторы. Последние отличаются повышенной механической и термической стойкостью, а кроме того, они могут содержать низкое количество ценных металлов – висмута и молибдена.
Процесс получения акрилонитрила окислительным аммонолизом пропилена протекает с образованием побочных реакций, таких как
CH2=CH-CHO + H2O
CH2=CH-CH3 + O2
 CH3CHO + HCHO
CH3CHO + HCHO
8
и ряда других. Для уменьшения образования побочных продуктов, которые затрудняют очистку акрилонитрила, аммиак подают в небольшом избытке.
2.1.3. Получение из ацетилена и синильной кислоты
Способ, основанный на жидкофазном гидроцианировании ацетилена, осуществляют в присутствии катализаторов, способных образовывать комплексные соединения как с ацетиленом, так и с синильной кислотой:
CH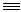 CH + HCN
CH + HCN  CH2=CH-C
CH2=CH-C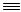 N
N
Катализаторами могут быть кислые водные растворы CuCl, которые содержат хлорид аммония и хлориды щелочных металлов (NH4Cl, KCl, NaCl). Процесс протекает с образованием ряда побочных продуктов. Проходит димеризация и тримеризация ацетилена с моновинилацетиленом и с дивинилацетиленом:
2 CH CH
CH  CH2=CH-C
CH2=CH-C CH CH CH CH2=CH-C
CH CH CH CH2=CH-C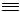 C-CH=CH2
C-CH=CH2
Гидрохлорированиеацетиленаприводиткобразованиювинилхлорида:
CH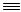 CH + HCl
CH + HCl  CH2=CHCl
CH2=CHCl
Наблюдается гидратация ацетилена в ацетальдегид:
CH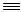 CH + H2O
CH + H2O  CH3CHO
CH3CHO
Возможны дальнейшие превращения образующихся побочных продуктов, как, например, гидратация моновинилацетилена в метилвинилкетон:
CH2=CH-C CH + H2O
CH + H2O  CH2=CH-CO-CH3
CH2=CH-CO-CH3
Протекают и другие превращения.
Процесс синтеза акрилонитрила включает ряд основных стадий. Вначале проводят компримирование свежего и циркулирующего ацетилена до избыточного давления 0,10–0,15 МПа. Затем осуществляют синтез акрилонитрила из ацетилена и HCN. После этого проводят выделения акрилонит- рила-сырца из реакционных газов.
9
Далее осуществляют очистку циркулирующего ацетилена из примесей. В дальнейшем ведут очистку акрилонитрила-сырца и тонкую его очистку. Катализаторный раствор подвергается регенерации.
2.1.4. Синтез через ацетальдегид и гидроксинитрил
На первой стадии взаимодействием ацетальдегида и синильной кислоты получают гидроксинитрил:
CH3CHO + HCN  CH3CH(OH)CN
CH3CH(OH)CN
Процесс ведут при 283–293 К и рН 7,0–7,5. Выход гидроксинитрила достигает 98 %.
Вторая стадия предусматривает дегидратацию гидроксинитрила с образованием акрилонитрила:
CH3CH(OH)CN  CH2=CH-CN + H2O
CH2=CH-CN + H2O
С целью предотвращения обратного разложения акрилонитрила на ацетальдегид и HCN процесс ведут при 600–700 К и времени контакта менее 3 секунд. Выход акрилонитрила в расчете на ацетальдегид достигает
90 %.
2.1.5. Получение из пропилена и оксида азота
Промышленное получение акрилонитрила осуществляют по схеме
CH2=CH-CH3 + NO  4CH2=CH-CN + 6H2O + N2
4CH2=CH-CN + 6H2O + N2
Процесс протекает при атмосферном давлении и температурном интервале 723–823 К. В качестве катализатора используют оксид серебра, нанесенный на оксид кремния. Могут применяться оксиды таллия и щелочноземельных металлов. Выход целевого продукта в расчете на пропилен составляет около 79 %.
2.1.6. Синтез прямым взаимодействием этилена, синильной кислоты и кислорода
Синтез акрилонитрила проводят при 603–633 К над катализаторами. Их получают на основе никеля или палладия, нанесенными на оксид алюминия:
10
