
Полимеразная цепная реакция (ПЦР) в клинической лабораторной диагностике. Общие принципы Методические рекомендации
.pdf
БИБЛИОТЕКА ПЕДИАТРИЧЕСКОГО УНИВЕРСИТЕТА
ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ (ПЦР) В КЛИНИЧЕСКОЙ
ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ
ОБЩИЕ ПРИНЦИПЫ
Санкт-Петербург
0

Министерство
здравоохранения Российской Федерации
Санкт-Петербургский Государственный Педиатрический Медицинский Университет
Методические
рекомендации
ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ (ПЦР)
В КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ
ОБЩИЕ ПРИНЦИПЫ
САНКТ-ПЕТЕРБУРГ
2018
1
УДК 579.2 ББК 52.64 П50
П50 Полимеразная цепная реакция (ПЦР) в клинической лабораторной диагностике. Общие принципы. Методические рекомендации. – СПб.:
СПбГПМУ, 2018. – 20 с.
ISBN 978-5-907065-06-2
В методических рекомендациях освещены вопросы использования полимеразной цепной реакции (ПЦР) в клинической лабораторной диагностике. Рассмотрены основы ПЦР и этапы анализа клинического материала с использованием ПЦР. Представлены модификации метода ПЦР и другие методы амплификации нуклеиновых кислот (МАНК). Уделено внимание вопросам обеспечения качества лабораторной диагностики, основанной на МАНК, и организации лаборатории, использующей МАНК.
Данные методические рекомендации предназначены для специалистов клинической лабораторной диагностики, бактериологов, акушеров-гинекологов, урологов, дерматовенерологов, инфекционистов, врачей общей практики, лаборантов, медицинских техников и др. Методические рекомендации могут быть использованы в качестве учебных материалов при подготовке студентов медицинских ВУЗов, а также при различных формах последипломного обучения.
Составители:
Савичева А.М., Шипицына Е.В., Хуснутдинова Т.А., Будиловская О.В., Крысанова А.А., Шалепо К.В., Спасибова Е.В., Воробьев С.В.
УДК 579.2 ББК 52.64
Утверждено учебно-методическим советом Государственного бюджетного образовательного учреждения высшего профессионального образования «Санкт-Петербургский государственный педиатрический медицинский университет» Министерства здравоохранения Российской Федерации
ISBN 978-5-907065-06-2 |
© СПбГПМУ, 2018 |
2
Содержание |
|
Введение ....................................................................................................................... |
4 |
Основы метода ПЦР.................................................................................................... |
5 |
Этапы анализа клинического материала с использованием ПЦР .......................... |
7 |
Модификации метода ПЦР ........................................................................................ |
9 |
Другие методы амплификации нуклеиновых кислот (МАНК) ............................ |
11 |
Применение метода ПЦР в клинической микробиологии .................................... |
12 |
Обеспечение качества лабораторной диагностики, основанной на МАНК........ |
14 |
Принципы организации работы лаборатории, применяющей МАНК ................ |
17 |
Нормативная литература .......................................................................................... |
20 |
3
Введение
Метод полимеразной цепной реакции (ПЦР) был разработан К. Мюллисом в 1983 году и с тех пор нашел широчайшее применение в биологии и медицине. С применением этого метода был совершен прорыв в диагностике целого ряда инфекционных и генетических заболеваний. В настоящее время ПЦР является неотъемлемой частью рутинной лабораторной практики.
Область применения ПЦР включает лабораторную диагностику инфекционных, генетических и некоторых других заболеваний, генную инженерию, судебную медицину, установление отцовства, биологический контроль препаратов крови, исследования в ветеринарии и растениеводстве. ПЦР в настоящее время – один из самых востребованных методов клинической микробиологической диагностики, позволяющий проводить высокочувствительную и высокоспецифичную диагностику инфекционных заболеваний, генотипирование микроорганизмов, оценку их вирулентности, определение устойчивости микрофлоры к антибиотикам. Данные методические рекомендации разработаны, в первую очередь, для применения в клинической микробиологической диагностике. Рассмотрены основы ПЦР и этапы анализа клинического материала с использованием ПЦР. Представлены модификации метода ПЦР и другие методы амплификации нуклеиновых кислот (МАНК). Уделено внимание вопросам обеспечения качества лабораторной диагностики, основанной на МАНК, и организации лаборатории, использующей МАНК.
Методические рекомендации предназначены для специалистов клинической лабораторной диагностики, бактериологов, акушеров-гинекологов, урологов, дерматовенерологов, инфекционистов, врачей общей практики, лаборантов, медицинских техников и др. Рекомендации могут быть использованы в качестве учебных материалов при подготовке студентов медицинских ВУЗов, а также при различных формах последипломного обучения.
4
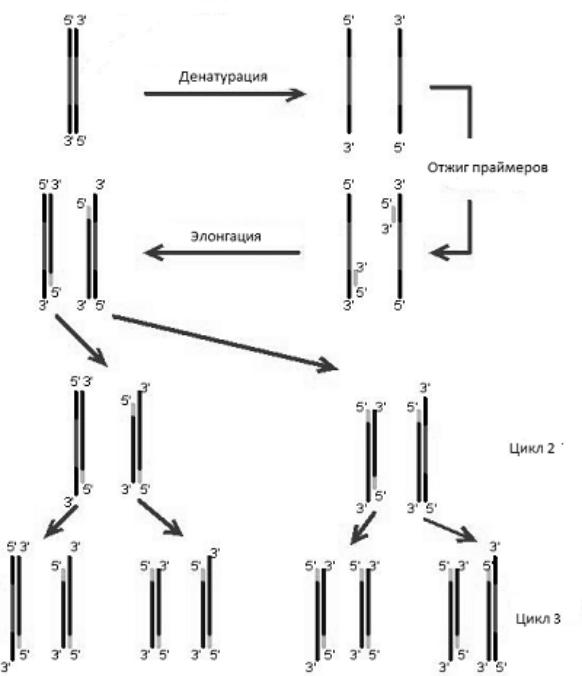
Основы метода ПЦР
Принцип метода ПЦР
В основе метода ПЦР лежит достраивание определенного фрагмента ДНК, осуществляемое с помощью фермента термостабильной ДНК-полимеразы, результатом чего является многократное увеличение копий (амплификации) данного фрагмента ДНК (рис. 1).
Рис. 1. Схема полимеразной цепной реакции.
Стадии ПЦР-амплификации
Цикл репликации ДНК включает в себя три основные стадии:
1) расплетение спирали ДНК и расхождение нитей (денатурация);
5
2)присоединение (отжиг) праймеров;
3)достраивание цепи дочерней нити (элонгация).
В ПЦР эти процессы осуществляются в пробирке в циклическом режиме. Переход от одной стадии реакции к другой достигается изменением температуры инкубационной смеси, которое осуществляется в термоциклере. Каждый цикл ПЦР-амплификации включает 3 стадии, протекающие при различных температурных режимах.
Денатурация ДНК: происходит расплетение двойной спирали ДНК с образованием одноцепочечных молекул при разрыве водородных связей между комплементарными парами оснований под воздействием высоких температур (93-95°С). Реакция протекает в течение 30-40 сек.
Отжиг праймеров: Присоединение праймеров происходит комплементарно к соответствующим последовательностям на противоположных цепях ДНК на границах специфического участка. Для каждой пары праймеров существует своя температура отжига, значения которой обычно располагаются в интервале 50-65°С. Время отжига варьирует от 20 до 60 сек.
Элонгация (синтез) цепей ДНК. Комплементарное достраивание цепей ДНК происходит от 5'-конца к 3'-концу цепи в противоположных направлениях, начиная с участков присоединения праймеров. Материалом для синтеза новых цепей ДНК служат добавляемые в раствор дНТФ. Процесс синтеза катализируется ферментом Тaq-полимеразой. Как правило, реакция протекает при 68-72°С (температурный оптимум фермента), время проведения элонгации зависит от размера амплифицируемого фрагмента.
Иногда в случае близкого значения температуры отжига праймеров и температуры оптимума работы фермента становится возможным использовать двухэтапный ПЦР-анализ, совместив отжиг и элонгацию.
Образовавшиеся в ходе первого цикла амплификации новые молекулы ДНК служат матрицей для второго цикла репликации ДНК. Таким образом, происходит экспоненциальное накопление исследуемых фрагментов ДНК (ампликонов) в реакционной смеси. За 30-40 циклов амплификации в растворе накапливается около 108 молекул ампликона.
Основные компоненты реакционной смеси
Реакционная смесь для проведения ПЦР включает следующие основные компоненты:
ДНК-матрица – ДНК, выделенная из анализируемого образца, содержащая искомый специфический фрагмент;
Праймеры – синтетические олигонуклеотиды размером 15–30 нуклеотидов, комплементарные прямой и обратной цепям определяемого фрагмента и ограничивающие его; играют ключевую роль в образовании продуктов реакции. Правильно подобранные праймеры обеспечивают специфичность и чувствительность теста.
Смесь дезоксинуклеозидтрифосфатов (дНТФ) – смесь четырех нуклеотид-
ных оснований дезоксиаденозинтрифосфата (дАТФ), дезоксигуанозинтрифосфата (дГТФ), дезоксицитозинтрифосфата (дЦТФ) и дезокситимидинтрифосфата
6
(дТТФ), служащих «строительными блоками» для синтеза новых комплементарных цепей ДНК.
Taq-полимераза – термостабильный фермент, катализирующий удлинение новой цепи ДНК.
Буферный раствор – реакционная среда, содержащая различные ионы, в том числе, ионы Mg2+, необходимые для поддержания оптимальной активности и стабильности фермента.
Этапы анализа клинического материала с использованием ПЦР
Проведение анализа с использованием метода ПЦР включает три основных этапа: выделение ДНК из клинического образца, амплификация специфического фрагмента ДНК, анализ продуктов амплификации. Анализ клинического материала в клинической лабораторной диагностике должен производиться только с использованием стандартизированных, разрешенных к применению в клинической практике тестов.
Выделение ДНК из клинического образца. Для подготовки пробы к по-
становке ПЦР используют различные методики в зависимости от поставленных задач и характера анализируемого материала. Их суть заключается в экстракции (извлечении) ДНК из образца клинического материала и удалении или нейтрализации посторонних примесей, которые могут ингибировать реакцию ПЦР. Разработан целый ряд методов для выделения ДНК из клинического материала. Классическим методом выделения ДНК считается ферментативный протеолиз клеток с последующей депротеинизацией и переосаждением ДНК спиртом. Одним из самых популярных в настоящее время является метод выделения ДНК, основанный на лизисе клеток сильным хаотропного агента – гуанидина изотиоционатом с последующей сорбцией ДНК на носителе (стеклянные бусы, диатомовая земля, стеклянное «молоко» и т.д.). После серии отмывок в пробе остается ДНК, сорбированная на носителе, с которого она снимается с помощью элюирующего буфера. Еще одна группа методов выделения ДНК основана на использовании ионообменников, которые сорбируют не ДНК, а примеси, ингибирующие ПЦР. Как правило, эта технология включает две стадии: кипячение образца, в результате которого клеточные стенки разрушаются, а нуклеиновые кислоты выходят в раствор, и сорбция примесей на ионообменнике.
Амплификация специфического фрагмента ДНК. На данном этапе про-
исходит накопление искомых фрагментов ДНК. Процесс амплификации происходит в специальных программируемых термостатах, автоматически меняющих температуру реакционной смеси по заданной программе.
Анализ продуктов амплификации. Для детекции продуктов реакции существует несколько методов. До недавнего времени самым распространенным методом являлся электрофорез в агарозном геле (рис. 2). Существенными недостатками метода являются субъективность оценки результатов, низкая производительность, высокий риск контаминации, а также вероятность амплификации
7
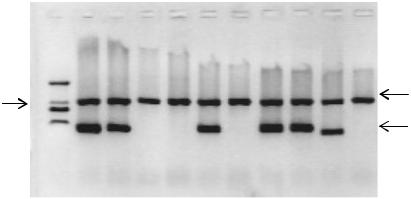
в ходе ПЦР неспецифического продукта, сходного по размерам с детектируемым продуктом.
Маркер |
Внутренний |
молекулярного |
контроль |
веса |
Положительные |
|
пробы |
Рис. 2. Электрофореграмма продуктов амплификации
Альтернативой электрофоретическим методам детекции амплифицированной ДНК являются методы гибридизационной детекции, когда амплифицированная ДНК гибридизуется с олигонуклеотидными зондами, и, в зависимости от типа мечения зонда, образующийся гибрид регистрируется с использованием фотоили флюориметрии.
Однако самое большое распространение в последнее время получил способ детекции амплифицированной ДНК в режиме реального времени. Данный подход реализуется путем использования меченных флюорофорами зондов, генерирующих флюоресцентный сигнал при наличии в реакционной смеси искомой последовательности ДНК. Для проведения ПЦР в реальном времени используются термоциклеры c оптическим блоком, позволяющим мониторировать интенсивность флюоресценции в ходе реакции: ДТ-96 (ДТпрайм) и ДТ 48 (ДТлайт) (НПФ «ДНК-Технология», Россия) «iQ5» и CFX (BioRad, США), «COBAS Amplicor» (Roche, США), «АВI PRISM 7400» (ABI, США), «RotorGene» (Qiagen, GmbH Германия), Smart Cycler (Cepheid, США) и другие.
Современные термоциклеры для ПЦР в реальном времени оснащены каналами для детекции флюоресценции в нескольких диапазонах длин волн (до 5–6), что позволяет разрабатывать мультиплексные форматы реакции (выявление сразу нескольких мишеней в одной реакции). Так как технология ПЦР в реальном времени позволяет регистрировать накопление специфического продукта амплификации непосредственно в процессе реакции, это существенно сокращает время анализа и снижает риск контаминации. Кроме того, так как интенсивность накапливаемого сигнала прямо пропорциональна количеству мишени в пробе, ПЦР в реальном времени позволяет проводить количественную оценку исследуемой мишени в пробе (рис. 3).
8
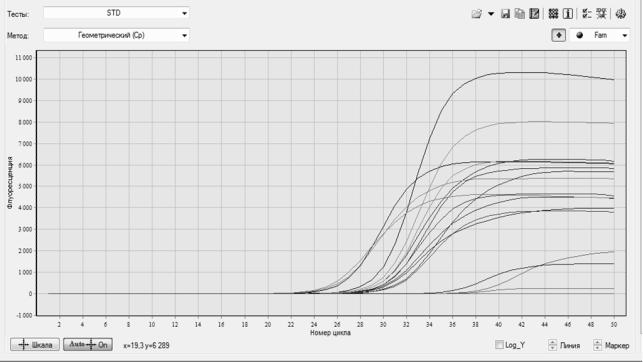
Рис. 3. Детекция продуктов ПЦР в режиме реального времени
Модификации метода ПЦР
Разработан ряд модификаций метода ПЦР: ПЦР с обратной транскрипцией
(reverse transcription PCR), мультиплексная ПЦР (multiplex PCR), ПЦР в два ра-
унда, или «гнездовая» ПЦР (nested PCR), ПЦР с горячим стартом (hot start PCR), ступенчатая ПЦР (touch-down PCR), ПЦР длинных фрагментов (longrange PCR), in situ ПЦР, ПЦР в реальном времени (real-time PCR).
ПЦР с обратной транскрипцией (ОТ-ПЦР). Применяется для исследова-
ния РНК. ПЦР способна проходить только на матрице ДНК. Для исследования РНК перед ПЦР проводят реакцию обратной транскрипции, которая представляет собой метод синтеза комплементарной ДНК (кДНК) на матрице РНК. В ходе ОТ-ПЦР одноцепочечная молекула РНК превращается в комплементарную одноцепочечную ДНК, которую затем амплифицируют, используя традиционную ПЦР. Такой синтез возможен с участием фермента РНК-зависимой ДНК-полимеразы, которую также называют обратной транскриптазой или ревертазой. Ревертаза кодируется геномами некоторых РНК-содержащих вирусов и подвижных генетических элементов генома высших организмов. Наиболее часто для ОТ-ПЦР используют ревертазу вируса мышиного лейкоза Молони
(M-MLV от англ. Moloney Murine Leukemia Virus) или вируса птичьего миелоб-
ластоза (AMV от англ. Avian myeloblastosis virus). В клинической практике эту модификацию ПЦР используют для диагностики РНК-содержащих вирусов.
Мультиплексная ПЦР. Одновременно используют более одной пары олигонуклеотидных праймеров, что приводит к одновременной амплификации нескольких фрагментов ДНК. Позволяет выявлять сразу несколько мишеней. Широко используется в клинической микробиологической диагностике для вы-
9
