
- •И.А. Жарская
- •Н.Л. Мара
- •Химия
- •Хабаровск 2003
- •Министерство образования Российской Федерации
- •Хабаровская государственная академия экономики и права
- •Кафедра естественнонаучных дисциплин
- •Химия
- •Часть 1
- •Хабаровск 2003
- •Химия. Часть 1. Общая химия: Пособие для абитуриентов и учащихся школы «Юный товаровед-эксперт» очной и заочной форм обучения. / И.А. Жарская, Н.Л. Мара. – Хабаровск: РИЦ ХГАЭП, 2003. – с.
- •Редактор Г.С. Одинцова
- •Уч.-изд. _____. Тираж_______экз. Заказ №_____
- •680042, Хабаровск. ул. Тихоокеанская, 134, ХГАЭП, РИЦ
- •Обучающая задача 2
- •Решение:
- •Из закона Авогадро следует, что при одном и том же давление и одинаковых температурах масса (m) равных объемов газов относится как их молярные массы (М).
- •Состояние электрона в атоме
- •Форма и ориентация электронных орбиталей
- •Обучающая задача 1
- •Электронные
- •ХИМИЧЕСКАЯ СВЯЗЬ
- •ковалентная
- •связь
- •CuOHCl
- •основные
- •Способы выражения состава раствора
- •Важнейшие индикаторы
- •Твердый
- •Жидкий
- •Разбавленный
- •Написать уравнение диссоциации следующих электролитов
- •Тест 1
- •Тест 2
- •ТЕМА 2. СТРОЕНИЕ АТОМОВ
- •Тест 1
- •Тест 4
- •Тест 5
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 1
- •Кислоты
- •Тест 1
- •Соли
- •Тест 1
- •Комбинированные тестовые задания
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 2
- •Тест 3

22
4. КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
|
Чистые вещества |
|
|
Простые вещества |
Сложные вещества |
||
металлы |
неметаллы |
бинарные |
многоэлементные |
|
|
соединения |
|
оксиды
несолеобразующие
CO, NO
солеобразующие
CO2, N2O5, Na2O
основные
Na2O, CaO, MnO, CrO
амфотерные
ZnO, BeO, Al2O3,
MnO2, Cr2O3
кислотные
SO3, CO2, Mn2O7, CrO3
прочие
HCl, H2S, NH3
гидроксиды
основные
NaOH, Ca(OH)4, Mn(OH)2, Cr(OH)2
амфотерные
Zn(OH)4, Be(OH)2, Al(OH3), Mn(OH)4, Cr(OH)2
кислотные
HNO3, H2SO4, HMnO4,
H2CrO4
соли
cредние
K2SO4, AlCl3
кислые
NaHCO3
основные
CuOHCl
двойные
Kal(SO4)2
смешанные
CaCl(OCl)
комплексные
K4[Fe(CN)6]
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород
Получение оксидов
1.Соединение простого вещества с кислородом.
C + O2 = CO2 4Li + O2 = 2Li2O

23
2.Горение сложных веществ:
4CH3NH2 + 9O2 = 4CO2 + 2N2 + 10H2O
3.Разложение при нагревании кислородных соединений:
CaCO3 = CaO + CO2;
|
t |
2Сu(NO3)2 |
2CuO + 4NO2 + O2; |
|
t |
2Fe(OH)3 |
Fe2O3 + 3H2O |
4. Разложение некоторых оксидов
t
Cu(OH)2 CuO + H2O.
Химические свойства оксидов
1. Взаимодействие с водой:
Основного оксида Na2O + H2O = 2NaOH Кислотного оксида CO2 + H2O = H2CO3
Несолеобразующие оксиды с водой не взаимодействуют. 2. Взаимодействие с кислотами:
Основные оксиды MgO + H2SO4 = MgSO4 + H2O
Амфотерные оксиды ZnO + 2HCl = ZnCl2 + H2O Кислотные оксиды не взаимодействуют
3.Взаимодействие с основаниями:
Кислотные оксид SO3 + 2NaOH = Na2SO4 + H2O Амфотерные оксиды Al2O3 + 2NaOH = 2NaAlO2 + H2O
Основные оксиды не взаимодействуют
4.Взаимодействие кислотных и основных оксидов друг с другом:
CaO + CO2 = CaCO3
Гидроксиды основные и амфотерные – сложные вещества, состоящие из ионов металла и ионов гидроксогрупп
Получение гидроксидов:
1. Растворение щелочных металлов в воде:
2Na + H2O = 2NaOH + H2↑
2.Взаимодействие оксидов щелочных и щелочноземельных металлов с водой:
CaO + H2O = Ca(OH)2 ↓
3.Взаимодействие солей со щелочами:
MnCl2 + 2NaOH = Mn(OH)2 ↓ + 2NaCl
Al(NO3)3 + 3KOH = Al(OH)3 ↓ + 3KNO3
4.Электролиз растворов солей
2KCl + 2H2O 2KOH + H2↑ + Cl2↑
Химические свойства гидроксидов:
1. Водные растворы диссоциируют на ионы металла и гидроксид иона:
24
KOH → K + + OH-
Zn(OH)2 |
OH- + ZnOH+ |
ZnOH+ |
OH- + Zn2+ |
2.Взаимодействие с водой растворимых оксидов
CaO + H2O = Ca(OH)2
3. Взаимодействие с кислотными оксидами:
2NaOH + SiO2 = Na2SiO3 + H2O 4. Взаимодействие с кислотами:
КОН + HCl = KCl + H2O Al(OH)3 + 3HCl = AlCl3 + 3H2O
5. Взаимодействие с растворами солей:
2 KOH + CuSO4 = Cu(OH)2↓ + K2SO4
6. Взаимодействие щелочей с амфотерными гидроксидами (в водных растворах):
Al(OH)3 + NaOH = Na[Al(OH)4]
КИСЛОТЫ
вещества, состоящие из ионов водорода и ионов кислотного остатка
число |
|
по способности к диссо- |
|
по содержанию кисло- |
ионов водорода |
|
циации |
|
рода |
|
|
|
|
|
|
|
|
|
|
|
|
|
Одноосновные |
|
cильные |
|
|
бескислородные |
|
HCl, HNO3 |
|
электролиты |
|
|
HCl, HCN |
|
|
|
HNO3, H2SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислородо- |
|
двухосновные |
|
слабые |
|
|
содержащие |
|
|
|
|
H2CO3, HClO4 |
||
|
H2S, H2SO4, |
|
электролиты |
|
|
|
|
|
|
|
|
||
|
H2CrO4 |
|
H2CO3, H2S |
|
|
|
|
|
|
|
|
|
|
трехосновные
H3PO4, H3AlO4
Название бескислородных кислот: неметалл + о + водородная кислота. Напри-
мер, HCl – хлороводородная кислота
Название кислородосодержащих кислот образуются от названия неметалла (металла) в зависимости от степени окисления: если степень окисления равна номеру группы, то окончание –ная, -вая; с уменьшением степени окисления – оватая, -истая, -оватистая.

25
HCl+7O4 – хлорная кислота HCl+5O3 – хлорноватая кислота HCl+3O2 – хлористая кислота
Получение кислот:
HCl+1O – хлорноватистая кислота HMn+7O4 – марганцовая кислота H2Mn+6O4 – марганцовистая кислота
1.Соединение водорода с неметаллом с последующим растворением в воде:
H2 + Br2 = 2HBr
2.Взаимодействие оксида неметалла с водой:
SO3 + H2O = H2SO4
3.Взаимодействие соли с кислотой:
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
4.Окисление простых веществ:
Br2 + 2Cl2 + 3H2O = HBrO3 + 4HCl
Химические свойства кислот
1. В водном растворе диссоциируют на положительные заряженные ионы водо-
рода и отрицательно заряженные ионы кислотного остатка: HBr → H+ + Br –
H2SO3 |
H+ + HSO 3 |
|
HSO |
3 |
Н+ + SO 2 |
|
3 |
|
2. Разложение некоторых кислот:
H2CO3 СO2↑ + H2O
3. Взаимодействие с металлами:
2HCl + Zn = ZnCl2 + H2 ↑
Cu + 2H2SO4к = CuSO4 + 2H2O + SO2↑
4. Взаимодействие с основными и амфотерными оксидами:
H2SO4 + MgO = MgSO4 + H2O
H2SO4 + ZnO = ZnSO4 + H2O
5. Взаимодействие с основными и амфотерными гидроксидами:
H2SO4 + 2KOH = K2SO4 + 2H2O
3HCl + Al(OH)3 = AlCl3 + 3H2O 6. Взаимодействие с солями:
H2SO4 + K2SiO3 = H2SiO3↓ + K2SO4
Названия некоторых кислот и их солей
Формула |
Традиционное название кислот |
Названия средних солей |
HNO3 |
Азотная |
Нитраты |
HNO2 |
Азотистая |
Нитриты |
H3BO3 |
Ортоборная |
Ортобораты |
H2CO3 |
Угольная |
Карбонаты |
H2SiO3 |
Метакремниевая (кремниевая) |
Метасиликаты (сили- |
|
|
каты) |

|
26 |
|
|
|
|
H3PO4 |
Ортофосфорная |
Ортофосфаты |
|
|
(фосфаты) |
HPO3 |
Метафосфорная |
Метафосфаты |
H2SO4 |
Серная |
Сульфаты |
H2SO3 |
Сернистая |
Сульфиты |
HClO |
Хлорноватистая |
Гипохлориты |
HClO2 |
Хлористая |
Хлориты |
HClO3 |
Хлорноватая |
Хлораты |
HClO4 |
Хлорная |
Перхлораты |
H2SeO3 |
Селенистая |
Селениты |
H2SeO4 |
Селеновая |
Селенаты |
H3AlO3 |
Ортоалюминиевая |
Ортоалюминаты |
HAlO2 |
Метаалюминипиевая |
Метаалюминаты |
H2ZnO2 |
Цинковая |
Цинкаты |
H2SnO2 |
Оловянистая |
Станниты |
H2SnO3 |
Оловянная |
Станнаты |
H2PbO2 |
Свинцовистая |
Плюмбиты |
H2PbO3 |
Свинцовая |
Плюмбаты |
H3SbO4 |
Сурьмяная |
Стибаты |
H2CrO4 |
Хромовая |
Хроматы |
H2Cr2O7 |
Дихромовая |
Дихроматы |
HCrO2 |
Хромистая |
Хромиты |
HMnO4 |
Марганцовая |
Перманганаты |
H2MnO4 |
Марганцовистая |
Манганаты |
H2MoO4 |
Молибденовая |
Молибдаты |
HCN |
Циановодородная (синильная) |
Цианиды |
HCl |
Хлороводородная (соляная) |
Хлориды |
HBr |
Бромоводородная |
Бромиды |
HJ |
Иодоводородная |
Иодиды |
H2S |
Сероводородная |
Сульфиды |
Соли – это сложные вещества, состоящие из ионов металла и ионов кислотного остатка
Название средних солей состоят из названия кислотного остатка и названия иона металла или другого положительного иона. Например: Ca(NO3)2 – нитрат кальция; MnCl2 – хлорид марганца (II); (NH4)SO4 – сульфат аммония.
Название кислых солей образуются так же, как и средних, но при этом добавляют приставку «гидро», указывающую на наличие незамещенных атомов водорода, число которых обозначается греческими числительными (ди, три и т.д.). Например: Na2HPO4 – гидрофосфат натрия; Ba(HCO3)2 – гидрокарбонат бария; NaH2PO4 – дигидрофосфат натрия.

27
Название основных солей образуется подобно названиям средних солей, но при этом добавляют приставку «гидроксо», указывающую на наличие незамещенных гидроксогрупп, число которых обозначаются греческими числительными. Например: FeOHCl – хлорид гидроксожелеза (II); (FeOH)2SO4 – сульфат гидроксожелеза (II); Al(OH)2NO3 – нитрат дигидроксоалюминия.
Получение солей
1.Взаимодействие металлов с неметаллами:
Fe + S t FeS 2K + Cl2 = 2KCl
2.Взаимодействие основных и кислотных оксидов
CaO + SO3 = CaSO3
3.Средние соли получают полным замещением ионов водорода кислоты на катионы:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
H2SO4 + 2NH4OH = (NH4)2SO4 + H2O
Кислые соли получают неполным замещением ионов водорода кислоты на катион:
H2SO4 + NaOH = NaHSO2 + H2O
Основные соли получают неполным замещением гидроксогрупп основания на кислотный остаток:
Mg(OH)2 + HCl = MgOHCl + H2O
4.Взаимодействие металла с кислотой
Mg + 2HCl = MgCl2 + H2↑
3Cu + 8HNO3р + 3Сu(NO3)2 + 4H2O + 2NO↑
5.Взаимодействие кислоты с солью
H2SO4 + Na2SiO3 = H2SiO3↓ + Na2SO4
6.Взаимодействие солей
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
7.Взаимодействие металлов с солями:
Zn + Cu(NO3)2 = Zn(NO3)2 + Cu
8.Взаимодействие основных и амфотерных оксидов с кислотами:
CuO + H2SO4 = CuSO4 + H2O Al2O3 + 6HCl = 2AlCl3 + 3H2O
9.Взаимодействие кислотных оксидов с основаниями:
N2O5 + Ba(OH)2 = Ba(NO3)2 + 3H2O
10.Взаимодействие щелочей с солями:
2KOH + CuCl2 = Cu(OH)2 + 2KCl
11. Взаимодействие кислот с солями:
NaCl+ H2SO4 = NaHSO4 + HCl↑
Свойства солей
1. В водных растворах соли диссоциируют:

|
|
|
|
|
28 |
Na2SO4 = 2Na+ + SO 2 |
|
|
|
|
|
4 |
|
|
|
|
|
NaHCO3 = Na+ + HCO |
3 |
; |
HCO |
3 |
= H+ + CO 2 |
|
|
|
3 |
||
CuOHCl = CuOH+ + Cl-; |
CuOH+ = Cu2+ + OH- |
||||
2.Разложение некоторых солей
CaCO3 t CaO + CO2↑
3.Взаимодействие с металлами:
Fe + CuSO4 = Cu + FeSO4
4. Взаимодействие с кислотами:
Na2S + 2HCl = H2S↑ + 2HCl
5. Взаимодействие со щелочами:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
6. Взаимодействие с солями:
CaCl2 + Na2CO3 = 2HCl + CaCO3↓
7. Взаимодействие с водой – гидролиз солей, приводит к изменению рН среды. Гидролизу не подвергаются соли, образованные сильным основанием и сильной кислотой. Соли, образованные слабой кислотой и сильным основанием, подвергаются гидролизу по аниону:
KCN + H2O = KOH + HCN (среда щелочная, рН > 7)
K+ + CN- + H2O = K+ + HCN + OH- СN- + H2O = HCN + OH-
Соли, образованные сильной кислотой и слабым основанием, подвергаются гидролизу по катиону:
NH4Cl + H2O = NH4OH + HCl (среда кислая, рН < 7) NH 4 + Cl- + H2O = NH4OH + H+ + Cl-
NH 4 + H2O = NH4OH + H+
Соли, образованные слабыми основаниями и слабой кислотой подвергаются гидролизу по катиону и аниону:
NH4 + CN + H2O = NH4OH + HCN NH 4 + CN- + H2O + HCN
Генетическая связь между классами неорганических соединений
Металл  Основный оксид
Основный оксид  Основание
Основание
+ |
|
Соль |
+ |
|
|
|
|
Неметалл |
Кислотный оксид |
Кислота |
|

29
Обучающая задача № 1
Какая из двух солей NaCl и CuCl2 подвергается гидролизу в водном растворе? Ответ подтвердите с помощью молекулярной и ионно-молекулярных реакций. Укажите рН среды.
Решение
Соль NaCl в водном растворе находится в виде ионов Na+ и Cl-, принадлежащих сильным электролитам. Поэтому эти ионы не могул взаимодействовать с молекулами воды с образованием ионом или молекул слабого электролита; рН среды не изменяется. Данная соль гидролизу не подвергается
Соль CuCl2 в водном растворе находится в виде ионов Cu2+ , принадлежащих слабому электролиту Cu(OH)2 и Cl-, принадлежащих сильному электролиту HCl. Поэтому соль CuCl2 в водном растворе подвергается гидролизу по катиону, разрушая молекулы воды и высвобождая ионы водорода H+; среда становится кислая (рН <7). Т.к. ион слабого электролита двухзаряден, то гидролиз может идти по двум ступеням.
I ступень
Cu2+ |
+ H2O CuOH+ + H+ |
||
Cu2+ |
+ 2Cl- + H2O |
CuOH+ + H+ + 2Cl- |
|
CuCl2 + H2O |
CuOHCl + HCl |
||
II ступень |
|
|
|
CuOH+ + H2O |
Cu(OH)2 + H+ |
||
CuOH+ + Cl- + H2O |
Cu(OH)2 + H+ + Cl- |
||
CuOHCl + H2O |
Cu(OH)2 + HCl |
||
Задания для самоподготовки:
1.Напишите уравнения реакций, с помощью, которых можно осуществить следующие превращения. Назовите вещества и укажите, к какому классу они относятся.
№ |
Схема процесса |
|
варианта |
||
|
||
1 |
CuO → CuSO4 → Cu(OH)2 → CuCl2 |
|
|
NaCrO2 |
|
2 |
Cr2O3 → Cr(NO3)3 → Cr(OH)3 |
|
|
Cr2(SO4)3 |
3PbO → Pb(NO3)2 → Pb(OH)2 → Na2PbO2
4SiO2 → Na2SiO3 → H2SIO3 → Ca(HSiO3)2
5CO2 → H2CO3 → CuCO3 → Ca(HCO3)2
|
Al(NO3)3 |
6 |
Al → AlCl3 → Al(OH)3 |
|
Na[Al(OH)4] |
7 |
SO2 → SO3 → H2SO4 → BaSO4 |
8 |
Na2ZnO2 |
30
ZnO → ZnSO4 → Zn(OH)2 
Zn(NO3)2
9 KHCO3 → CO2 → CaCO3 → Ca(OH)2
10 Si → SiO2 → K2SiO3 → H2SiO3
 ZnCl2
ZnCl2
11 Zn → ZnSO4 → Zn(OH)2
Na2ZnO2
12Ag → AgNO3 → AgCl → AgOH
13Ca → CaO → CaCl2 → Ca(OH)2
|
NaAlO2 |
14 |
Al2O3 |
AlCl3 Al(OH)3
15N2O3 → N2O5 → HNO3 → Cu(NO3)2
16Al → Al2(SO4)3 → Na[Al(OH)4] → AlCl3
17Mg → MgO → MgCl2 → Mg(OH)2 → MgSO4
18CuO → CuSO4 → Cu(OH)2 → CuOHCl
19Cr2O3 → CrCl3 → Cr(OH)3 → Cr(NO3)3
20S → SO2 → Na2SO3 → H2SO3
21Mg → MgO → Mg(OH)2 → MgOHCl
22NO → NO2 → HNO3 → CuOHNO3
23NH3 → NH4OH → NH4Cl → (NH4)2SO3
24K2O → KOH → K2S → H2S
25CaO → CaCO3 → Ca(HCO3)2 → Ca(OH)2
2.Напишите молекулярные и ионно-молекулярные уравнения гидролиза следующих солей, укажите тип гидролиза и рН среды.
1.CuSO4 и Na2S
2.AlCl3 и K2CO3
3.NaHCO3 и ZnSO4
4.AgNO3 и AlCl3
5.KNO2 и Zn(NO3)2
6.Fe(NO3)3 и KHSiO3
7.Na3PO4 и Ca(HCO3)2
8.FeBr3 и NH4Cl
9.MgCl2 и Na2SO3
10.MnCl2 и CuOHCl

31
5. КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
По числу и составу исходных и образующихся веществ
Реакция |
|
|
Определение |
|
|
|
|
|
Пример |
||
Разложения |
Реакция, в которой из одного ис- |
|
|
t |
|
|
|||||
|
ходного |
вещества образуется |
не- |
|
2Hg |
2Hg + O2 |
|||||
|
сколько новых веществ |
|
|
|
|
|
t |
|
|||
|
|
|
|
CaCO3 |
CaO CO2 |
||||||
Замещения |
Реакция между простым и слож- |
|
Mg + Cu(NO3)2 = |
||||||||
|
ным веществами, в результате ко- |
|
MgSO4 + Cu |
|
|||||||
|
торой |
атомы |
простого |
вещества |
|
|
|
|
|
||
|
замещают атомы одного из эле- |
|
|
|
К |
|
|||||
|
|
C6H6+ Cl2 |
C6H5Cl + HCl |
||||||||
|
ментов сложного вещества |
|
|
|
|
|
|
||||
Обмена |
Реакция, в результате которой два |
|
AgNO3 + HCl → |
||||||||
|
вещества |
обмениваются своими |
|
Ag2Cl↓ + HNO3 |
|||||||
|
составными частями, образуя два |
|
|
|
|
|
|||||
|
новых вещества |
|
|
|
|
|
|
|
|||
Соединения |
Реакция, в результате которой из |
|
H2 + Cl2 = 2HCl |
||||||||
|
двух или нескольких веществ об- |
|
HCl + NH3 → NH4Cl↓ |
||||||||
|
разуется одно новое |
|
|
|
|
|
|
|
|||
По агрегатному состоянию реагирующих веществ |
|||||||||||
Гомогенные |
Реагирующие вещества находятся |
|
2COг + O2г = 2CO2г |
||||||||
|
в одном агрегатном состоянии |
|
|
|
|
|
|
||||
Гетерогенные |
Реагирующие вещества находятся |
|
С(т) + О2(г) = СО2(г) |
||||||||
|
в различных агрегатных состояни- |
|
|
|
|
|
|||||
|
ях, реакция протекает на поверх- |
|
Zn(т) + H2SO4 (ж) = |
||||||||
|
ности раздела фаз |
|
|
|
ZnSO4(ж) + H2(г) |
||||||
|
|
|
|
|
|
|
|
|
|
||
Реакция |
|
|
Определение |
|
|
|
|
|
Пример |
||
|
|
|
По признаку обратимости |
|
|
||||||
Обратимые |
Такая реакция, которая в данных |
|
3H2 + N2 |
2NH3 |
|||||||
|
условиях протекает одновременно в |
|
Br2 + H2O |
HBrO + HBr |
|||||||
|
двух |
взаимно противоположных |
|
|
|
|
|||||
|
направлениях |
|
|
|
|
|
|
|
|
||
Необра- |
Такая реакция, которая в данных |
|
C + O2 = CO2 + H2O |
||||||||
тимые |
условиях протекает до конца, |
т. е. |
|
H2SO4 + BaCl2 → BaSO4↓ |
|||||||
|
до полного превращения исходных |
|
+ 2HCl |
|
|||||||
|
веществ в продукты реакции. |
|
|
|
|
|
|
||||
|
Признаки необратимости: |
|
|
|
|
|
|
||||
|
образование |
в продуктах реакции |
|
2Mg + O2 = 2MgO + Q |
|||||||
|
осадка, газообразного или малодис- |
|
|
|
|
||||||
|
социируемого вещества, а также |
|
|
|
|
||||||
|
выделение большого |
количества |
|
|
|
|
|||||
|
теплоты |
|
|
|
|
|
|
|
|
|
|

32
По тепловому эффекту
Эндотерми- |
Реакция, проходящая с поглощени- |
N2 + O2 = 2NO – Q |
|
||||
ческая |
ем теплоты |
|
|
|
|
||
Экзотермиче- |
Реакция, проходящая с выделением |
H2 + Cl2 = 2HCl + Q |
|
||||
ская |
теплоты |
|
|
|
|
||
|
|
По изменению степени окисления |
|
|
|||
Происходящая |
без |
|
Реакция, в которой степень |
2AlCl3 + 3Na2S + 6H2O = |
|||
изменения степени |
|
окисления каждого |
атома |
2Al(OH)3 |
+ 3H2S |
+ |
|
окисления |
|
|
остается неизменной |
|
6NaCl |
|
|
Окислительно- |
|
|
Реакции, протекающие с из- |
2K+1J- + Cl 0 |
= 2K+1Cl-1 |
|
|
восстановительные |
|
менением степени окисления |
2 |
|
|
||
|
|
|
|
||||
реакции |
|
|
атомов элементов |
|
|
|
|
Электролиз |
|
|
окислительно- |
|
расплав NaCl |
|
|
|
|
|
восстановительный процесс, |
электролиз |
|
||
|
|
|
|
|
|
||
|
|
|
протекающий на электродах |
2NaCl |
2Na + Cl2 |
|
|
|
|
|
при прохождении электри- |
раствор NaCl |
|
||
|
|
|
ческого тока через |
раствор |
|
||
|
|
|
|
|
|
электролиз |
|
|
|
|
или расплав электролита |
2H2O + 2NaCl |
H2 |
||
|
|
|
|
|
+ Cl2 + 2NaOH |
|
|
Схема электролиза расплава NaCl
NaClрасплав → Na+ + Cl-
(+) Анод: 2Cl- - 2ē = Cl2 |
(–) Катод: Na+ + ē = Na0 |
окисление |
восстановление |
электролиз |
|
2NaCl |
2Na + Cl2 |
Схема электролиза раствора NaCl |
|
(+) Анод: 2Сl- - 2ē = Cl2 |
(–) Катод: 2H2O + 2ē = 2OH- + H2 |
окисление |
восстановление |
2H2O + 2Cl- электролиз |
H2 + Cl2 + 2OH- или |
электролиз |
|
2H2O + 2NaCl |
H2 + Cl2 + 2NaOH |
33
Анодные процессы
на нерастворимом аноде |
на растворимом аноде |
Cl-, Br-, J-, OH- |
2 |
|
S2- |
SO 4 |
; NO 3 |
окисляются |
не |
окисляются, |
в расплаве и |
окисляются моле- |
|
водных рас- |
кулы воды, выделя- |
|
творах |
ется кислород: |
|
|
2H2O - 4ē = O2 + |
|
|
4H+ |
(кислая и |
нейтральная среда)
4OH- - 4ē = 2O2 + 2H2O
Me |
Me+n |
nē |
анод раство- |
|
|
|
ряется |
↓ |
↓ |
↓ |
|
металл |
уходят |
уходят во |
|
анода |
в рас- |
внешнюю |
|
|
твор |
цепь |
|
Катодные процессы
|
Увеличение окислительной способности ионов металлов |
|||
Li+; |
K+; Ca2+; Na+; |
Zn2+; Cr3+; Fe2+; |
H+ |
Cu2+; Ag+; Hg2+; Au3+ |
Mg2+; Al3+ |
Ni2+ |
|
|
|
не |
восстанавливаются |
восстанавливаются |
|
восстанавливаются в |
на катоде в растворе, |
на катоде вместе с |
|
растворе на катоде при |
|
восстанавливаются |
молекулами воды |
|
электролизе |
|
молекулы воды |
|
|
|
|
Окислительно-восстановительные реакции
Межмолекулярная (межатомная)
Окислитель и восстановитель находится в разных молекулах (атомах)
H2S-2 + O 02 = S0 + H2O-2
Внутримолекулярная
Окислитель и восстановитель в одном веществе:
а) атомы различных элементов
t
2K+1Cl+5O 3 2 
2K+1Cl-1 + 3O 02
б) атомы одного элемента (диспро-
порционирование)
3NaCl+1O → NaCl+5 + 2NaCl-1
34
Важнейшие окислители и восстановители
Окислители |
Восстановители |
1. Простые вещества: галогены (F2, |
1. Простые вещества: металлы; водо- |
Cl2, Br2, I2); кислород (О2), озон (О3) |
род Н2, углерод С при нагревании |
2.Оксиды элементов с высокими сте- 2. Оксиды: СO, SO2 пенями окисления (MnO2, CrO3, SO3,
NO2, HgO)
3.Кислоты, содержащие элементы с 3. Бескислородные кислоты, содер-
высокими степенями окисления: окисжащие элемент в отрицательной сте-
ляющие |
ионом |
|
водорода |
(HCl, |
пени окисления (HCl, HF, HBr, H2S) |
|||
H2SO4р); окисляющие ионом кислот- |
|
|||||||
ного остатка (HNO3, H2SO4конц, HIO3) |
|
|||||||
4. Соли, содержащие элемент с высо- |
4. Водородные соединения (NH3, PH3, |
|||||||
кой степенью |
окисления |
(KMnO4, |
CH4 и др.) |
|||||
K2Cr2O7, KClO3) |
|
|
|
|
|
|||
5. Ионы металлов в высокой степени |
5. Ионы металлов в низших степенях |
|||||||
окисления |
или |
ионы малоактивных |
окисления (Sn+2, Cr+2, Fe+2), а также |
|||||
металлов (Fe |
3 |
, Cu |
2 |
+ |
|
гидрид-ион Н– |
||
|
|
, Ag ) |
|
|
||||
6. Анод при электролизе |
|
6. Катод при электролизе |
||||||
|
|
|
|
|
|
|
|
7. Органические вещества (спирты, |
|
|
|
|
|
|
|
|
альдегиды, амины, муравьиная и ща- |
|
|
|
|
|
|
|
|
велевая кислоты, глюкоза) |
Вещества, содержащие элементы в промежуточной степени окисления, могут быть как окислителями, так и восстановителями (H2O2, SO2, HNO2 и др.)
Обучающая задача 1
Расставить коэффициенты, используя метод электронного баланса в следующей реакции:
HClO3 + P → H3PO4 + HCl
Решение:
1. В уравнении реакции определяем элементы, изменяющие степень окисления:
5 0 5 1
H Сl O3 + P → H3 P O4 + H Cl
2. Записываем полуреакции окисления и восстановления, определяем
число отданных восстановителем |
и принятых окислителем электронов, нахо- |
|||||
дим дополнительным множители и сбалансируем заряды. |
||||||
|
0 |
|
|
5 |
|
|
Окисление, восстановитель |
P – 5 е |
= P |
6 |
|||
|
5 |
|
|
|
1 |
|
Восстановление, окислитель |
Сl + 6 е = Cl |
5 |
||||

35
3. Суммируем полуреакции в полное уравнение, находим коэффициенты при окислители, восстановителе и других реагирующих веществах.
5HClO3 + 6P = 6H3PO4 + 5HCl
Обучающая задача 2
Используя ионно-электронный метод, расставить коэффициенты в реакции, схема которой приведена ниже:
H2S + KMnO4 + H2SO4 S + MnSO4 + K2SO4 + H2O
Решение:
1. Находим окислитель и восстановитель, определяем, какие ионы существуют
H2S S0 + 2H+; MnO 4 Mn+2
2. Записываем полуреакции окисления и восстановления, определяем число отданных восстановителем и принятых окислителем электронов, находим дополнительным множители. Чтобы сбалансировать заряды записываем в полуреакции восстановления ионы водорода Н+, которые связывают кислород с образованием воды
Окисление |
H2S – 2 |
|
= S0 + 2H+ |
|
5 |
|||
е |
|
|||||||
Восстановление |
MnO 4 + 8Н+ + 5 |
|
= Mn+2 + 4Н2О |
|
2 |
|||
е |
|
|||||||
3. |
Суммируем полуреакции в полное уравнение |
|
|
|||||
|
5H2S + 2MnO 4 + 16H+ = 5S + 10H+ + 2Mn+2 + 8H2O |
|||||||
4. |
Электроны сокращаем (на 10Н+) |
|
|
|||||
|
5H2S + 2MnO 4 + 6H+ = 5S + 2Mn+2 + 8H2O |
|||||||
5. Записываем уравнения в ионно-молекулярной и молекулярной формах
5H2S + 2MnO 4 + 6H+ + 2K+ + 3SO 42 = 5S + 2Mn+2 + 8H2O + 2K+ + 3SO 42
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
Задания для самоподготовки:
Расставить коэффициенты в окислительно-восстановительных реакциях, используя метод электронного баланса или ионно-электронный метод, указать окислитель и восстановитель; определить тип окислительно-восстановительной реакции.
1. H2 + Na |
NaH |
|
KI + H2O2 + H2SO4 I2 + K2SO4 + H2O |
||
2. CuO + H2 |
Cu + H2O |
|
H2O + KMnO4 + H2SO4 O2 + K2SO4 + MnSO4 + H2O |
||
3. NaH + H2O |
NaOH + H2 |
|
KMnO4 + HCl |
MnCl2 + Cl2 + KCl + H2O |
|
4. Ca + H2 |
CaH2 |
|
FeCl3 + H2S |
S + FeCl2 + HCl |
|
|
|
|
|
|
|
36 |
5. NaH + H2O |
|
NaOH + H– |
||||
K2SO3 + KMnO4 + KOH K2MnO4 + K2SO4 + H2O |
||||||
6. LiH + HCl |
|
LiCl + H2 |
||||
K2Cr2O7 + HCl |
Cl2 + KCl + CrCl3 + 7H2O |
|||||
7. H2O2 |
|
H2O + O2 |
|
|||
Cr + HCl + O2 |
CrCl3 + H2O |
|||||
8. MnO2 + HCl |
|
MnCl2 + Cl2 + H2 |
||||
HI + HClO |
|
I2 + HCl + H2O |
||||
9. Cl2 + HCl |
t |
Br2 + HCl |
||||
|
||||||
KMnO4 |
K2MnO4 + MnO2 + O2 |
|||||
10. KI + O3 + H2O |
I2 + O2 + KOH |
|||||
Ag + H2SO4к Ag2SO4 + SO2 + H2O |
||||||
11. MnO2 + HBr |
MnBr2 + H2O |
|||||
KCl |
t |
KCl + O2 |
|
|||
|
|
|||||
12. MnO2 + KI + H2SO4 |
I2 + K2SO4 + MnSO4 + H2O |
|||||
H2S + H2SO4к |
S + SO2 + H2O |
|||||
13. F2 + H2O |
|
HF + O2 |
|
|||
Fe + H2SO4к |
|
t |
Fe2(SO4)3 + SO2 + H2O |
|||
|
|
|||||
14. Cl2 + H2O |
|
HCl + HClO |
||||
K2Cr2O7 |
t |
|
K2CrO4 + Cr2O3 + O2 |
|||
|
|
|||||
15. Cl2 + KOH |
|
KCl + KClO + H2O |
||||
Cu + HNO3к Cu(NO3)2 + NO2 + H2O |
||||||
16. H2S + FeCl3 |
|
FeCl2 + S + HCl |
||||
Cl2 + KOH |
|
t |
KCl + KClO3 + H2O |
|||
|
|
|||||
17. LiH + O2 |
|
Li2O + H2O |
||||
HNO2 + HI |
|
I2 + NO + H2O |
||||
18. PH3 + O2 |
|
P2O5 + H2O |
||||
KMnO4 + HCl |
KCl + MnCl2 + Cl2 + H2O |
|||||
19. Zn + NaOH + H2O |
Na2[Zn(OH)4] + H2 |
|||||
HBr + K2Cr2O7 |
KBr + CrBr3 + Br2 + H2O |
|||||
20. P + Cl2 |
PCl3 |
|
|
|||
K2Cr2O7 + HCl |
Cl2 + KCl + CrCl3 + H2O |
|||||
21. Br + H2S |
|
S + HBr |
|
|||
HI + Fe2(SO4)3 |
I2 + FeSO4 + H2SO4 |
|||||
22. V2O5 + H2 |
|
V2O3 + H2O |
||||
Na2SO3 + H2SO4 |
Na2SO4 + SO2 + H2O |
|||||
23. I2 + SO2 + H2O |
H2SO4 + HI |
|||||
Fe + HNO3к |
|
t |
Fe(NO3)3 + NO2 + H2O |
|||
|
|
|||||
24. P + I2 + H2O |
|
H3PO3 + HI |
||||
Fe(OH)2 + O2 + H2O |
Fe(OH)3 |
|||||

37
25. FeS2 + O2 |
Fe2O3 + SO2 |
HBr + H2SO4к |
Br2 + SO2 + H2O |
26.Составьте схему электролиза расплава хлорида магния и вычислите объем хлора, выделившегося при н.у. из соли масса 19,0 г.
27.При электролизе расплава хлорида калия выделилось 22,4 л хлора (н.у.). Какое количество соли подверглось электролизу
28.Какие вещества выделяются на электродах при электролизе раствора соли AgNO3. Составьте схему электролиза.
29.Вычислите объем газа, выделившийся при электролизе раствора сульфата меди (II), если при этом на катоде образовалась 16,0 г меди.
30.Какое вещество будет содержаться в растворе по окончании электролиза раствора KCl?
31.Вычислите массу серебра, выделившуюся при пропускании через раствор нитрата серебра тока в 8 А в течении 15 мин.
7. ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Первый закон термодинамики
U = U2 – U1 = Q – A,
где U – изменение внутренней энергии системы при переходе ее из состояния 1 в состояние 2; Q – теплота, полученная системой при переходе; А – работа, совершенная системой.
Энтальпия
H = U + PV,
где Р – давление; V – объем.
Тепловой эффект химической реакции (при постоянном давлении) или изме-
нение энтальпии – количество теплоты выделившееся или поглощенное системой при протекании в ней химической реакции (Q = -∆H).
Закон Гесса: тепловой эффект химической реакции не зависит от пути протекания реакции, а определяется только состоянием исходных веществ и продуктом реакции.
Следствие Закона Гесса: тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и сумм теплот образования исходных веществ с учетом стехиометрических коэффициентов
aA + bB → cC + dD
Ho c Ho обрС d Ho обрD (a Ho обрA b Ho обрВ) ,
где ∆H 0обр – изменение энтальпии при стандартных условиях.
Стандартное состояние – состояние вещества при давлении 101 кПа (1 атм, 760 мм. рт. ст.) и T = 298 К (25 0С).

38
Если < 0, теплота выделяется, и реакция экзотермическая. Если > 0, теплота поглощается, и реакция эндотермическая.
Обучающая задача 1
Вычислите по термохимическому уравнению количество теплоты, выделяемой при сгорании 1 кг серы:
S + O2 = SO2 + 297 кДж
Решение:
Данное термохимическое уравнение показывает, что при сгорании 1 моль серы (32 г) выделяется 297 кДж теплоты. Учитывая это записываем:
при сгорании 32 г серы выделяется 297 кДж при сгорании 1 000 г выделяется х к.Дж
32 : 1000= 297 : х; х = |
1000 297 |
9281; х = 9281 кДж |
||
|
32 |
|
||
|
|
|
||
Ответ: при сгорании 1 кг серы выделяется 9281 кДж теплоты.
Обучающая задача 2
По термохимическому уравнению С + О2 = СО2 + 402,24 кДж
вычислите, сколько сгорело угля, если при реакции выделилось 33 520 кДж теплоты.
Решение:
Данное термохимическое уравнение показывает, что при сгорании 1 моль угля, т.е. 12 г, выделяется 402, 24 кДж теплоты.
Учитывая это, записываем:
если выделилось 402,24 кДж, то сгорело 12 г угля, если выделилось 33 520 кДж, то сгорело х г угля
402,24 : 33 520 = 12 : х; х = |
33520 12 |
1000; |
|
402,24 |
|||
|
|
х = 1 000 г
Ответ: 33 520 кДж теплоты выделяется при сгорании 1 кг угля.
Задания для самоподготовки:
1.При соединении 4,2 г железа с серой выделилось 7,15 кДж теплоты. Составьте термохимическое уравнение этой реакции.
2.При взаимодействии 1,8 г алюминия с кислородом выделилось 54,7 кДж теплоты. Вычислите теплоту образования оксида алюминия. Составьте термохимическое уравнение этой реакции.
3.При полном сжигании 42 л метана (н.у.) выделилось 1 674 кДж теплоты. Составьте термохимическое уравнение реакции горения метана.
4.По термохимическому уравнению реакции
СО + 2Н2 СН3ОН + 109 кДж
39
вычислите количество выделившейся теплоты при образовании 6,4 г метанола?
5. По термохимическому уравнению реакции
С2Н4 + Н2О С2Н5ОН + 46 кДж вычислите объем взятого этилена (н.у.), если известно, что выделенная в
этом процессе теплота составила 184 кДж.
6. Термохимическое уравнение реакции горения фосфора:
4Р + 5О2 = 2Р2О5 + 3 010 кДж.
Сколько теплоты выделится при сгорании 62 г фосфора?
7. По термохимическому уравнению реакции горения этилена
С2Н4 + 3О2 = 2СО2 + 2Н2О + 1 400 кДж рассчитайте, сколько выделится теплоты, если в реакцию вступило 5,6 л
этилена (н.у.).
8. По термохимическому уравнению реакции горения ацетилена
2С2Н2 + 5О2 = 4СО2 + 2Н2О + 2 610 кДж рассчитайте, сколько выделится теплоты, если в реакцию вступило:
а) 1 моль ацетилена; б) 5,2 г ацетилена; в) 67,2 л ацетилена (н.у.). 9. По термохимическому уравнению реакции горения спирта
С2Н2ОН + 3О2 = 2СО2 + 3Н2О + 1 374 кДж вычислите, сколько выделится теплоты и какое количество вещества кисло-
рода вступило в реакцию, если сгорело 3 моль спирта.
10. По термохимическому уравнению реакции горения метана
СН4 + 2О2 = СО2 + 2Н2О + 803 кДж рассчитайте, какое количество теплоты выделится при сгорании 5 м3 метана
(н.у.) и какое количество вещества кислорода потребуется на это горение. 11. По термохимическому уравнению
2Н2О = 2Н2 + О2 – 571 кДж рассчитайте количество теплоты, поглощенной при образовании 2,24 л во-
дорода (н.у.).
12.При сжигании 2 моль фосфора выделяется 1 504 кДж теплоты. Составьте термохимическое уравнение реакции горения фосфора.
13.Возобновление кислорода в атмосферу осуществляется реакцией фотосинтеза:
6СО2 + 6Н2О = С6Н12О6 + 6О2 – 2 815,8 кДж.
Рассчитайте количество вещества оксида углерода (IV) и количество поглощенной теплоты при образовании 7,2 кг глюкозы.
14. По термохимическому уравнению горения водорода
2Н2 + О2 = 2Н2О + 484 кДж рассчитайте объем водорода (н.у.) и количество вещества воды, если в ре-
зультате реакции выделилось 24,2 кДж теплоты. 15. Используя термохимическое уравнение реакции
CuO + H2 = Cu + H2O + 80 кДж,
рассчитайте количество теплоты, выделяющейся при восстановлении: а) 5 моль оксида меди (II); б) 1,6 г оксида меди (II).
40
16. В промышленности водород получают по уравнению:
CH4 + 2H2O = CO2 + 4H2 – 165 кДж.
Каков расход воды (в г), метана (в л) и теплоты при получении 250 м3 водорода (н.у.).
17.Составьте термохимическое уравнение реакции горения метилового спирта, при сжигании 0,8 г которого выделилось 18,2 кДж теплоты.
18.По термохимическому уравнению реакции
2Al + FeO3 = Al2O3 + 2Fe + 848 кДж
рассчитайте, сколько выделится теплоты при вступлении в реакцию: а) 10,8 г алюминия; б) 0,2 моль оксида железа (III).
19. По термохимическому уравнению реакции
2H2S + 3O2 = 2SO2 + 2H2O + 857,3 кДж
вычислите, какое количество теплоты образуется при сжигании: а) 3 моль
Н2S; б) 17 г Н2S; в) 2,24 л Н2S.
20. По термохимическому уравнению реакции
2Al + 3Cl2 = 2AlCl3 + 1 394,8 кДж
вычислите, какое количество теплоты выделилось при взаимодействии с алюминием: а) 1 моль Cl2; б) 4,48 л Cl2; в) 7,1 г Cl2.
21. По термохимическому уравнению реакции
2Na + Cl2 = 2NaCl + 819 кДж
вычислите объем (н.у.) и количество вещества хлора, вступившего в реакцию, если известно, что выделилось 81,90 кДж теплоты.
22. По термохимическому уравнению реакции
Fe + S = FeS + 95,4 кДж
вычислите количество теплоты, образуемое при окислении 11,2 г железа, и количество вещества сульфида железа (II), полученного при этом.
23.Составьте термохимическое уравнение реакции, если известно, что при сгорании 6 г водорода в кислороде выделяется 858 кДж теплоты. Вычислите, какое количество вещества воды выделилось при этом.
24.Составьте термохимическое уравнение реакции, если известно, что при взаимодействии 14 г железа с серой выделилось 24,3 кДж теплоты.
25.По термохимическому уравнению реакции
3Fe + O2 = Fe3O4 + 1 116 кДж
вычислите количество теплоты, выделившееся при сжигании 1 кг железа, содержащего 6 % примеси.
6.СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Скорость химической реакции (v) – показывает изменение количества реагирующих веществ в единице реакционного пространства в единицу времени. Для гомогенной (однородной) системы скорость химической реакции характеризуется измерением концентрации реагирующих веществ в единицу времени в

41
единице объема. Для гетерогенной системы скорость химической реакции характеризуется изменение количества вещества на границе раздела фаз.
v = |
С2 |
С1 |
|
C |
, |
t2 |
t1 |
|
t |
где v – средняя скорость химической реакции за время t,
С2 и С1 – концентрации вещества в моменты времени t2 и t1.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ РЕАКЦИИ
Природа реагирующих веществ
Условия протекания реакций
|
концентрация |
|
Температура |
|
присутствие |
|
|
(С) |
|
(Т) |
|
катализатора |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
давление |
|
измельчение |
|
радиоактивное |
|
|
(для газовых |
|
(для твердых |
|
излучение |
|
|
|
|
|
|||
|
|
|
|
|||
|
реакций) |
|
веществ) |
|
|
|
Основной закон химической кинетики (закон действия масс): скорость хими-
ческой реакции пропорциональна произведению концентрации реагирующих веществ в степенях их стехиометрических коэффициентах.
аА + bВ = cС + dD v = k C аА C bB ,
где v – скорость химической реакции, моль/(л-с), CA и CВ – концентрации веществ А и В, моль/л, k – константа скорости реакции
Правило Ван-Гоффа: при повышении температуры на каждые 10 0 скорость большинства реакций увеличивается в 2-4 раза.
v2 |
|
t2 t1 |
|
|
γ |
10 , |
|||
v1 |
||||
|
|
|
||
где v t1 , v t2 – скорость реакции соответственно при t1 – начальной температуре, t2 – конечной температуре, γ – температурный коэффициент скорости реакции.
42
КАТАЛИЗ И КАТАЛИЗАТОРЫ
Катализаторами называются вещества, изменяющие скорость химических реакций
Отрицательный катализ (ингибирование) – катализатор (ингиби-
тор) замедляет реакцию
Положительный катализ – катализатор ускоряет реакцию
Гомогенный катализ –
реагирующие веществ и катализатор образуют однофазную систему.
Например:
2SO2(г) + O2(г) |
NO(г) |
2SO3(г) |
|
Гетерогенный катализ –
реагирующие вещества и катализатор образуют систему из разных фаз.
Например:
C6H6(ж) + Cl2(г) |
Fe(тв) |
|
|
C6H5Cl(ж) + HCl(г) |
|
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Кинетическое условие равновесия
скорости прямой и обратной ре-
акции равны ( V V )
K= [C]c  [D]d [A]a
[D]d [A]a  [B]b
[B]b
Факторы, влияющие на смещение равновесия
Концентрация |
Тем- |
Давление (для |
реагирующих |
пера- |
газообразных |
веществ |
тура |
веществ) |
|
|
|
Катализатор на смещение равновесия влияния не оказывает
Принцип Ле-Шателье или принцип подвижного равновесия
если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие (изменяется концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие.

43
Обучающая задача 1
Написать выражения закона действия масс для реакций
а) 2NO(г) + Cl2(г) 2NOCl(г)
б) CaCO3(к) CaO(к) + CO2(г)
Решение:
Используя закон действующих масс, записываем выражение для скоростей прямой реакции
а) v = k [NO]2[Cl2]
б) Поскольку карбонат кальция – твердое вещество, концентрация которого не изменяется в ходе реакции, то выражение для скорости прямой реакции будет иметь вид: v = k, т.е. в данном случае скорость реакции при определенной температуре постоянна.
Обучающая задача 2
Как изменится скорость реакции
2NO(г) + O2(г) = 2NO2(г),
если уменьшить объем реакционного сосуда в 3 раза?
Решение:
До изменения объема скорость реакции выражалась уравнением
v = k [NO]2[O2]
Вследствие уменьшения объема концентрация каждого из реагирующих веществ возрастет в 3 раза. Следовательно, выражение скорости реакции будет иметь вид
v/ = k(3[NO])2(3[O2]) = 27k [NO]2[O2]
Ответ: скорость прямой реакции увеличится в 27 раз.
Обучающая задача 3
Температурный коэффициент скорости реакции равен 2. Во сколько раз возрастет скорость реакции при повышении температуры от 20 до 50 0С?
Решение:
Обозначим скорости при 20 0С и 50 0С соответственно через v1 и v2; t2-t1 = = 70 – 20 = 50. Используя правило Вант-Гоффа
v2 |
|
t2 t1 |
50 |
|
γ 10 |
210 = 25 = 32. |
|||
v1 |
||||
|
|
|
||
Ответ: скорость реакции увеличится в 32 раза.
Обучающая задача 4
Какое влияние на смещение равновесия в системе
4HCl(г) + O2(г) 2Cl2(г) + 2H2O(г), 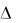 0 = -116,4 кДж
0 = -116,4 кДж
окажут: а) увеличение давления; б) повышение температуры; в) введение катализатора.

44
Решение:
Так как все вещества в системе – газы, то в соответствии с принципом ЛеШателье повышение давления приводит к смещению равновесия в сторону реакции, сопровождающейся уменьшением количества вещества газа, т. е. в сторону образования Cl2 и H2O.
Поскольку прямая реакция экзотермическая, то повышение температуры будет способствовать протеканию процесса с поглощением температуры, т.е. равновесие сместится в сторону протекания эндотермической реакции – образования HCl и О2.
Катализатор в одинаковой степени ускоряет прямую и обратную реакции, поэтому в его присутствии равновесные количества веществ не изменятся, что не влияет на смещение химического равновесия.
Задания для самоподготовки: |
|
|
1. |
Как изменится скорость реакции |
|
|
2NO(г) + O2(г) |
2NO2(г), |
|
если объем реакционного сосуда уменьшить в 4 раза? |
|
2. |
Как изменится скорость реакции |
|
|
N2(г) + 3H2(г) |
2HN3(г), |
|
если увеличить давление в системе в 2 раза? |
|
3. |
Как изменится скорость реакции |
|
|
С(тв) + О2(г) = СО2(г), |
|
|
если увеличить концентрацию кислорода в 5 раз? |
|
4. |
Как изменится скорость реакции |
|
|
4Fe(к) + 3O2(г) = 2Fe2O3(к), |
|
|
если уменьшить концентрацию кислорода в 2 раза? |
|
5. |
Как изменится скорость реакции |
|
|
2SO2(г) + O2(г) 2SO3(г), если уменьшить давление в 3 раза? |
|
6. |
Как изменится скорость реакции |
|
Н2(г) + Сl2(г) = 2HCl(г),
если уменьшить объем реакционного сосуда в 2 раза?
7.На сколько градусов надо увеличить температуру, чтобы скорость реакции возросла в 27 раз? Температурный коэффициент скорости реакции равен 3.
8.Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 0С скорость реакции возрастает в 8 раз?
9.Температурный коэффициент скорости некоторой реакции равен 4. Во
сколько раз увеличиться скорость этой реакции, если повысить температуру на 20 0С?
10.На сколько градусов нужно уменьшить температуру, чтобы скорость реакции уменьшилась в 4 раза? Температурный коэффициент скорости реакции равен 2.
11.Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 50 0С скорость реакции возрастет в 32 раз?

45
12. Температурный коэффициент скорости некоторой реакции равен 3. Во
сколько раз уменьшиться скорость этой реакции, если понизить температуру на 20 0С?
13. Как повлияет уменьшение температуры на равновесие в следующих системах:
|
a) A + B = 2C, |
> 0; |
|
|
|
б) A + B = 2C, |
< 0. |
||
14. |
Как надо изменить температуру и давление, чтобы равновесие в реакции |
||||||||
|
сместилось в сторону продуктов разложения |
|
|
|
|||||
|
CaCO3(г) |
CaO(г) + CO2(г), |
= 178 кДж. |
|
|||||
15. |
Как повлияет уменьшение давления на равновесие в реакциях: |
|
|||||||
|
|
|
а) N2O4 |
2NO2; |
|
|
|||
|
|
|
б) 2NO + O2 |
|
2NО2; |
|
|
||
|
в) 3Fe2O3(к) + CO(г) |
2Fe3O4(к) + CO2(г)? |
|
||||||
16. |
В каком направлении сместится равновесие |
|
|
|
|||||
|
2CO(г) + O2(г) |
2CO2(г); |
|
0 = -566 кДж: |
|
||||
а) при понижении температуры; б) при повышении давления? |
|
||||||||
17. |
В каком направлении сместится равновесие |
|
|
|
|||||
|
N2(г) + O2(г) |
2NO(г); |
|
0 = 180 кДж |
|
||||
а) понижение температуры; б) повышение давления? |
|
||||||||
18. |
Как повлияет на равновесие следующей реакции |
|
|
||||||
|
2Н2(г) + О2(г) |
2Н2О |
|
0 = -483,6 кДж: |
|
||||
а) понижение температуры; б) повышение давления? |
|
||||||||
19. |
Как повлияет на равновесие следующей реакции |
|
|
||||||
|
СaCO3(к) |
CaO(к) + CO2(г) |
0 = 179 кДж: |
|
|||||
а) при понижении температуры; б) при повышении давления? |
|
||||||||
20. |
Указать, какими изменениями концентраций реагирующих веществ можно |
||||||||
|
сместить вправо равновесие реакции |
|
|
|
|
|
|||
|
|
СО2(г) + С(графит) |
|
2СО(г). |
|
|
|||
21. |
Во сколько раз увеличиться скорость реакции горения аммиака |
|
|||||||
|
|
4NH3(г) + 3O2 = 2N2 + 6H2О(ж) |
|
|
|||||
при увеличении давления в 2 раза? |
|
|
|
|
|
||||
22. |
Как изменится скорость гетерогенной реакции |
|
|
||||||
|
C2H5OH(ж) + 3O2(г) = 2CO2(г) + 3H2O(ж) |
|
|||||||
при увеличении давления в 3 раза? |
|
|
|
|
|
||||
23. |
В каком направлении произойдет смещение равновесия системы |
||||||||
|
СО(г) + Н2О СО2(г) + Н2(г), |
> 0, |
|
||||||
если: а) повысить давление; б) понизить температуру. |
|
||||||||
24. |
В каком направлении произойдет смещение равновесия при понижении |
||||||||
|
давления в системах: |
|
|
|
|
|
|
|
|
|
|
|
а) N2 + 3H2 |
|
2NH3 |
|
|
||
|
|
|
б) 2SO2 + O2 |
|
2SO3 |
|
|
||
25. |
В каком направлении произойдет смещение равновесия при увеличении |
||||||||
давления в системах:
