
- •И.А. Жарская
- •Н.Л. Мара
- •Химия
- •Хабаровск 2003
- •Министерство образования Российской Федерации
- •Хабаровская государственная академия экономики и права
- •Кафедра естественнонаучных дисциплин
- •Химия
- •Часть 1
- •Хабаровск 2003
- •Химия. Часть 1. Общая химия: Пособие для абитуриентов и учащихся школы «Юный товаровед-эксперт» очной и заочной форм обучения. / И.А. Жарская, Н.Л. Мара. – Хабаровск: РИЦ ХГАЭП, 2003. – с.
- •Редактор Г.С. Одинцова
- •Уч.-изд. _____. Тираж_______экз. Заказ №_____
- •680042, Хабаровск. ул. Тихоокеанская, 134, ХГАЭП, РИЦ
- •Обучающая задача 2
- •Решение:
- •Из закона Авогадро следует, что при одном и том же давление и одинаковых температурах масса (m) равных объемов газов относится как их молярные массы (М).
- •Состояние электрона в атоме
- •Форма и ориентация электронных орбиталей
- •Обучающая задача 1
- •Электронные
- •ХИМИЧЕСКАЯ СВЯЗЬ
- •ковалентная
- •связь
- •CuOHCl
- •основные
- •Способы выражения состава раствора
- •Важнейшие индикаторы
- •Твердый
- •Жидкий
- •Разбавленный
- •Написать уравнение диссоциации следующих электролитов
- •Тест 1
- •Тест 2
- •ТЕМА 2. СТРОЕНИЕ АТОМОВ
- •Тест 1
- •Тест 4
- •Тест 5
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 1
- •Кислоты
- •Тест 1
- •Соли
- •Тест 1
- •Комбинированные тестовые задания
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 2
- •Тест 3
82
Комбинированные тестовые задания
по основным классам неорганических соединений
Тест 1
1.Какой элемент образует основные, амфотерные и кислотные оксиды? а) алюминий б) барий в) сера г) хром
2.Какие из оксидов, формулы которых приведены ниже, реагируют со щелочами?
а) Р2О3
б) Fe2O3 в) Al2O3 г) ZnO
3.Какова степень окисления цинка в цинкат-ионе (ZnO 22 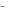 )?
)?
а) +4 б) +3 в) +1
г) +2
4.Укажите названия веществ, которые реагируют и с кислотами и со щелочами: а) оксид Al
б) оксид Ca
в) гидроксид Mg г) гидроксид Zn
5.Какое соединение не реагирует с разбавленным раствором гидроксида натрия? а) уксусная кислота
б) оксид азота (III) в) оксид алюминия г) оксид железа (II)
6.Укажите формулу амфотерного оксида: а) СаО
б) СО2
в) CrO3 г) Cr2O3
83
7.Укажите формулы соединений, не взаимодействующих со щелочами: а) СаО
б) Al(OH)3 в) Cr(OH)3 г) Mg(OH)2
8.Какие из соединений, формулы которых приведены ниже, реагируют с гидроксидом калия?
а) Mg(OH)2 б) Cr(OH)3 в) Zn(OH)2 г) Fe(OH)3
9.С какими из перечисленных веществ реагирует оксид алюминия? а) вода б) хлорид натрия
в) гидроксид бария г) серная кислота
10.Укажите формулы веществ, с которыми реагирует гидроксид цинка: а) КОН
б) Na2O (при нагревании)
в) Н2SO4
г) KCl
Тест 2
1.Какой реактив не осаждает ионы Ва2+ из водного раствора? а) карбонат калия б) карбонат натрия в) сульфат натрия г) нитрат лития
2.После растворения в воде по 0,5 моль трех солей раствор содержит 0,5 моль ионов Mg2+, 1,5 моль ионов Na+, 1,5 моль ионов Cl- и 0,5 моль ионов SO 24 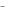 . В каком ряду приведены формулы солей, удовлетворяющих этим данным?
. В каком ряду приведены формулы солей, удовлетворяющих этим данным?
а) MgSO4, Na2SO4, NaCl б) MgCl2, MgSO4, Na2SO4 в) MgCl2, NaCl, Na2SO4
3.Концентрация каких ионов (укажите их формулы) максимальна в растворе
сульфата железа (II)?
а) Fe2+
84
б) SO 24 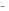
в) H+
г) FeOH+
4.Какие частицы (укажите их формулы) находятся в разбавленном водном
растворе хлорида меди (II)?
а) Cu2+
б) HCl
в) CuOH+ г) CuCl2
5.Укажите схему реакции, в которой ортофосфорная кислота выступает как двухосновная:
а) NH3 + H3PO4 → NH4H2PO4
б) KOH + H3PO4 → K3PO4 + H2O в) KOH + H3PO4 → KH2PO4 + H2O г) KOH + H3PO4 → K2HPO4 + H2O
6.В растворе некоторой соли содержится 1 моль катионов металла и 106,5 г ионов Cl-. Укажите формулу соли (гидролиз не учитывайте):
а) NaCl
б) CaCl2 в) AlCl3
г) CuOHCl
7.В растворе соли количество вещества анионов в 1,5 раза больше количества вещества катионов. Укажите формулу соли (гидролиз не учитывайте):
а) FeCl3 б) CuSO4
в) Fe2(SO4)3 г) K2CO3
8.Какие пары веществ не могут совместно находиться в растворе? а) тетрагидроксаолюминат калия и соляная кислота б) тетрагидроксоцинкат натрия и гидроксид натрия
в) хлорид гироксожелеза (II) и соляная кислота г) нитрат гидроксоалюминия и гидроксид натрия
9.С учетом гидролиза отметьте формулы солей, в водных растворах которых число катионов металла в точности равно числу анионов кислотного остатка:
а) NaCl
б) CH3COONa в) KNO3
г) CuSO4
85
10.Пренебрегая гидролизом, укажите, для каких солей в водном растворе число катионов металла в 1,5 раза меньше числа анионов:
а) сульфат алюминия б) сульфат железа (II) в) сульфат хрома (III) г) сульфат натрия
Комбинированные задания по теоретических основам химии
Тест 1
1.Укажите число нейтронов в ионе Zn2+ одного из изотопов цинка с массовым числом 70:
а) 32 б) 36 в) 38 г) 40
2.Число неспаренных электронов на d-орбиталях в атомах хрома в основном состоянии равно:
а) 6 б) 5 в) 4 г) 3
3.Радиус атома какого элемента наибольший? а) бериллия б) бора в) магния
г) алюминия
4.Масса молекулы фосфора при некоторых условиях равна 1,03 ∙ 10-22 г. сколько атомов фосфора входит в состав его молекулы при этих условиях?
а) 2 б) 4 в) 1 г) 3
5.Укажите схемы процессов, на смещение равновесия которых не влияет изменение давления:
а) CaO(к) + СО2(г) ↔ СаСО3(к)
б) 2NO(г) ↔ N2(г) + О2(г)
в) ZnO(к) + Н2(г) ↔ Zn(к) + Н2О(г)
86
г) Са(к) + Н2(г) ↔ СаН2(к)
6. Сумма стехиометрических коэффициентов в ОВР, протекающей по схеме
S + HNO3 → H2SO4 + NO2 + H2O,
равна:
а) 14 б) 16 в) 18
г) 20
7.Какой процесс протекает при аноде при электролизе расплава гидроксида
натрия?
а) Na+ + е → Na0
б) 2H2O - 4е → O2 + 4H+ в) 2OH- - 2е → O2 + H2
г) 4OH- - 4е → O2 + 2H2O
8.Укажите электронную конфигурацию атома изотопа водорода с массовым
числом, равным 3:
а) 1s2
б) 1s22s1 в) 1s1
г) 1s22s2
9.Укажите схемы реакций, которые не протекают в водном растворе:
а) KHS + H2S → б) CuSO4 + Fe → в) AgNO3 + KCl →
г) K2S + NaOH →
10.При электролизе расплава хлорида калия (выход по току составил 100%) выделилось 22,4 л хлора (н.у.). Какая масса соли подверглась электролизу
(г)?
а) 37,25 б) 74,50 в) 149,00 г) 111,75
