
- •И.А. Жарская
- •Н.Л. Мара
- •Химия
- •Хабаровск 2003
- •Министерство образования Российской Федерации
- •Хабаровская государственная академия экономики и права
- •Кафедра естественнонаучных дисциплин
- •Химия
- •Часть 1
- •Хабаровск 2003
- •Химия. Часть 1. Общая химия: Пособие для абитуриентов и учащихся школы «Юный товаровед-эксперт» очной и заочной форм обучения. / И.А. Жарская, Н.Л. Мара. – Хабаровск: РИЦ ХГАЭП, 2003. – с.
- •Редактор Г.С. Одинцова
- •Уч.-изд. _____. Тираж_______экз. Заказ №_____
- •680042, Хабаровск. ул. Тихоокеанская, 134, ХГАЭП, РИЦ
- •Обучающая задача 2
- •Решение:
- •Из закона Авогадро следует, что при одном и том же давление и одинаковых температурах масса (m) равных объемов газов относится как их молярные массы (М).
- •Состояние электрона в атоме
- •Форма и ориентация электронных орбиталей
- •Обучающая задача 1
- •Электронные
- •ХИМИЧЕСКАЯ СВЯЗЬ
- •ковалентная
- •связь
- •CuOHCl
- •основные
- •Способы выражения состава раствора
- •Важнейшие индикаторы
- •Твердый
- •Жидкий
- •Разбавленный
- •Написать уравнение диссоциации следующих электролитов
- •Тест 1
- •Тест 2
- •ТЕМА 2. СТРОЕНИЕ АТОМОВ
- •Тест 1
- •Тест 4
- •Тест 5
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 1
- •Кислоты
- •Тест 1
- •Соли
- •Тест 1
- •Комбинированные тестовые задания
- •Тест 1
- •Тест 2
- •Тест 1
- •Тест 2
- •Тест 3
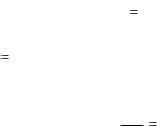
10
Обучающая задача 2
Плотность газа по воздуху равна 1,17. Определить молекулярную массу газа.
Решение:
Из закона Авогадро следует, что при одном и том же давление и одинаковых температурах масса (m) равных объемов газов относится как их молярные массы (М).
|
|
|
m1 |
|
M1 |
|
|
|
|
|
m2 |
|
M2 |
||
Так как отношение |
m1 |
D – относительная плотность первого газа по второму, |
|||||
m2 |
|||||||
|
|
|
|
|
|
||
следовательно, по условию задачи:
D =
M1 1,17
M 2
Тогда М 1= D ∙ М2 , где М2 – средняя молярная масса воздуха.
М2 = 29 г/моль М1 = 1,17 ∙ 29 = 33,9 (г/моль)
Ответ: Мгаза = 33,9 г/моль.
Обучающая задача 3
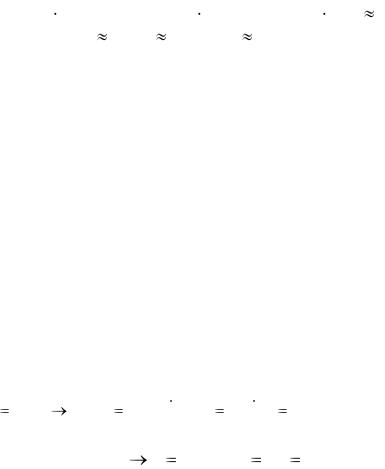
Определить эквивалентность, число эквивалентности, молярную массу эквивалента, количество эквивалентов вещества H2SO4 массой 196 г в следующих реакциях:
а) H2SO4 + KOH = KHSO4 + H2O
б) H2SO4 + 2KOH = K2SO4 + 2H2O
в) 4H2SO4(конц) + 3Zn = 3ZnSO4 + S + 4H2O
Решение:
Определение эквивалентных чисел и эквивалентов веществ неодинаково для обменных и окислительно-восстановительных реакций. В кислотноосновных и обменных реакциях эквивалент и эквивалентное число определяется стехиометрией реакции.
В окислительно-восстановительных реакциях эквиваленты и эквивалентные числа для окислителя и восстановителя определяются по числу электронов, которое принимает одна формульная единица окислителя или отдает одна формульная единица восстановителя.
Первые две реакции являются обменными, кислотно-основными.
а) H2SO4 + KOH = KHSO4 + H2O
в этой реакции на одну формульную единицу Н2SO4 требуется одна формульная единица KOH, следовательно,
Э(Н2SO4) = 1; Z(Н2SO4) = 1;
Mэ(Н2SO4) = М(Н2SO4)  1/Э = М(Н2SO4)
1/Э = М(Н2SO4)  Z = 98 г/моль
Z = 98 г/моль  1 = 98 г/моль. nэ(Н2SO4) = m/Mэ = 196/98 = 2 моль
1 = 98 г/моль. nэ(Н2SO4) = m/Mэ = 196/98 = 2 моль
11
б) H2SO4 + 2KOH = K2SO4 + 2H2O
в этой реакции на одну формульную единицу Н2SO4 требуется две формульных единицы KOH, следовательно,
Э(Н2SO4) = ½; Z(Н2SO4) = 2;
Mэ(Н2SO4) = М(Н2SO4)  1/Э = М(Н2SO4)
1/Э = М(Н2SO4)  Z = 98 г/моль
Z = 98 г/моль  1/2 = 49 г/моль. nэ(Н2SO4) = m/Mэ = 196/49 = 4 моль.
1/2 = 49 г/моль. nэ(Н2SO4) = m/Mэ = 196/49 = 4 моль.
в) 4H2SO4к + 3Zn = 3ZnSO4 + S + 4H2O
данная реакция является окислительно-восстановительной
окислитель |
S+6 + 6 |
|
|
|
= S0 |
восстановление |
е |
||||||
восстановитель |
Zn0 - 2 |
|
= |
окисление |
||
е |
||||||
Э(Н2SO4) = 1/6; Z(Н2SO4) = 6;
Mэ(Н2SO4) = М(Н2SO4) 1/Э = М(Н2SO4) Z = |
98 г/моль 1/6 16,3 г/моль. |
nэ(Н2SO4) m/Mэ 196/16,3 |
12 моль. |
Ответ: а) Э(Н2SO4) = 1; Z(Н2SO4) = 1; Mэ = 98 г/моль; nэ = 2 моль.
б) Э(Н2SO4) = ½; Z(Н2SO4) = 2; Mэ = 49 г/моль; nэ = 4 моль.
в) Э(Н2SO4) = 1/6; Z(Н2SO4) = 6; Mэ = 16,3 г/моль; nэ = 12 моль.
Обучающая задача 4
При соединении 5,6 г железа с серой образовалось 8,8 г сульфида железа. Определите эквивалентную массу железа Мж(Fe) и его эквивалент, если известно, что эквивалентная масса серы равна 16 г/моль.
Решение:
Fe + S = FeS
Из условия задачи следует, что в сульфиде железа на 5,6 г. Железа приходится
8,8 – 5,6 = 3,2 (г) серы.
Согласно закона эквивалентов, массы взаимодействующих веществ пропорциональны их эквивалентным массам. Поэтому:
m(Fe) |
m(S) |
M(Fe) |
m(Fe) M(S) |
5,6 16 |
2,8 (г/моль). |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
M(Fe) |
M(S) |
m(S) |
|
|
3,2 |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
Mэк = |
|
M(Fe) |
|
Z |
|
|
M |
|
|
|
56 |
2 |
||||
|
|
|
Z |
M эк (Fe) |
28 |
|||||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
так как Э = |
1 |
; Э = |
1 |
|
|
|
|
||||||
|
|
|
|
|
|
Z |
2 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Ответ: 28 г/моль; 1/2.
12
Задания для самоподготовки:
1.Плотность газа по кислороду равна 0,875. Определите молярную массу газа.
2.Масса 0,001 м3 газа (н.у.) равна 0,0021 кг. Определите молярную массу газа и его плотность по воздуху.
3.Масса 200 мл ацетилена при нормальные условиях равна 0,232 г. Определите молярную массу и количества вещества ацетилена.
4.Вычислите массу 500 мл паров ацетона, при 87 0С и давление 96 кПа (720 мм рт столба).
5.При 17 0С и давлении 104 кПа (780 мм рт столба) масса 624 мл газа равна 1,56 г. Вычислите молярную массу газа.
6.Рассчитайте объем: 2 моль метана; 5 г аммиака.
7.Вычислите массу 0,25 моль кислорода. Какой объем (н.у.) занимает это количество вещества? Сколько молекул кислорода содержится в этом объеме?
8.Определите, какое число молей и молекул содержится в 112 литрах аммиака? Какова масса этого объема газа?
9.Какое количество и какой объем (н.у.) вещества этана образовалось в результате реакции гидрирования 11,2 л этилена? Сколько это составляет молекул?
10.Какое количество и какой объем (н.у.) кислорода выделиться при разложении 6 моль пероксида водорода?
11.Вычислите массу и количество вещества гидроскида кальция, образовавшегося в результате взаимодействия 11,2 г оксида кальция с водой.
12.Рассчитайте количество вещества и объем оксида углерода (IV), который выделится при сгорании 11,2 г этилена (н.у.).
13.Какую массу и количество вещества хлорида аммония можно получить при взаимодействии 89,6 л аммиака с хлороводородной кислотой?
14.Определите эквивалент, число эквивалентности и молярные массы эквивалентов серной кислоты в следующих реакциях:
а) H2SO4 + NaOH = NaHSO4 + H2O; б) H2SO4 + 2NaOH = Na2SO4 + 2 H2O.
15. Определите эквивалент, число эквивалентность и молярную массу эквивалента хлороводородной кислоты в следующих реакциях:
а) HCI + NaOH = NaCI + H2O; б) 2HCl + Zn = ZnCI2 + H2.
16. Определите эквивалент, число эквивалентности и молярную массу эквивалента гидроксида кальция в реакциях:
а) Ca(OH)2 + HCI = CaOHCI + H2O; б) Ca(OH)2 + 2HCI = CaCI2 + 2H2O.
17.Рассчитайте молярную массу эквивалента и количество эквивалентов вещества оксида меди (II) массой 8 г? (Ответ: 40 г/моль; 0,2 моль/экв).
18.Рассчитайте молярную массу эквивалентов и массу вещества поваренной соли (хлорида натрия), взятого в количестве 2 моль.
19.Рассчитайте молярную массу эквивалента и количества эквивалентов веще-
ства AICI3 и вещества КОН в реакции: AICI3 + 3KOH = AI(OH)3 + 3KCI.
20.Определите эквивалент и молярную массу эквивалента кадмия, зная, что 14 г его соединяются с 16 г кислорода?
