
5094
.pdfМинистерство образования и науки Российской Федерации Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
«Хабаровская государственная академия экономики и права»
В. Л. Бутуханов, Л. П. Павлюченкова, И. А. Жарская
ХИМИЯ
Рекомендовано Дальневосточным региональным учебно-методическим центром (ДВ РУМЦ)
в качестве учебного пособия для студентов специальностей 080401 «Товароведение и экспертиза потребительских товаров» и 260501 «Технология продуктов общественного питания» вузов региона
Хабаровск 2008

ББК Г 4
Х 12
Химия : учебн. пособие для студентов заочной сокращённой формы обучения для специальностей 080401 «Товароведение и экспертиза потребительских товаров» и 260501 «Технология продуктов общественного питания» / сост. В. Л Бутуханов, Л. П. Павлюченкова, И. А. Жарская. под ред. Л.П. Павлюченковой. – Хабаровск : РИЦ ХГАЭП, 2008. – 68 с.
Рецензенты: завкафедрой органической химии и токсикологической химии Дальневосточного государственного медицинского университета доцент, канд. хим. наук Минаева Н. Н.; канд. хим. наук., доцент кафедры химии ТОГУ Чекмарёва Л.И.
Владимир Лаврентьевич Бутуханов Людмила Павловна Павлюченкова Ирина Анатольевна Жарская
ХИМИЯ
Учебное пособие для студентов заочной сокращённой формы обучения для специальностей 080401 «Товароведение и экспертиза потребительских
товаров» и 260501 «Технология продуктов общественного питания»
Редактор Г.С. Одинцова
Подписано в печать Формат 60 x 84/16
Бумага писчая. Офсетная печать. Усл. печ.л.___ Уч-изд.л. ___. Тираж 200 экз. Заказ ___.
680042, г. Хабаровск, ул. Тихоокеанская, 134, ХГАЭП, РИЦ © Хабаровская государственная академия экономики и права, 2008
|
3 |
|
|
СОДЕРЖАНИЕ |
|
Введение......................................................................................................................... |
4 |
|
Глава |
1. Неорганическая химия |
|
1.1. |
Растворы.............................................................................................................. |
5 |
1.2. |
Гидролиз солей................................................................................................... |
9 |
1.3. |
Произведение растворимости......................................................................... |
12 |
1.4. |
Окислительно-восстановительные реакции.................................................. |
13 |
1.5. |
Комплексные соединения................................................................................ |
17 |
Глава |
2. Физическая и коллоидная химия |
|
2.1. Основы химической термодинамики............................................................. |
20 |
|
2.2. Химическая кинетика....................................................................................... |
23 |
|
2.3. Электрохимические явления........................................................................... |
25 |
|
2.4. Поверхностные явления................................................................................... |
28 |
|
2.5. Классификация дисперсных систем. Строение коллоидных частиц............. |
31 |
|
2.6. Молекулярно-кинетические свойства коллоидных систем............................ |
34 |
|
Глава |
3. Органическая химия |
|
3.1. Жиры и масла.................................................................................................... |
36 |
|
3.2. Аминокислоты.................................................................................................. |
40 |
|
3.3. Белки – природные полимеры......................................................................... |
44 |
|
3.4. Углеводы (сахара)............................................................................................. |
47 |
|
3.5. Моносахариды.................................................................................................. |
48 |
|
3.6. Олигосахариды (сахароподобные полисахариды) дисахариды..................... |
56 |
|
3.7. Высокомолекулярные (несахароподобные) полисахариды............................ |
61 |
|
3.8. Крахмал................................................................................................................. |
61 |
|
3.9. Целлюлоза (клетчатка)........................................................................................ |
62 |
|
Библиографический список........................................................................................... |
67 |
|
4
ВВЕДЕНИЕ
Химия относится к числу естественных наук, являющихся одной из важных дисциплин, необходимых для подготовки технологов продуктов общественного питания и товароведов экспертов. Она изучает состав и строение веществ, зависимость свойств веществ от их состава и строения, условия и пути превращения одних веществ в другие. Данная дисциплина включает в себя теоретические основы, принципы и методы химического анализа веществ.
Органическая химия наряду с другими химическими дисциплинами является основой специальных дисциплин технологического цикла, как и товароведение продовольственных и непродовольственных товаров.
Основное внимание при изучении физической химии уделяется закономерностям протекания химических реакций: условиям равновесия химических реакций и зависимости равновесия от температуры, давления и концентрации. Важное значение имеет изучение свойств растворов электролитов и электрохимических явлений, являющихся основой многих методов исследования характеристик качеств товаров и процессов их производства.
Для технологических процессов большое значение имеют явления, протекающие на поверхности, такие как смачивание и сорбция, являющиеся предметом изучения коллоидной химии.
Химический анализ базируется на таких разделах химии, как строение атома, химическая связь, химическая кинетика и термодинамика, равновесие в реакциях кислотно-основного взаимодействия, комплексообразования, окисления-восстановления и осаждения.
5
ГЛАВА 1. НЕОРГАНИЧЕСКАЯ ХИМИЯ
1.1. Растворы
Растворами называют гомогенные (однородные) системы переменного состава, состоящие из двух или более независимых компонентов и продуктов их взаимодействия. Растворы могут быть в любых агрегатных состояниях: газообразных (смеси газов), жидких и твердых. Ниже рассматриваются жидкие системы. Различают растворы неэлектролитов и электролитов. Неэлектролитами называются вещества, растворы или расплавы которых не проводят электрического тока. К неэлектролитам относятся большинство органических соединений. Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами. К электролитам относятся кислоты, основания и почти все соли. Электролиты – проводники второго рода. В растворе или расплаве они распадаются на ионы, благодаря чему и протекает ток. Распад электролитов на ионы при растворении их в воде называется электрической диссоциацией.
Электролитическая диссоциация кислот, оснований и солей в воде
Характер ионов, образующихся при диссоциации разных электролитов, должен быть различным. Электролитическая диссоциация соединений зависит как от характера химических связей в них, так и от характера растворителя. Электролиты могут диссоциировать на ионы только в полярных растворителях (например, в воде). Свойства водных растворов кислот, оснований и солей определяются теми ионами, которые образуются в процессе электролитической диссоциации.
С точки зрения теории электролитической диссоциации, кислотами называют соединения, дающие в водных растворах ионы водорода (гидроксония). Примеры:
HCl → H+ + Cl-, H2SO4 → 2 H+ + SO42-.
Число способных к ионизации атомов водорода определяет основность кислоты. Ионы Н+ обусловливают характерные химические свойства кислот. Анионы кислотного остатка, образующиеся при диссоциации кислот, могут быть различными по составу.
В зависимости от разбавления и других условий многоосновные кислоты могут диссоциировать ступенчато, последовательно отщепляя один ион водорода за другим. Первый ион водорода отрывается от молекулы легче,

6
последующие всё труднее, так как возрастает заряд кислотного остатка. Способность многоосновных кислот диссоциировать ступенчато объясняет их склонность к образованию кислых солей. Так, для ортофосфорной кислоты можно представить 3 ступени диссоциации:
H3PO4 |
H+ + H2PO4- |
(K1 |
= 7,11∙10-3); |
H2PO4- |
H+ +HPO42- |
(K2 |
= 1,9∙10-6); |
HPO 2- |
H+ + PO 3- |
(K |
= 3,5∙10-13). |
4 |
4 |
3 |
|
где К1, К2 и К3 – представляют собой константы диссоциации каждой ступени при 25°С.
Основания можно определить как соединения, дающие в водном растворе гидроксид-ионы. Примеры:
KOH → K+ + OH-; NH4OH NH4+ + OH-;
Ba(OH)2 → BaOH+ + OH-, BaOH+ Ba2+ + OH-.
Число способных к ионизации гидроксидных групп определяет кислотность основания. Основания многоразрядных катионов могут диссоциировать ступенчато. Этим объясняется способность основания многовалентного металла образовывать основные соли.
Гидроксиды многих металлов в водных растворах могут диссоциировать и по кислотному, и по основному типам. Например, гидроксид цинка диссоциирует:
OH- |
OH- |
[Zn(H2O)4]2+ Zn(OH)2 (H2O)2 [Zn(OH)4]2-. |
|
H3O+ |
H3O+ |
При этом в щелочной среде равновесие сдвигается вправо, в кислой – влево. Оба процесса приводят к образованию очень слабого электролита H2O. Соединения, которые в зависимости от условий проявляют как кислотные, так и основные свойства, называются амфотерными, или амфолитами (от греч. «амфотерос» – обоюдный, двусторонний).
Ниже представлена схема диссоциации гидроксида алюминия (в упрощённом виде):
диссоциация как основания |
диссоциация как кислоты |
||
Al3+ |
+ 3OH- |
Al(OH)3 |
H+ + AlO2- + H2O |
|
|
|
. |
|
в кислой среде |
в щелочной среде |
|

7
Соли могут быть определены как соединения, дающие в водном растворе ионы металла (или сложных групп) и кислотного остатка. Примеры:
K3PO4 → 3K+ + PO43-
CaCl2 → Ca2+ + 2Cl-, K2SO4 → 2 K+ + SO42-
NH4NO3 → NH4+ + NO3- .
Рассмотренные средние соли являются сильными электролитами.
Кислые соли диссоциируют ступенчато, легко отщепляя вначале ионы металлов, а затем ионы водорода. Например:
KH2PO4 → K+ + H2PO4-; H2PO4- H+ + HPO42-
и HPO 2- |
H+ + PO 3-. |
4 |
4 |
В последних двух ступенях равновесие сдвинуто влево, поэтому ионов Н+ в растворе очень мало.
Основные соли также диссоциируют ступенчато, легко отделяя кислотный остаток, а затем гидроксид-ион ОН-. Например:
Cr(OH)2Cl Cr(OH)2+ + Cr-; Сr(OH)2- Cr(OH)2+ + OH-
и Cr(OH)2+ Cr3+ + OH-.
Некоторые гидроксосоли, легко отщепляя воду, переходят в оксосоли. Например:
Bi(OH)2Cl = BiOCl + H2O.
Оксосоли диссоциируют на оксониевый катион и анион кислоты:
BiOCl (BiO)+ + Cl-.
Количественную характеристику равновесного состояния электролита даёт его степень диссоциации (α), т.е. отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул. Это отношение часто множат на 100 и таким образом выражают диссоциированную часть в процентах от общего числа молекул. Говоря о степенях диссоциации электролитов, необходимо одновременно указывать и концентрацию растворов, поскольку изменение последнего параметра различно отражается на процессах ионизации и моляризации.
Электролиты, диссоциированные при указанных условиях на 30 % и больше, называют обычно сильными, диссоциированные в пределах от 30 % до 3 % –
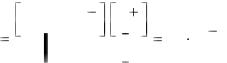
8
электролитами средней силы, ещё менее диссоциированные – слабыми электролитами.
Согласно современным представлениям сильные электролиты в водных растворах полностью диссоциированы на ионы. Однако экспериментальные данные (например, изменение электропроводности) показывают, что при увеличении концентрации сильного электролита как будто уменьшается степень диссоциации. Эти изменения объясняются не уменьшением числа диссоциированных молекул, а увеличением сил взаимного притяжения между противоположно заряженными ионами вследствие уменьшения расстояния между ними при увеличении концентрации раствора. Поэтому говорят о кажущейся степени диссоциации сильного электролита и активности ионов. В разбавленных растворах сильных электролитов силы взаимодействия между противоположно заряженными ионами незначительны и активность ионов близка к концентрации.
Степень диссоциации слабого электролита зависит от концентрации раствора. Величина эта тем больше, чем более разбавленным является раствор, и поэтому не может служить мерой диссоциации, т.е. мерой силы электролита. Способность слабого электролита диссоциировать на ионы характеризует константа электролитической диссоциации (К). Например, для уксусной кислоты, диссоциирующей по уравнению
СH3COOH 
константа диссоциации (Ка – константа кислотности; Кв – константа основности)
|
|
CH3COO |
H |
5 . |
|
K |
a |
|
|
1,8 10 |
|
|
|
||||
|
CH3COOH |
|
|||
|
|
|
|||
Величина К для данного вещества является постоянной и зависит главным образом от природы растворителя и от температуры. Константа диссоциации (слабого электролита) не зависит от его концентрации, поэтому она даёт более полную характеристику слабого электролита, чем степень диссоциации. Чем меньше К, тем меньше ионов в растворе, тем хуже диссоциирует данный электролит.
Чистая вода является слабым электролитом, диссоциирующим в очень малой степени по уравнению

9
H2O H+ + OH- (K = 1,8 10-16).
= 1,8 10-16).
Произведение равновесных концентраций ионов водорода и гидроксид-ионов есть величина постоянная при постоянной температуре. Это произведение называется ионным произведением воды (Кω):
Кω = [Н+][ОН-] = 10-14 (при 25°С)
Для чистой воды [Н+] = [ОН-] = 
 Кω =
Кω = 
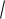 10 14 = 10-7 моль/л (при 25°С).
10 14 = 10-7 моль/л (при 25°С).
Водные растворы, в которых концентрации ионов водорода и гидроксидионов равны, называются нейтральными. В кислых растворах больше концентрации водородных ионов, в щелочных – гидроксид-ионов. В кислом растворе [Н+] > 10-7, в щелочном растворе [Н+] 10 моль/л.
Количественно реакцию среды принято выражать не концентрацией ионов [Н+], а её десятичным логарифмом, взятым с обратным знаком.
Эту величину называют водородным показателем [рН]:
рН= − lg [Н+].
В нейтральном растворе рН = 7, в кислом – значение рН < 7, в щелочном – значение рН > 7.
Реакцию среды чаще всего определяют с помощью индикаторов. Индикаторами называют вещества, имеющие различную окраску в зависимости от концентрации водородных ионов, т.е. в зависимости от рН среды. Интервал рН, в котором происходит изменение окраски индикатора, называют интервалом перехода окраски индикатора. Например, метиловый оранжевый изменяет окраску в кислой среде в интервале рН от 4,4 до 3,1; фенолфталеин изменяет окраску в интервале рН от 8 до 9,8. Для установления реакции среды обычно применяют лакмус. У лакмуса изменение окраски от красной до синей происходит в интервале рН от 5 до 8. Нередко для определения рН раствора пользуются универсальным индикатором и универсальной индикаторной бумагой (с цветной шкалой). Реакцию среды раствора часто приходится учитывать при выполнение химических реакций. Химические реакции в растворах электролитов происходят не между молекулами, а между ионами, поэтому их называют ионными. Эти реакции протекают в направлении образования труднорастворимых, летучих и малодиссоциирующих веществ.

10
1.2. Гидролиз солей
Гидролизу могут подвергаться химические соединения различных классов (соли, углеводы, белки, эфир, жиры и т.д.), но в неорганической химии нередко приходится иметь дело с гидролизом солей. Гидролизом соли называется взаимодействие ионов соли с ионами воды, в результате которого образуется малодиссоциированное или труднорастворимое вещество, смещается равновесие электролитической диссоциации воды и обычно изменяется рН раствора. В связи с этим растворы большинства солей имеют кислую или щелочную реакцию.
Если растворителем является не вода, то реакции взаимодействия между составными частями его молекул и растворенного вещества называются сольволизом. Следовательно, гидролиз является частным случаем сольволиза. Гидролиз («гидро» – вода, «лиз» – разложение) – разложение вещества водой. Гидролиз, согласно современным данным, является процессом сложным. Гидролиз соли рассматривают как результат поляризационного взаимодействия ионов данного вещества с их гидратной оболочкой: чем значительнее указанный процесс, тем интенсивней протекает гидролиз. Приведённые ниже простые записи уравнений реакций гидролиза солей в значительной степени является условными.
Гидролизу подвергаются соли, которые образованы: а) слабой кислотой и сильным основанием (например: K2CO3, Na2S, KCN, CH3COONa); б) сильной кислотой и слабым основанием (например: NH4Cl, CuSO4, ZnCl2); в) слабой кислотой и слабым основанием (например: (NH4)2CO3, CH3COONH4).
Гидролиз протекает различно в зависимости от силы кислоты и основания, образующих соль.
Соли, образованные сильными основаниями и сильными кислотами, гидролизу не подвергаются, так как при их взаимодействии с водой не могут быть получены слабые электролиты. В этом случае равновесие диссоциации воды (Н2О Н+ + ОН-) в присутствии ионов соли практически не смещается. Растворы таких солей имеют рН 7 (реакция среды практически нейтральная).
Соли, образованные очень слабой кислотой и очень слабым основанием, гидролизуются необратимо (см. знак равенства в уравнении):
Al2S3 + 6H2O = 2Al(OH)3 ↓ + 3H2S ↑.
