
Tomchuk_POSІB_VET_BІOHІMІJa
.pdf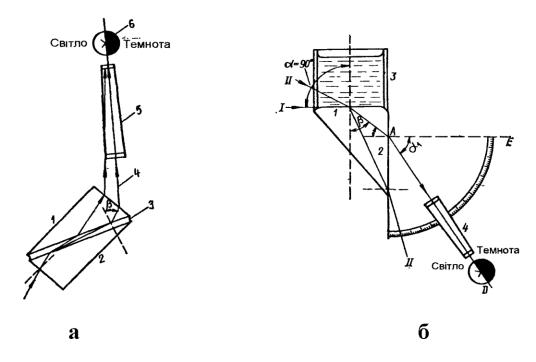
чення показника заломлення ±2·10–5, але потребує значної кількості досліджуваного розчину і монохроматора світла.
Рис. 1.11. Схема рефрактометра типа Аббе (а): 1 – вимірю-
вальна призма; 2 – освітлювальна призма; 3 – шар рідини; 4 – межові промені; 5 – зорова труба; 6 – поле зору; та схема рефрактометра типу Пульфриха (б): 1,2 – вхідна і вихідна вимірювальна призма відповідно; 3 – кювета для досліджуваної рідини; 4 – зорова трубка
Визначити концентрацію розчинів речовин рефрактометричним методом можна двома способами: розрахунковим та графічним. При розрахунковому способі використовують формулу, що відображає залежність між концентрацією розчину та його показником заломлення:
n = n0 + FC → C = (n – n0)/F,
де n – показник заломлення розчину; n0 – показник заломлення розчинника; F – рефрактометричний фактор; C – концентрація розчину (%).
Рефрактометричний фактор (F) демонструє зміну показника заломлення при зміні концентрації розчину на 1 %. Його встановлюють експериментально шляхом визначення показника залом-
51

лення для стандартних зразків, склад яких відомий, або розраховують за таблицями показників заломлення.
Табличні значення показників заломлення наводять при довжині хвилі λD = 589,3 нм (жовта лінія в спектрі натрію) і температурі 20 оС. При збереженні постійними довжини хвилі світла та умов проведення досліджень, від яких залежить показник заломлення, його значення будуть визначатись тільки природою середо - вища, які контактують.
При використанні графічного способу визначення концентрації розчину речовини будують калібрувальний графік у кординатах n-C, вимірюють показник заломлення розчину і за графіком знаходять відповідну концентрацію.
Рефрактометричний метод використовують для ідентифікації речовини; для кількісного визначення одно-, двота багатокомпонентних сумішей.
Рефрактометр ИРФ 454 Б2М
– найбільш зручний та перевірений на практиці у використанні прилад, який призначений для визначення показників заломлення неагресив-
них прозорих рідин та розчинів.
52
1.4. ХРОМАТОГРАФІЧНІ МЕТОДИ АНАЛІЗУ
Хроматографія – процес, заснований на багаторазовому повто-ренні актів сорбції та десорбції речовини при її переміщенні в потоці рухомої фази вздовж нерухомого сорбенту. Розподіл складних сумішей хроматографічним методом засновано на різній сорбції компонентів суміші. При протіканні цього процесу так звана рухома фаза (елюент), що містить аналізовану пробу, переміщується через нерухому фазу. Зазвичай нерухома фаза являє собою речовину з розвиненою поверхнею, а рухлива – потік газу або рідини, що фільтрується через шар сорбенту. При цьому відбувається багаторазове повторення актів сорбції – десорбції, що є характерною особливістю хроматографічного процесу і зумовлює ефективність хроматографічного розділення.
Якісний хроматографічний аналіз, тобто ідентифікація речо-
вини по його хроматограмі, може бути виконаний при порівнянні хроматографічних характеристик, найчастіше це утримуваного об’єму (тобто об’єму рухомої фази, пропущеної через колонку від початку введення суміші до появи даного компонента на виході з колонки), які знаходять при певних умовах для компонентів аналізованої суміші та для еталона.
Кількісний хроматографічний аналіз зазвичай проводять на хроматографі. Метод заснований на вимірюванні різних параметрів хроматографічного піка (висоти, ширини, площі і утримуваного об’єму), які залежать від концентрації речовин, що визначаються.
У кількісній газовій хроматографії застосовують методи абсо-
лютного градуювання і внутрішньої нормалізації, або нормування.
Використовується також метод внутрішнього стандарту. При абсолютному градуюванні експериментально визначають залежність висоти або площі піка від концентрації речовини і будують градуювальні графіки або розраховують відповідні коефіцієнти. Далі визначають ті ж характеристики піків в аналізованої суміші, і за градуювальним графіком знаходять концентрацію аналізованого речовини. Цей простий і точний метод є основним при визначенні мікродомішок.
При використанні методу внутрішньої нормалізації беруть суму будь-яких параметрів піків, наприклад суму висот всіх піків або суму їх площ, за 100 %. Тоді відношення висоти окремого піка до суми висот або відношення площі одного піку до суми площ при
53

множенні на 100 буде характеризувати масову частку (%) компонента в суміші. При такому підході необхідно, щоб залежність величини вимірюваного параметра від концентрації була однаковою для всіх компонентів суміші.
1.4.1 Класифікації хроматографічних методів
Існують різні види класифікації хроматографічних методів:
1. За агрегатним станом фаз (найголовніше в цій класифікації агрегатний стан рухомої фази):
газово-рідинна хроматографія; газово-твердофазна (газоадсорбційна) хроматографія; рідинно-рідинна хроматографія;
рідинна-твердофазна (рідинноадсорбційна) хроматографія; рідинно-гелева хроматографія;
2. За механізмами розділення (тобто характером взаємодії між сорбентом та сорбатом):
Адсорбційна хроматографія – розділення основане на відмінності в адсорбційній здатності речовин, що розділяються, твердим адсорбентом;
Розподільна хроматографія – розділення основане на відмінності в розчинності речовин, що розділяються, в нерухомій фазі (газова хроматографія) та на відмінності в розчинності речовин, що розділяються, в рухомій та нерухомій рідких фазах;
Іонообмінна хроматографія – розділення основане на відмінності в здатності речовин, що розділяються, до іонного обміну;
Гель-фільтрація або ексклюзивна хроматографія (гель-про-
никна, гель-фільтраційна хроматографія) – різновид хроматографії, в ході якої молекули речовин розділяються за розміром за рахунок їх різної здатності проникати в пори нерухомої фази. При цьому першими виходять з колонки найбільш великі молекули (більшої молекулярної маси), здатні проникати в мінімальне число пор стаціонарної фази. Останніми виходять речовини з малими розмірами молекул, які здатні вільно проникати в пори. На відміну від адсорбційної хроматографії, при гель-фільтрації стаціонарна фаза залишається хімічно інертною і не взаємодіє з речовинами, які розділяються;
54

Осадова хроматографія – розділення засновано на утворенні різних по розчинності осадів речовин, які розділяються, із сорбентом;
Адсорбційно-комплексоутворююча хроматографія – розді-
лення засновано на утворенні координаційних сполук різної міцності у фазі чи на поверхні адсорбента;
Афінна хроматографія (різновид лігандної). В основі останньої лежить реакція взаємодії речовин, що розділяються, з лігандом, який зв’язаний з інертним носієм. У разі афінної хроматографії розділяються біологічно активні речовини (білки, ферменти), що вступають з лігандом (теж, як правило, органічним) в специфічні біохімічні взаємодії. Наприклад: антитіло-антиген, гормон-рецептор тощо. Саме висока специфічність подібної взаємодії обумовлює високу ефективність афінної хроматографії і її широке поширення;
3. За метою проведення:
Аналітична хроматографія; Препаративна хроматографія; Промислова хроматографія;
4. За характером техніки, що застосовується:
Хроматографія на колонці – розділення речовин проводиться в спеціальних колонках;
Паперова хроматографія – поділ речовин проводиться на спеціальному папері;
Тонкошарова хроматографія – поділ речовин проводиться в тонкому шарі сорбенту.
У хроматографії на колонці та тонкошаровій хроматографії можна використовувати будь-який з наведених вище механізмів поділу, а паперовій хроматографії найчастіше застосовують розподільний і іонообмінний механізми.
5. За способом відносного переміщення фаз:
Елюєнтна хроматографія. Суміш, що аналізується вводять в
потік елюєнта у вигляді імпульсу. У колонці суміш розділяється на окремі компоненти, між якими знаходяться зони рухомої фази;
Фронтальна хроматографія Суміш подають в колонку, при цьому в розчині на виході із колонки визначають концентрацію кожного компоненту та будують графік в координатах концентрація речовини – об’єм розчину, який пройшов через колонку. Цю залежність називають хроматограмою чи вихідною кривою;
55

Витіснювальна хроматографія. В колонку, після подачі сумі-
ші для розділення, вводять спеціальну речовину-витіснювач, яка утримується сильніше за будь-який із компонентів суміші. Утворюються зони речовин, які розділюються.
Розглянемо більш детально окремі хроматографічні методи.
1.4.2 Тонкошарова хроматографія
Метод тонкошарової хроматографії (ТШХ) розроблено Н.А. Ізмайловим і М.С. Шрайбер у 1938 р. У методі ТШХ нерухома тверда фаза тонким шаром наноситься на скляну, металеву або пластмасову пластинку. У 2–3 см від краю пластинки на стартову лінію наносять пробу речовини, яка аналізується, і край пластинки занурюють в розчинник, який діє як рухлива фаза. Під дією капілярних сил розчинник рухається уподовж шару сорбенту та з різною швидкістю переносить компоненти суміші, що приводить до їх розділення. Дифузія в тонкому шарі відбувається в поздовжньому та поперечному напрямках, тому процес необхідно розглядати як двомірний.
Сорбційні властивості системи в ТШХ характеризуються хроматографічною рухливістю, тобто величиною Rf, яка розраховується із результатів експерименту згідно із рівнянням:
Rf = Хi / Xf,
де Хi – відстань від стартової лінії до центра зони i-го компонента;
Xf – відстань від стартової лінії, яку пройшов розчинник. Підкладки для сорбенту (пластинки) зазвичай виготовляють
із скла, алюмінієвої фольги або поліетерної плівки. В якості сорбенту в ТШХ застосовують силікагелі, оксид алюмінію, крохмаль, целюлозу. Вибір розчинника залежить від природи сорбенту і властивостей речовин, які аналізуються. Часто застосовують суміші розчинників із двох або трьох компонентів. Після закінчення хроматографування непроточним методом зони на хроматограмі проявляють хімічним або фізичним способом. При хімічному способі пластинку обприскують розчином реактиву, що взаємодіє з компонентами суміші. При фізичних способах прояву використовується здатність деяких речовин до флуорес-
56
ценції під дією ультрафіолетового випромінювання, часто при додаванні флуоресцентного індикатора, що взаємодіє з компонентами суміші. Після прояву хроматограми приступають до ідентифікації речовин і подальшого аналізу.
Якісний аналіз у ТШХ. Найбільш загальний підхід до якісного аналізу заснований на значеннях Rf. Хроматографічна рухливість є чутливою характеристикою речовини, проте вона істотно залежить від умов визначення. При дотриманні стандартних умов отримуються повторювані значення Rf, які можна використовувати в аналітичних цілях при порівнянні з табличними, якщо вони отримані за тих же умов досліду.
Найнадійнішим є метод свідків, коли на стартову лінію поряд із пробою наносяться індивідуальні речовини, які відповідають компонентам суміші. Вплив різних чинників на всі речовини будуть однаковими, тому збіг Rf компонента проби і одного зі свідків дає підставу для ототожнення речовин з врахуванням можливих відхілень. Розбіжність Rf інтерпретується однозначніше: воно вказує на відсутність в пробі відповідного компонента. На практиці стандартна речовина (свідок) у тому ж розчиннику наноситься на стартову лінію разом з аналізованою пробою та проводиться хроматографування за однакових умов.
Кількісний аналіз у ТШХ. Кількісні визначення можуть бути зроблені безпосередньо на пластинці, або після видалення речовини з пластинки. При безпосередньому визначенні на пластинці, вимірюють площу плями (наприклад, за допомогою міліметрової кальки) та по заздалегідь побудованому градуювальному графіку знаходять кількість речовини.
Найбільш точним вважається метод, в якому речовина після розділення віддаляється з пластинки і аналізується спектрофотометрично або іншим методом. Видалення речовини з пластинки зазвичай здійснюють механічним шляхом, хоча інколи застосовують вимивання відповідним розчинником.
1.4.3. Іонообмінна хроматографія
Іонообмінна хроматографія заснована на зворотному сте-
хіометричному обміні іонів, що знаходяться в розчині, на іони, які входять до складу іонообмінника. Синтетичні іонообмінники, які використовуються на даний час, володіють рядом важливих
57
переваг: вони мають високу обмінну ємкість, стійкі до дії кислот та лугів, не руйнуються у присутності багатьох окиснювачів і відновників тощо. Зазвичай синтетичним іонообмінником є високо полімерна сполука, наприклад поперечно-зшитий полістирол, що містить різні функціональні групи, які і визначають найбільш характерні властивості смол.
Типи іонообмінних смол. У залежності від знака функціональних груп іонообмінні смоли являються катіонітами чи аніонітами. Катіоніти містять функціональні кислотні групи (-SO3-; - COO-; -PO3-; -N(CH2CO2-)2). Функціональними групами аніонітів являються четвертинні –NR3+, третинні –NR2H+ чи первинні – NH3+ амонієві, пиридинові чи інші основи. Важливою характеристикою іонообмінника є його обмінна ємкість. Обмінну ємкість іоніту чисельно можна виразити кількістю молей еквіваленту протиіону на одиницю маси або об’єму смоли.
Методи іонообмінної хроматографії використовують переважно для розділення іонів. Проста методика іонообмінного розділення обумовлена поглинанням компонентів суміші іонітом і послідовному елююванні кожного компонента відповідним розчинником. Кількісні визначення компонентів після розділення можуть бути виконані будь-яким відповідним методом. Методами іонообмінної хроматографії визначають головним чином катіони лужних і лужноземельних металів.
1.4.4. Газова хроматографія
Газова хроматографія – це метод розділення летких компонентів, при якому рухливою фазою служить інертний газ (газносій), що протікає через нерухому фазу з великою поверхнею. Типова схема газового хроматографу представлена на рис. 1.12. У якості рухомої фази використовують водень, гелій, азот, аргон, вуглекислий газ. Газ-носій не реагує з нерухомою фазою і речовинами, що розділяються. Розрізняють газово-твердофазну та газово-рідинну хроматографію. У першому випадку нерухомою фазою є твердий носій (силікагель, вугілля, оксид алюмі-нію), в другому – рідина, нанесена на поверхню інертного носія. Розділення засноване на відмінностях в летючості і розчинності (або адсорбованості) компонентів суміші, що розділяється.
58

Рис. 1.12. Типова блок-схема газового хроматографу П р и м і т к а: 1 – джерело газу-носія (рухомої фази); 2 – регу-
лятор витрату газу-носія; 3 – пристрій введення приладу; 4 – хроматографічна колонка; 5 – детектор; 6 – електронний посилювач; 7 – реєструючий пристрій; 8 – прилад вимірювання витрат.
Цей метод можна використовувати для аналізу газоподібних, рідких і твердих речовин з молекулярною масою менше 400, які повинні задовольняти певним вимогам, головні з яких – термостабільність, летючість, інертність, легкість отримання. Цим вимогам повною мірою задовольняють, як правило, органічні речовини, тому газову хроматографію широко використовують як серійний метод аналізу органічних сполук.
Джерело газу-носія – це балон із газом, який знаходиться під великим тиском (до 150 атм). Частіше всього використовують гелій, рідше азот, ще рідше водень та інші гази.
Призначення регулятора витрати – контроль витрати газу в системі, а також підтримка необхідного тиску газу на вході в систему. Зазвичай для цього використовуються редуктор або дро - сель.
Пристрій введення проби. Призначений для подачі проби аналізованої суміші в хроматографічну колонку. Проба вводиться за допомогою мікрошприца шляхом проколювання еластичної прокладки. Об’єм проби, що вводиться, декілька мікролітрів.
Хроматографічні колонки. Під колонкою мається на увазі сосуд, довжина якого значно більше діаметру. Внутрішній діаметр колонок – 2–15 мм, а довжина – 1–20 м. Матеріалом для виготовлення колонок служить скло, неіржавіюча сталь, мідь, інколи фторопласт. Останнім часом найбільшого поширення набули капілярні колонки виготовлені з плавленого кварцу, з нанесеною усередині нерухомою фазою. Довжина подібних колонок може досягати
59
сотень і навіть тисяч метрів, хоча частіше використовуються колонки завдовжки 30–50 м. Украй важливе щільне наповнення колонок нерухомою фазою, а також забезпечення постійної температури колонки протягом всього процесу.
Носії нерухомих рідинних фаз. Тверді носії для диспергування нерухомої рідкої фази у вигляді однорідної тонкої плівки мають бути механічно міцними з помірною питомою поверхнею (близько 20 м2/г), невеликим і однаковим розміром часток, а також бути досить інертними, щоб адсорбція на поверхні розділу твердої і газоподібної фаз була мінімальною. Найслабкіша адсорбція спостерігається на носіях з силанізованого хромосорбата, скляних гранул і флуоропака (фторвуглеводний полімер). Крім того, тверді носії не повинні реагувати на підвищення температури і повинні легко змочуватися рідкою фазою.
Детектор – це пристрій, призначений для виявлення в потоці газу-носія аналізованих речовин по якій-небудь физико-хімічній властивості. Відгук здійснюється за рахунок перетворення властивостей в електричний сигнал. Детектори підрозділяються на інтегральні та диференціальні. Інтегральний детектор реєструє зміни в часі сумарної кількості компонентів, що виходять з колонки. Всі газохроматографічні детектори, що серійно випускаються, є диференціальними. Сигнал таких детекторів пропорційний миттєвій зміні значення якої-небудь властивості газового потоку, а її аналоговий запис має вигляд піку. Хроматограма, яка отримана з використанням такого детектору, представляє ряд піків, причому кількість кожного компонента пропорційна площі відповідного піку.
В процесі детектування хімічна природа молекули аналізованої речовини може змінюватися або ні. Якщо природа молекули змінюється (процес руйнування молекули), то вона може бути зареєстрована лише разово. Якщо ж природа молекули не змінюється, то така молекула може бути зареєстрована детектором багато разів. Детектори, в яких можлива багаторазова реєстрація молекул, називаються концентраційними, оскільки їх сигнал пропорційний концентрації речовини в газі-носієві. Прикладом концентраційного детектора є детектор по теплопровідності (ДТП), в якому процес відведення теплоти від чутливих елементів не руйнує молекул аналізованих речовин. Детектори, в яких можлива лише одноразова реєстрація молекул, називаються потоковими, оскільки їх сигнал пропорційний потоку речовини. Як типовий приклад потокового
60
